 Робоча група: В.М. Коваленко, М.М. Долженко, О.С. Сичов, Ю.А. Іванів, С.В. Поташев, Л.М. Грубяк
Робоча група: В.М. Коваленко, М.М. Долженко, О.С. Сичов, Ю.А. Іванів, С.В. Поташев, Л.М. Грубяк
Емболії з серця або грудної аорти часто призводять до клінічно-значущої захворюваності та смертності внаслідок розвитку транзіторних ішемічних атак (ТІА), емболічних інсультів (ЕІ) або оклюзій периферичних артерій. Трансторакальна (ТТЕхоКГ) та черезстравохідна (ЧСЕхоКГ) ехокардіографія (ЕхоКГ) є ключовими діагностичними засобами оцінки, діагностикита лікування у випадку інсульту, системних емболій або емболій гілок легеневої артерії (ТЕЛА). Даний документ представляє експертні рекомендації Українського товариства кардіологів та Всеукраїнської громадської організації «Асоціація фахівців з ехокардіографії» з використання ЕхоКГ в оцінці кардіальних джерел емболій. Він описує загальні механізми розвитку інсультів, системних емболій та ТЕЛА та роль ЕхоКГ в оцінці, діагностиці та лікуванні наслідків емболій з кардіальних та аортальних джерел, включаючи зростаючу роль контрастної та трьохвимірної (3D) ЕхоКГ. Окремі рекомендації вироблені для кожної категорії емболічних джерел, включаючи ліве передсердя та його вушко, лівий шлуночок, серцеві клапани, пухлини серця та грудну аорту. На додаток, в документ включені рекомендації щодо використання ЕхоКГ при ТЕЛА та при емболіях, пов’язаних з кардіохірургічними та перкутанними втручаннями. Також ці рекомендації включають розділ, що стосується кардіальних джерел емболій в педіатричній популяції.
Ключові слова: кардіальні емболії, кріптогенний шок, кардіальні маси, кардіальні пухлини, внутрішньосерцеві шунти, вегетації, клапанні протези, атеросклероз аорти, внутрішньосерцевий тромбоз.
Зміст
Перелік умовних скорочень
Вступ
Методологія
Загальні положення про інсульти та системні емболії
Класифікація інсультів
Тип та порівняльний емболічний потенціал різних кардіальних джерел емболій
Діагностичний алгоритм у пацієнтів з потенційними кардіальними джерелами емболій
Профілактика та лікування
Роль ехокардіографії в діагностиці джерел емболій
Критерії ехокардіографічної оцінки кардіальних джерел емболій
Критерії відповідності використання ехокардіографії для діагностики кардіальних джерел емболій
Відповідне використання: трансторакальна ехокардіографія (ТТЕхоКГ)
Відповідне використання: черезстравохідна ехокардіографія (ЧСЕхоКГ)
Невизначенні показання для використання: ТТЕхоКГ
Невизначенні показання для використання: ЧСЕхоКГ
Невиправдане використання: ТТЕхоКГ
Невиправдане використання: ЧСЕхоКГ
Практичні аспекти: ехокардіографічні методики для діагностики кардіальних джерел емболій
Двовимірна високочастотна та базова візуалізація
Трьохвимірна та мультипланова візуалізація
Констрастування фізіологічним розчином та транспульмонарне контрастування
Кольорове допплерівське картування, проміжні позиції та фокусні зображення
Порівняльна характеристика ТТЕхоКГ та ЧСЕхоКГ
Рекомендації з використання ЕхоКГ у пацієнтів з потенційним кардіальних джерелом емболій
ЕхоКГ є рекомендованою
ЕхоКГ є потенційно корисною
ЕхоКГ не є рекомендованою
Порівняльна характеристика ТТЕхоКГ та ЧСЕхоКГ
Альтернативні засоби візуалізації кардіальних джерел емболій
Нейровізуалізація: комп’ютерна томографія та магнето-резонансна томографія
Транскраніальна допплерографія (ТКД)
Ядерна кардіологія
КТ грудної клітки
МРТ грудної клітки
Рекомендації з альтернативних засобів візуалізації в діагностиці кардіальних джерел емболій
Альтернативні рекомендовані засоби візуалізації
Альтернативні нерекомендовані засоби візуалізації
Тромбоемболії з ЛП та ВЛП
Патогенез тромбоутворення та тромбоемболійз передсердь
ЕхоКГ оцінка ЛП та ВЛП
Кардіоверсія
Ізоляція легеневих вен
Спостереження за перкутанними процедурами на ВЛП
Рекомендації з виконання ЕхоКГ у пацієнтів з підозрою на тромбоз ЛП та ВЛП
ЕхоКГ є рекомендованою
ЕхоКГ є потенційно корисною
ЕхоКГ не є рекомендованою
Тромбоемболії з лівого шлуночка
Гострі коронарні синдроми
Кардіоміпатії
Морфологія тромбів ЛШ
Роль ЕхоКГ в діагностиці тромбів ЛШ
Рекомендації з ЕхоКГ у пацієнтів з підозрою на тромбоз
ЕхоКГ є рекомендованою
ЕхоКГ є потенційно корисною
ЕхоКГ не є рекомендованою
Клапанна патологія
Інфекційний ендокардит
Діагностика
Прогноз
Рекомендації з ЕхоКГ у пацієнтів з підозрою на ІЕ
ЕхоКГ є рекомендованою
ЕхоКГ є потенційно корисною
ЕхоКГ не є рекомендованою
Небактеріальний тромботичний ендокардит
Верукозний (бородавчастий) ендокардит або ендокардит
Дегенеративний ендокардит або НБТЕ
Рекомендації з ЕхоКГ у пацієнтів з підозрою на неінфекційний ендокардит
ЕхоКГ є рекомендованою
ЕхоКГ є потенційно корисною
ЕхоКГ не є рекомендованою
Папілярні фіброеластоми
Клапанні тяжі та нарости Ламбла
Кальциноз мітрального кільця
Рекомендації з ЕхоКГ у пацієнтів з КМК
ЕхоКГ є потенційно корисною
Тромбоз клапанних протезів
Діагностика
Діагностика тромбозів клапанних протезів за допомогою ЧСЕхоКГ
Емболічні ускладнення інтервенційних втручань
Рекомендації з ЕхоКГ у пацієнтів з тромбозом клапанних протезів
Пухлини серця
ЕхоКГ оцінка пухлин серця
Міксоми
Папілярна фіброеластома
Рекомендації з ЕхоКГдіагностики та оцінки пухлин серця
ЕхоКГ є рекомендованою
ЕхоКГ є потенційно корисною
ЕхоКГ не є рекомендованою
Емболії з грудної аорти
Роль ЕхоКГ в візуалізації атеросклеротичних бляшок аорти
Рекомендації з ЕхоКГдіагностики та оцінки аортальних джерел емболії
ЕхоКГ є рекомендованою
ЕхоКГ є потенційно корисною
ЕхоКГ не є рекомендованою
Парадоксальна емболія
Роль ЕхоКГ в діагностиці при підозрі на парадоксальну емболію
Рекомендації з ЕхоКГдіагностики та оцінки при підозрі на парадоксальну емболію
ЕхоКГ є рекомендованою
ЕхоКГ є потенційно корисною
ЕхоКГ не є рекомендованою
Емболія гілок легеневої артерії
Роль ЕхоКГ в діагностиці ТЕЛА
Рекомендації з ЕхоКГдіагностики та оцінки при підозрі наТЕЛА
ЕхоКГ є рекомендованою
ЕхоКГ не є рекомендованою
Кардіоемболії та емболії з аорти підчас кардіохірургічних та перкутанних втручань
Катетеризація серця
Кардіохірургія
Перкутанні втручання
Рекомендації з ЕхоКГ у пацієнтів, госпіталізованих для кардіохірургічних або перкутанних втручань
ЕхоКГ є рекомендованою
Інсульти в педіатричній популяції
Роль ЕхоКГ в діагностиці системних емболій у педіатричних пацієнтів
Рекомендації з ЕхоКГ у педіатричних пацієнтів з підозрою на системну емболію
ЕхоКГ є рекомендованою
ЕхоКГ є потенційно корисною
Додаткові джерела
Література
Перелік умовних скорочень
АВМ – артеріо-венозна мальформація
АК – аортальний клапан
АМПП – аневризма міжпередсердної перегородки
АТЕС – аортальний тромбоемболічний синдром
АТС – аортальний тромбоемболічний синдром
ВВС – вроджена вада серця
ВЛП – вушко лівого передсердя
ВОВ – відкрите овальне вікно
ГІМ – гострий інфаркт міокарда
ГКС – гострий коронарний синдром
ДМПП – дефект міжпередсердної перегородки
ДМШП – дефект міжшлуночкової перегородки
ІЕ – інфекційний ендокардит
ІІ – ішемічний інсульт
КЕІ – кардіоемболічний інсульт
КМК – кальциноз мітрального кільця
КМП – кардіоміопатія
КТ – комп’ютерна томографія
ЛВ – легеневі вени
ЛП – ліве передсердя
ЛШ – лівий шлуночок
МК – мітральний клапан
МПП – міжпередсердна перегородка
МРТ – магнитно-резонансна томографія
МС – мітральний стеноз
МСКТ – мультиспіральна комп’ютерна томографія
НБТЕ – небактеріальний тромбендокардит
НПВ – нижня порожниста вена
ПП – праве передсердя
ПФЕ – папілярна фіброеластома
ПШ – правий шлуночок
СВ – серцевий викид
СХЕ – синдром холестеринової емболії
СЧВ – системний червоний вовчак
ТЕЛА – тромбоемболія гілок легеневої артерії
ТІА – транзиторна ішемічна атака
ТКД – транскраніальна допплерографія
ТТЕхоКГ – трансторакальна ЕхоКГ
ФП – фібриляція передсердь
ФР – фактор ризику
ФСК – феномен спонтанного контрастування
ЧСЕхоКГ – черезстравохідна ЕхоКГ
ШВР – штучний водій ритму
2D – двовимірна, В-режим
3D – трьохвимірна
ASE – Американське товариство ехокардіографії
PLAX – парастернальна позиція по довгій вісі ЛШ
PSAX – парастернальна позиція по короткій вісі ЛШ
TAVR (TAVI) – транскатетерне протезування (імплантація) АК
Вступ
Емболії з серця або грудного відділу аорти часто призводять до клінічно значущих захворюваності та смертності внаслідок розвитку транзиторних ішемічних атак (ТІА), інсультів або оклюзій периферичних артерій. Інсульт є одним з чільних чинників смертності в Україні та в світі. Ехокардіографія (ЕхоКГ) є цінним засобом візуалізації в діагностиці, оцінці та веденні хворих з інсультами та системними емболіями. Емболії з кардіальних джерел відповідають приблизно за третину всіх випадків ішемічного інсульту (ІІ). Парадоксальні емболії та емболії з грудної аорти, особливо вмістом атером, відповідні за інші додаткові причини інсультів та системних емболій. Дані рекомендації є першими специфічними рекомендаціями Українського товариства кардіологів та Всеукраїнської громадської організації «Асоціація фахівців з ехокардіографії», присвяченими цій актуальній тематиці.
Методологія
Дані рекомендації базуються на ретельному та поширеному огляді літературних джерел, включаючи всі інші відповідні рекомендації Європейської асоціації серцево-судинної візуалізації (EACVI) та Американського товариства ехокардіографії (ASE)[1], а також інших національних та міжнародних медичних товариств. В них викладені переважно експертні консенсусні погляди, тому що з багатьох тем, що обговорюються в даних рекомендаціях доказові дані рандомізованих досліджень до сьогодні відсутні. Всі рекомендації викладені в однаковому форматі для всіх обговорених тематик. Є три рівня рекомендацій: ЕхоКГ є рекомендованою, ЕхоКГ є потенційно корисною та ЕхоКГ не є рекомендованою. Колектив авторів робочої групи сподіваються, що ці рекомендації допоможуть в стандартизації ЕхоКГ діагностики пацієнтів з кардіальними джерелами емболій та поліпшенні надання медичної допомоги таким пацієнтам в Україні.
Загальні положення про інсульти та системні емболії
Інсульт, вірогідно емболічного генезу, був вперше описаний давньогрецьким лікарем Гіппократом (460–370 до н.е.). Він також увів термінапоплексія (αποπληξια, «насильницьке збиття з ніг»), який сторіччями використовувався для описання того, що сьогодні носить назву інсульту або цереброваскулярних судинних подій. В 1847 німецький патолог Рудольф Вірхов (1821–1902) забезпечив перші докази тромбоемболічної природи деяких інсультів. Кожного року в США відбувається більше 795,000 первинних або повторних інсультів (610,000 первинних та 185,000 повторних). За статистикою 6,9 мільйонів американців старше 20 років перенесли інсульт (2,7% усіх чоловіків та 2,6% усіх жінок в США). Дуже високою є частота «німих» ішемічних інсультів (від 6 до 28%). Інсульт є третьою найчастішою причиною смертності в західних країнах (після онкозахворювань та серцево-судинної патології), що відповідає за кожну 19-ту смерть в США. В 2009 р. фінансовий тягар прямих та непрямих витратів на лікування інсультів в США склав $36,5 мільярдів [2]. Передвісниками 15% всіх інсультів є ТІА, що визначаються як локальний неврологічний дефіцит, що триває <24 годин.
Класифікація інсультів
Приблизно 87% всіх інсультів є ішемічними, решта 13% - геморагічними. Згідно реєстру TrialofOrg 10172 з критеріїв лікування гострого інсульту [3], ішемічні інсульти можна поділити на наступні типи:
1. Тромбоз або емболія, асоційовані з атеросклерозом.
2. Емболії кардіального генезу (кардіоемболічний інсульт).
3. Оклюзії судин малого діаметру (лакунарний інсульт).
4. Інші визначені причини.
5. Невизначені (криптогенні) причини (причина невизначена, більше однієї причини, неповне обстеження).
Частота кожної з причин є варіабельною та залежить від віку, статі, раси пацієнта, географічного положення, супутніх факторів ризику (ФР), даних анамнезу, об’єктивних знахідок та результатів додаткових досліджень. Дані рекомендації присвячені головним чином кардіоемболічним інсультам, включаючи також роль ЕхоКГ при оцінці емболічних інсультів з джерелом в грудному відділі аорти (атероемболії) та при криптогенних інсультах. Емболії кардіального походження відповідають за різними даними за 15 – 40% всіх ішемічних інсультів [4], в той час як криптогенні причини відповідають за приблизно 30 – 40% випадків [5].
Типи та відносний емболічний потенціал кардіальних джерел емболій
У пацієнтів з ФР, або тих, що вже перенесли потенційно емболічного ґенезу ішемічний інсульт, первинна роль ЕхоКГ полягає у визначенні існування джерела емболії, вірогідності такого джерела як правдоподібної причини інсульту або системної емболії та визначенні тактики лікування даного індивіду.
Кардіальні джерела емболії включають кровяні тромби, фрагменти пухлин, інфекційні та неінфекційні вегетації та атеросклеротичний детрит. Стани, що відомі, як такі, що можуть призводити до системної емболізації, перелічені в Таб. 1, та розподілені на групи високого ризику та низького ризику відповідно до свого емболічного потенціалу. Втім, при багатьох станах можуть мати місце більше одного джерела емболії (співіснування емболічних джерел) або один емболічний стан може викликати інший (взаємозалежність емболічних джерел). Наприклад, мітральний стеноз (МС) асоціюється із феноменом спонтанного контрастування (ФСК), фібриляцією передсердь (ФП), тромбозом лівого передсердя (ЛП) та ризиком інфекційного ендокардиту (ІЕ).
Таб. 1.Класифікація кардіальних джерел емболії.
|
Високий ризик емболії
|
|
1. Внутрішньосерцеві тромби
А. Передсердні аритмії
1)Клапанна ФП
2) Неклапанна ФП
3) ТП
Б. ІХС
1) Недавно перенесений ГІМ
2) ПІК, особливо з хронічною аневризмою ЛШ
В. Неішемічні КМП
Г. Клапанні протези та імплантовані пристрої
2. Внутрішньосерцеві вегетації
1)Ендокардит нативних клапанів
2) Ендокардит клапанних протезів
Д. Неклапанний ендокардит
3. Внутрішньосерцеві пухлини
1) Міксома
2) ПФЕ
3) Інші пухлини
4. Атероматоз аорти
1)Тромбоемболії
2) Холестеринові емболії
|
|
Низький ризик емболії
|
|
1. Потенційні попередники внутрішньосерцевого тромбозу
1)ФСК (за відсутності ФП)
2) Аневризма ЛШ без тромбозу
3) Пролапс МК з міксоматозною дегенерацією (хвороба Барлоу)
2. Внутрішньокардіальні кальцифікати
1) Кальциноз мітрального кільця
2) Кальцинуючий аортальний стеноз
3. Клапанні аномалії
1)Ніті фібрину
2) Гігантські нарости Ламбла
4. Септальні дефекти та аномалії
1)ВОВ
2)Аневризма МПП
3)ДМПП
|
Діагностичний алгоритм у пацієнтів з потенційними кардіальними джерелами емболії
Оцінка підозр на кардіальні джерела емболії вимагає швидкої діагностики, що має включати детальний анамнез, адекватне об’єктивне обстеження, необхідні лабораторні аналізи крові та візуалізацію серця та органів, що постраждали від емболії. ЕхоКГ має бути засобом візуалізації серця першої лінії, дані якої підкріплюються рентгенографією органів грудної клітки, комп’ютерною томографією (КТ), магнето-резонансною томографією (МРТ), та іншими радіологічними засобами візуалізації за необхідності. КТ та МРТ разом з ангіографією можуть бути незамынними при діагностиці органів та тканин, що постраждали від кардіоемболії.
Профілактика та лікування
ЕхоКГ відіграє важливу роль не тільки в діагностиці, але й в лікуванні та профілактиці емболій з кардіальних джерел. Але даний аспект ЕхоКГ лежить за межами завдать даних рекомендацій, але з посиланнями на відповідні рекомендації.
Роль ЕхоКГ в діагностиці джерел емболії
З самого початку втілення в клінічну практикуЕхоКГ вважалася важливим інструментом діагностики можливих кардіальних джерел емболій. Навіть М-режим, вперше втілений шведським кардіологом Інге Едлером (1911 – 2001) та інженером Хельмутом Гертцем (1920 – 1990), був здатен виявляти певні стани, що асоціюються з емболічними інсультами та системними емболія ми, такі як МС, дилатація ЛП, міксома ЛП та систолічна дисфункція лівого шлуночка (ЛШ).
Застосування двохвимірної ЕхоКГ (В-режим) в ранніх 1970-х рр.. значно розширив діагностичні можливості та точність ультразвукової (УЗ) візуалізації при діагностиці кардіальних джерел емболій за рахунок того, що зросла здатність виявлення порушень скоротливості та роздільна здатність візуалізації різних нормальних та патологічних кардіальних структур.
Застосування допплерографії в 1970-х та черезстравохідної (ЧСЕхоКГ) ЕхоКГ у 1980-х дозволили здійснювати більш точну кількісну оцінку різноманітних нормальних та патологічних внутрішньокардіальних структур та потоків крові. Врешті решт, втілення в клінічну практику тривимірної ЕхоКГ в режимі реального часу (3D-ЕхоКГ) на початку 21 сторіччя забезпечило безпрецедентну анатомічну та функціональну деталізацію багатьох кардіальних структур, що здатні бути джерелами емболійта дозволило інтраопераційне керування кардіальних джерел емболії, в тому числі за допомогою перкутанних інвазивних втручань (напр., перкутанне закриття вушка ЛП (ВЛП) при ФП).
Загалом, використання ЕхоКГ в діагностиці та оцінці кардіальних джерел емболій має відповідати певним критеріям відповідності [6], наприклад експертним критеріям, наведеним нижче.
Критерії виправданого використання ЕхоКГ при оцінці кардіальних джерел емболій
Виправдане застосування: Трансторакальна ЕхоКГ (ТТЕхоКГ)
-
Симптоми або стани потенційно пов'язані з підозорою на кардіальну етіологію, включаючи біль в грудях, задишку, серцебиття, ТІА, інсульт або периферічна емболічна подія, та не тільки.
-
Підозра на об'ємне утворення серця.
-
Підозра на серцево-судинне джерело емболу.
-
Початкова діагностика при підозрі на інфекційний ендокардит (ІЕ) з позитивними результатами культури крові або новими шумами в серці.
-
Повторна оцінка плину ІЕ при високому ризику прогресування або ускладнень або при наявності явних змін об'єктивного стану хворого або результатів додаткових обстежень.
-
Доведена тромбоемболія гілок легеневої артерії (ТЕЛА) для вибору тактики терапії (напр., тромбектомія або троболізис).
-
Повторна оцінки при доведеній ТЕЛА після тромболітизису або тромбектомії для оцінки змін стану морфології та функції правого шлуночка (ПШ) та / або тиску в ЛА.
Виправдане застосування: Черезстравохідна ЕхоКГ (ЧСЕхоКГ)
-
Метод першої лінії або допоміжний при оцінці серцево-судинного джерела емболії при відсутності доведеного екстракардіального джерела.
-
Метод першої лінії або допоміжний для діагностики ІЕ з помірною або високою вірогідністю (напр., staph. бактеріемія, фунгемія, імплантований клапанний протез або внутрішньосерцевий пристрій).
-
Метод першої лінії для оцінки та прийняття рішення відносно антикоагуляції, кардіоверсії при персистуючих тахіаритміях та / або радіочастотної абляції
Невизначена доцільність застосування: ТТЕхоКГ
-
Пошук серцево-судинного джерела емболії при попередньо визначеному екстракардіальному джерелі
Невиправдане застосування: ТТЕхоКГ
-
Транзиторна лихоманка без доказів бактеріеміїабо нових шумів в серці.
-
Транзиторна бактеріемія патогеном, що типово не асоціюється з ІЕ та / або документоване неендоваскулярно джерело інфекції.
-
Рутинне динамічне спостереження при неускладненому ІЕ, якщо немає потреби в змінах в лікуванні
-
Підозра на ТЕЛА (для первинної діагностики
-
Рутинне динамічне спостереження при нормальній функції ПШ та систолічному тиску в ЛА.
Невиправдане застосування: ЧСЕхоКГ
-
Пошук серцево-судинних джерел емболії при вже відомих доведених кардіальних джерелах, коли результати ЧСЕхоКГ не вплинуть на лікування.
-
Рутинне використання ЧСЕхоКГ коли ТТЕхоКГ є інформативним та вирішує всі діагностичні та тактичні завдання.
-
Динамічне спостереження за динамікою попередніх знахідок підчас ЧСЕхоКГ (напр., зникнення тромба після антикоагулянтів, розрішення вегетацій після антибіотикотерапії), якщо не передбачається змін у терапії.
-
Для діагностики ІЕ при низькій вірогідності та ступені підозри (напр., транзиторна лихоманка, відоме альтернативне джерело інфенкції, негативні результати посівів крові або атиповий для ІЕ патоген).
-
Оцінка необхідності призначення антикоагулянтів, якщо не планується кардіоверсія.
Практична перспектива: ЕхоКГ методики діагностики кардіальних джерел емболії
ЕхоКГ відіграє важливу роль в діагностиці, оцінці та веденні пацієнтів з кардіальними та аортальними джерелами емболії [7]. Стандартні трансторакальна (ТТЕхоКГ) та ЧСЕхоКГ є дуже корисними, із значним збільшенням діагностичної точності при використанні додаткових методик візуалізації протягом дослідження [8], що включають використання як високочастотних, так і фундаментальних зображень, проміжних та нестандартних позицій та зрізів, фокусних зображень окремих камер та використання багатьої площин сканування та 3D-ЕхоКГ та використання УЗ-контрастів. Сумація цих технологій викладена в Таб. 2.
Таб. 2. ТТЕхоКГ та ЧСЕхоКГ: рекомендовані методики візуалізації джерел емболії.
|
Джерело кардіоемболії
|
ТТЕхоКГ
|
ЧСЕхоКГ
|
|
Передсердні аритмії
|
-
Фокусні зрізи передсердь та їх вушок з множинних доступів (PLAX, PSAX, апікальні, А2С для ВЛП)
-
Візуалізація з усіх можливих позицій
-
ЕхоКГ у 3D, краще з парастернального доступу для кращої роздільності
-
Високочастотні зображення
-
Внутрішньовенне контрастування
|
-
Фокусні зрізи передсердь та їх вушок з множинних доступів
-
Візуалізація з усіх можливих позицій
-
ЕхоКГ у 3D для деталізації анатомії передсердь та їх структур
-
Високочастотні зображення
-
Внутрішньовенне контрастування
|
|
Клапанна патологія:
-
Механічні протези
-
Ревматичні вади
|
-
Класичні позиції
-
Фокусні зрізи спереду та сзаду, вище та нижче клапану (-ів)
-
ЕхоКГ у 3Dможе вимагати нестандартних вікон зображення для кращої роздільної
-
КДК (з фокусуванням)
|
-
Класичні позиції
-
Фокусні зрізи спереду та сзаду, вище та нижче клапану (-ів)
-
ЕхоКГ у 3Dдля кращої оцінки (деталізації) клапанних та пов’язаних структур та відповідних анатомічних настідків
-
КДК (з фокусуванням)
|
|
Ендокардит
|
-
Високочастотні та фундаментальні зображення
-
Фокусні зрізи спереду та сзаду, вище та нижче клапану (-ів)
-
ЕхоКГ у 3D, краще з парастернального доступу для кращої роздільності
-
КДК
|
-
Високочастотні та фундаментальні зображення
-
Фокусні зрізи спереду та сзаду, вище та нижче клапану (-ів)
-
ЕхоКГ у 3D (для кращої оцінки розмірів та точок прикріплення)
-
КДК
|
|
Неішемічні та ішемічні КМП
|
-
Високочастотні та фундаментальні зображення (з фокусними зрізами)
-
Фокусні зрізи спереду та сзаду, вище та нижче з множинних доступів з та без «гармоніки»
-
ЕхоКГ у 3D та візуалізація з усіх можливих позицій
-
В/в контрастування
-
КДК (особливо у випадках аневризм стінок для виявлення ДМШП)
|
-
Фокусні зрізи спереду та сзаду, вище та нижче з множинних доступів, особливо з трангастрального доступу для фокусу на ЛШ/ПШ
-
В/в контрастування
-
ЕхоКГ у 3D та візуалізація з усіх можливих позицій
-
КДК (особливо у випадках аневризм стінок для виявлення ДМШП)
|
-
Внутрішнькардіальні об'ємні утворення (маси)
|
|
Внутрішньопорожнинні тромби, вегетації (дегенеративні або інфекційні)
|
-
Високочастотні та фундаментальні зображення (з фокусними зрізами)
-
Фокусні зрізи спереду та сзаду, вище та нижче з множинних доступів з та без «гармоніки»
-
Некласичні / нестандартні доступи (для кращого визначення локалізації)
-
ЕхоКГ у 3D та візуалізація з усіх можливих позицій
-
В/в контрастування
|
-
Високочастотні та фундаментальні зображення (з фокусними зрізами)
-
Фокусні зрізи спереду та сзаду, вище та нижче з множинних зрізів
-
ЕхоКГ у 3D та візуалізація з усіх можливих позицій
-
В/в контрастування
|
|
Внутрішньсерцеві пухлини, фіброеластома
|
-
Фокусні зрізи спереду та сзаду, вище та нижче з множинних доступів з та без «гармоніки»
-
ЕхоКГ у 3D та візуалізація з усіх можливих позицій (для кращого визначення локалізації прикріплення, розмірів та контурів)
-
В/в контрастування (для деталізації меж та васкуляризації)
|
-
Фокусні зрізи спереду та сзаду, вище та нижче з множинних зрізів
-
ЕхоКГ у 3D та візуалізація з усіх можливих позицій (для кращого визначення локалізації прикріплення)
-
В/в контрастування (для деталізації меж та васкуляризації)
|
|
Тромбоемболії з грудного відділу аорти
|
-
Додаткові 2D-доступи, такі як правий парастернальний та високий лівий парастернальній, зріз короткої вісі з супрастернального доступу
-
Фокусні зрізи спереду та сзаду, вище та нижче з множинних доступів / латеральніше та медіальніше з та без «гармоніки»
-
ЕхоКГ у 3D та візуалізація з усіх можливих позицій (для кращого визначення локалізації)
-
В/в контрастування
|
-
Фокусні зрізи спереду та сзаду, вище та нижче з множинних доступів / латеральніше та медіальніше з та без «гармоніки»
-
ЕхоКГ у 3D та візуалізація з усіх можливих зрізів(для кращого визначення локалізації)
-
В/в контрастування
|
|
Атероматозні бляшки дуги аорти
|
-
ЕхоКГ у 3D та візуалізація з усіх можливих позицій
-
Високочастотні та фундаментальні зображення (з фокусними зрізами)
|
-
ЕхоКГ у 3D та візуалізація з усіх можливих зрізів
-
Високочастотні та фундаментальні зображення (з фокусними зрізами)
|
|
Внутрішньосерцеві шунти
|
-
КДК з відповідним зсувом ліміту Найквіста для кращого визначення шунта (зниження для міжпередсердних шунтів та великих ДМШП, підвищення для маленьких ДМШП)
-
Некласичні / нестандартні доступи
-
Контрастування збовтаним фізіологічним розчином (за показанням)
|
-
КДК з відповідним зсувом ліміту Найквіста для кращого визначення шунта (зниження для міжпередсердних шунтів та великих ДМШП, підвищення для маленьких ДМШП)
Контрастування збовтаним фізіологічним розчином (за показанням)
|
|
Інтрапульмонарні шунти
|
-
Контрастування збовтаним фізіологічним розчином (за показанням)
|
Контрастування збовтаним фізіологічним розчином (за показанням)
|
|
Транскатетерні пристрої
|
-
Високочастотні та фундаментальні зображення (з фокусними зрізами)
-
Фокусні зрізи спереду та сзаду, вище та нижче з множинних доступів / латеральніше та медіальніше з та без «гармоніки» та КДК
-
ЕхоКГ у 3D та візуалізація з усіх можливих позицій
|
-
-
Високочастотні та фундаментальні зображення (з фокусними зрізами)
-
Фокусні зрізи спереду та сзаду, вище та нижче з множинних доступів / латеральніше та медіальніше з та без «гармоніки» та КДК
-
ЕхоКГ у 3D та візуалізація з усіх можливих зрізів
|
При оцінці специфічних структур з використанням 3D-ЕхоКГ фокус робиться на структурах відповідно до існуючих європейських та американських рекомендацій [9]. Залежно від об’єктивного статусу та анамнезу пацієнта, звичайно слід використовувати більшість з вище описаних в цьому розділі методик. Приклади різних ЕхоКГ методик надані протягом цього документу у відповідних розділах окремих джерел емболій.
Візуалізація в В-режимі високочастотна та фундаментальна. Сьогодні більшість УЗ-апаратів мають попередні заводські налаштування з використанням «гармоніки», що дозволяє кращу роздільну здатність ендокарду, але зменшує роздільну здатність візуалізації клапанних та інших дрібних структур порівняно з візуалізацією на фундаментальній частоті. Ефект тканинної гармоніки реалізується через тканини з мінімальним ефектом гармоніки у просторі поруч. Це особливо важливо при оцінці апікальних тромбів при диференціації меж тромбів та ендокарду. Як наведено в Таб. 2, зображення на високій та фундаментальній частотах повинні використовуватися для розрізнення структур без збільшення товщини структури (Рис. 1).
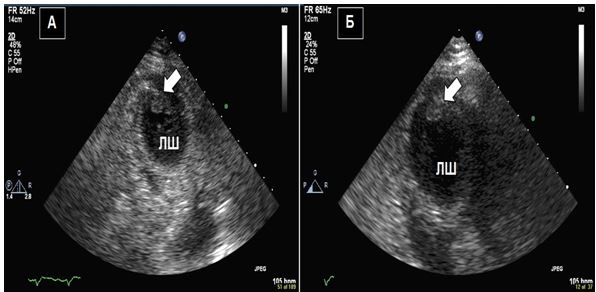
Рис. 1. Двовимірне ТТЕхоКГ апікального тромба ЛШ з використанням «гармоніки» (А) та при фундаментальному зображенні (Б). А. Апікальний тромб в режимі «гармоніки» (стрілка). Б. Апікальний тромб ЛШ (стрілка) без «гармоніки» краще відображує насправді більший розмір тромба.
Тривимірна та багатозрізова візуалізація. Тривимірна та багатопланова візуалізація вивела ЕхоКГ на новий рівень оцінки кардіальних структур та функції. Хоча стандартне ЕхоКГ в В-режимі досі використовується у більшості випадків, 3D- та багатозрізова ЕхоКГ може краще висвітлювати та візуалізувати певні зони інтересу, що часто пропускаються або «продивляються», особливо при пошуку джерел кардіальних, аортальних та легеневих емболій, як, наприклад, наведено на Рис. 2.
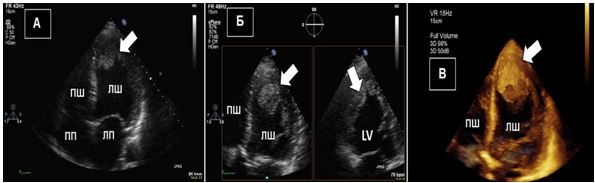
Рис. 2. ТТЕхоКГ апікального тромба ЛШ в 2Dта в 3D. А. Двохвимірна ТТЕхоКГ в А4С позиції ЛШ, що відображує тромб (стрілка). Б. Біпланове зображення в 3Dбез реконструкції, що дозволяє виявити множинні тромби ЛШ. В. 3D–реконструкція ЛШ, що відображує шари, локалізацію та протяжність тромбів.
Чим більше вдається візуалізувати зрізів, тим більше отримується інформації щодо протягу, розмірів, мобільності та кількості тромбів або інших структур, що можуть бути джерелами емболії. Наприклад, часто при міксомах В-режим дозволяє тільки візуалізувати рух міксоми через отвір мітрального клапану (МК), в той час як 3D-ЕхоКГ дозволяє в повному обсязі зареєструвати як рух міксоми в ЛП та через МК, так і точку прикріплення ніжки міксоми до міжпередсердної перегородки (МПП) або іншої структури (Рис. 3).
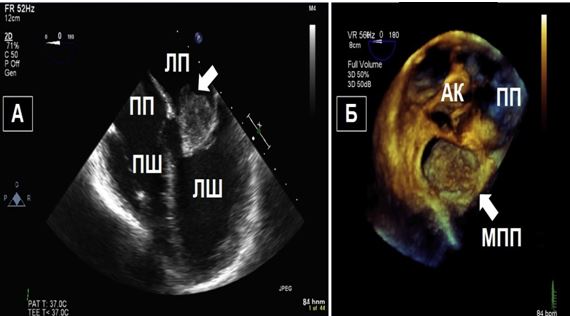
Рис. 3. ЧСЕхоКГ міксоми ЛП. А. 2D ТТЕхоКГ, 4-камерна позиція 0о, що показує діастолічний рух міксоми через мітральний отвір. Б. 3D-реконструкція підчас ЧСЕхоКГ, що показує вигляд з перспективи оперуючого хірурга, що відображує місце прикріплення ножки міксоми (стрілка) до МПП.
Транспульмонарне контрастування та контрастування фізіологічним розчином. Доцільність використання транспульмонарного контрастування для чіткішого визначення меж ендокарду та підсилення допплерівських спектрів є добре визначеною відповідними рекомендаціями з використання ЕхоКГ-контрастування ASE2014 р. [10]. Додаткові покази можуть включати визначення структури та меж тромбів (Рис. 4) та внутрішньокардіальних мас, а також визначення васкуляризації об'ємних структур, подібно до МРТ серця. Хоча кольорове допплерівське картування (КДК) може іноді виявити інтракардіальні комунікації, використання збовтаного фізрозчину дає кращі результати та чутливість в їх діагностиці (Рис. 5).
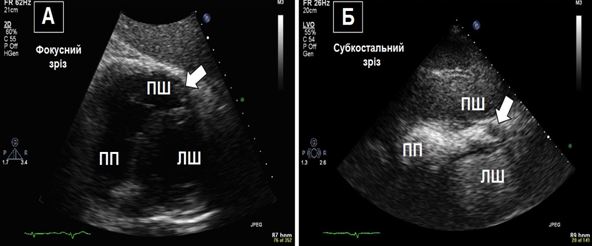
Рис. 4.Зображення апікального тромба ПШ з та без ЕхоКГ-контрастування. А. ТТЕхоКГ, субкостальне зображення ПШ з апікальним тромбом (стрілка). Б. ТТЕхоКГ, субкостальне зображення ПШ з контрастуванням порожнини, що дозволяє чіткіше відокремити межі порожнини та апікального тромба (стрілка).
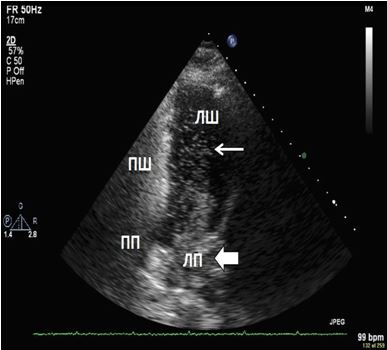
Рис. 5. Виявлення інтракардіального шунтування крові з використанням в/в ін’єкції взбовтаного фізіологічного розчину. ТТЕхоКГ, А4С позиція підчас дослідження з контрастуванням демонструє шунтування з ПП в ЛП в стані спокою. Спостерігається велика кількість пухирців в ЛП (товста стрілка) та менша їх кількість в ЛШ (тонка стрілка).
КДК, не осеві та нестандартні зрізі, фокусні проекції. На додаток до стандартного КДК при клапанних стенозах та регургітаціях, при пошуку кардіальних джерел емболій слід також рутинно виконувати КДК для пошуку внутрішьосерцевих комунікацій (з відповідними налаштуваннями ліміту Найквіста). КДК може виявити нові комунікації між камерами серця, параклапанні потоки, аневризми та псевдоаневризми та абсцеси (Рис. 6).
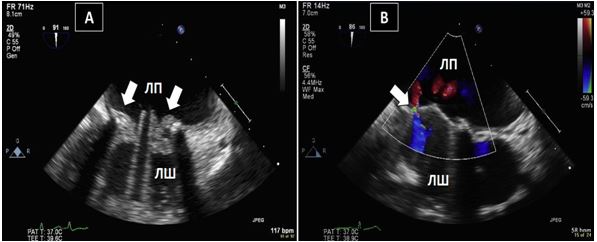
Рис. 6. ЧСЕхоКГ ендокардиту протезу клапану в мітральній позиції. Середньостравохідний 2-камерний зріз ендокардиту механічного протезу МК. А. В-режим на 91о демонструє вегетації (стрілки), прилеглі до протезу з боку ЛП. Б. КДК демонструє перивальвулярний потік (пара клапанна гнійна фістула, стрілка) біля інфікованої зони механічного протезу.
Як згадувалося вище в підрозділі, присвяченому 3D-ЕхоКГ, кардіальні, аортальні та легеневі джерела емболій можуть «продивлятися» або пропускатися тільки при виконанні стандартних ЕхоКГ зрізів. Застосування проміжних та нетрадиційних зрізів може зробити вірний акцент на певних патологічних утвореннях та підсилити цільове визначення патологічних утворень за рахунок кращої їх візуалізації, та допомогти краще візуалізувати окремі ділянки, що не здатні допомогти візуалізувати стандартні позиції у В-режимі. Використання фокусних проекцій з багатопланових зрізів також допомагає уточнити відносну анатомію сусідніх структур та покращити просторове розуміння підчас візуалізації (Рис. 7).
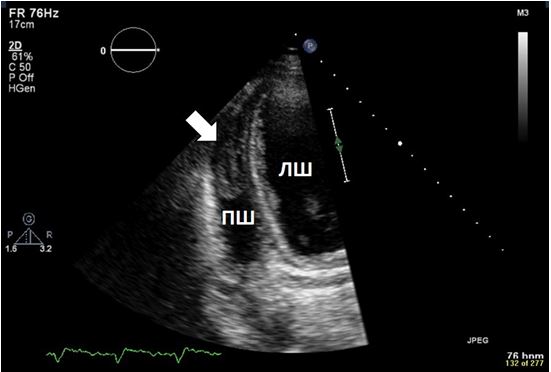
Рис. 7. Трансторакальний зсув сектору сканування, що використовується для візуалізації тромбу ПШ за рахунок фокусування на верхівці ПШ (стрілка).
Порівняльна характеристика ТТЕхоКГ та ЧСЕхоКГ. Якість ТТЕхоКГ може бути дуже різною залежно від пацієнта, тому що дуже залежить від habitus’у пацієнта, ширини межреберних проміжків, наявності або відсутності деформацій грудної клітки, легеневої патології, напр., емфіземи. Навіть при використанні ЕхоКГ обладнання експертного класу ТТЕхоКГ візуалізація може бути субоптимальною або навіть невідтворюваною.
Внаслідок того, що УЗ промінь втрачає енергію протягом проходення через тканини, структури, що залегають глибше від грудної стінки, можуть візуалізуватися підчас ТТЕхоКГ гірше, ніж більш поверхневі. Зниження частоти випромінення датчика покращує проникнення в тканини, але знижує роздільну здатність візуалізації структур. В результаті, ті структури, що можуть бути важливими джерелами емболії, наприклад задня частина ЛП та його вушко, МПП, або грудна аорта, підчас ТТЕхоКГ можуть візуалізуватися субоптимально або не візуалізуватися взагалі.
При знаходженні датчика в стравоході підчас ЧСЕхоКГ він дуже щільно прилежить до задньої поверхні серця з мінімальною відстанню, яка дозволяє використання більш високих частот УЗ випромінення. Крім того, підчас ЧСЕхоКГ серце не маскується прилеглими екстракардіальними структурами, такими як кістки та легенева тканина. В результаті, ЧСЕхоКГ дозволяє отримання зображень з вищою роздільною здатністю та краще розкриває потенційні кардіальні та аортальні джерела емболії. В багатьох лікувальних закладах пошук джерел емболії є найчастішим показом для ЧСЕхоКГ.
Хоча звичайно ЧСЕхоКГ є цільком безпечною, її досі вважають напівінвазивною процедурою.Ускладнення є рідкими, але одним з найсерйозніших лишається перфорація стравоходу з частотою від 0,01 до 0,09% від усіх досліджень [11]. Інші ускладнення включають анатомічні ушкодження в ротовій порожнині, зубів, глотки та трахеї, а також ускладнення, пов'язані з локальною анестезією та седацією, тому виконання ЧСЕхоКГ повинне завжди проводитися у відповідності до існуючих рекомендацій [12].
За відсутності чітких ознак, що могли б пояснити емболічну природу події (напр., ФП, МС або ІЕ), результати ТТЕхоКГ часто є негативними. Тому сьогодні часто вважається, що ТТЕхоКГ не є необхідною у пацієнтів з криптогенним інсультом та негативними даними клінічного обстеження. ТТЕхоКГ також не є необхідною, якщо вже заплановано проведення ЧСЕхоКГ (напр., для оцінки внутрішньосерцевих об'ємних утворень, клапанних протезів та грудної аорти, або коли ЧСЕхоКГ використовується для контролю за проведення перкутанних процедур, пов’язаних з кардіальними джерелами емболій). Інші дослідники вважають, що ТТЕхоКГ іноді може забезпечити додаткову інформацію, що не знаходиться підчас ЧСЕхоКГ (напр., апікальні тромби ЛШ) або навіть може усунути необхідність у проведенні більш інвазивної та коштовної ЧСЕхоКГ.
Спроби визначити цінову ефективність ЕхоКГ у пацієнтів з гострим неврологічним дефіцитом дійшли суперечливих результатів внаслідок різних підходів до проведення аналізу [13, 14]. Втім, слід підкреслити, що ці спроби аналізу брали до уваги не користь для індивідуальних пацієнтів, а лише оцінювали цінову ефективність на соціально-популяційному рівні [4, 15-20].
В цілому можна зробити висновок, що ТТЕхоКГ є відмінним методом візуалізації кардіальних структур, розташованих передніше, особливо при використанні нижчих частот датчик. Навпаки, ЧСЕхоКГ використовує вищі частоти УЗ та є кращою у візуалізації більш задніх кардіальних структур. Загалом, чутливість ЧСЕхоКГ є вищою порівняно з ТТЕхоКГ [21-22].ЧСЕхоКГ є цінною при поганій якості ТТЕхоКГ, у молодих пацієнтів з інсультом, при інсультах нез’ясованої етіології та, взагалі, при нелакунарних інсультах. Основні переваги та недоліки ТТЕхоКГ та ЧСЕхоКГ наведені у Таб. 3.
Таб. 3. Порівняльна характеристика переваг ТТЕхоКГ та ЧСЕхоКГ при оцінці кардіальних джерел емболії.
|
|
Потенційне джерело емболії
|
ТТЕхоКГ
|
ЧСЕхоКГ
|
|
Перевагу маєЧСЕхоКГ
|
Тромб або ФСК ЛП / ВЛП
|
- / +
|
++++
|
|
|
Атерома аорти
|
- / +
|
++++
|
|
|
Аномалії клапанних протезів
|
+
|
++++
|
|
|
Вегетації нативних клапанів
|
++
|
++++
|
|
|
Аномалії МПП
|
++
|
++++
|
|
|
Внутрішньокардіальні пухлини
|
+++
|
++++
|
|
Перевагу має ТТЕхоКГ
|
Тромби ЛШ
|
++++
|
++
|
Рекомендації з використання ЕхоКГ у пацієнтів з потенційним кардіальних джерелом емболій
ЕхоКГ є рекомендованою
-
Проведення ЕхоКГ має призначатися всім пацієнтам з підозрою на кардіальне джерело емболії, особливо пацієнтам, у яких прийняття клінічних рішень (напр., антикоагулянтна терапія або кардіоверсія) буде залежати від знахідок підчас ЕхоКГ.
ЕхоКГ є потенційно корисною
-
Пацієнти з неврологічними подіями та супутньою маніфестною цереброваскулярною патологією.
ЕхоКГ не є рекомендованою
-
ЕхоКГ не є рекомендованою у пацієнтів, у яких результати дослідження не призведуть до зміни тактики лікування та прийняття клінічного рішення.
ТТЕхоКГ або ЧСЕхоКГ
-
ЧСЕхоКГ не є показаною, якщо результати ТТЕхоКГ є достатньо чіткими для встановлення діагнозу кардіального джерела емболії.
-
ТТЕхоКГ не є необхідною, якщо вже заплановано проведення ЧСЕхоКГ (напр., для оцінки внутрішньосерцевих об'ємних утворень, клапанних протезів та грудної аорти, або коли ЧСЕхоКГ використовується для контролю за проведенням перкутанних процедур, пов’язаних з кардіальними джерелами емболії).
Альтернативні засоби візуалізації кардіальних джерел емболій
Радіологічні неехокардіографічні методики візуалізації використовуються для дослідження органів-мішеней кардіоемболій (переважно головного мозку), а також для візуалізації джерел емболії з серця та великих судин.
Нейровізуалізація: комп’ютерна томографія та магнето-резонансна томографія
Нейровізуалізація за допомогою КТ або МРТ є дуже важливою для диференційної діагностики ішемічних та геморагічних інсультів. Знахідки підчас нейровізуалізації, що підтверджують кардіоемболічну природу інсульту включають одночасні або послідовні інсульти в різних басейнах кровопостачання (Рис. 8). Внаслідок досить великого розміру кардіальні емболи заносяться в більшості випадків в артерії мозку, частіше в басейни сонних та середніх мозкових артерій [8, 23].Такі нейровізуалізаційні ознаки чітко відрізняються від ознак неемболічних інсультів, таких як гемодинамічні або лакунарні (Рис. 9).
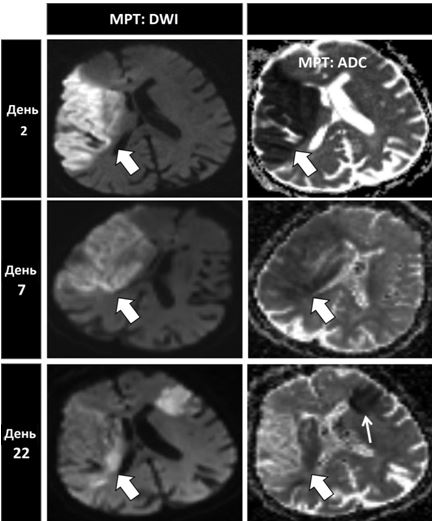
Рис. 8. МРТ головного мозку при емболічному інсульті у пацієнта з фібриляцією передсердь демонструє інсульти в різних басейнах кровопостачання, що відбулися в різні часові періоди, що є типовим для емболічної етіології ішемічних інсультів. Спочатку у пацієнта відбувся емболічний інсульт в басейні правої середньої мозкової артерії (товсті стрілки), а через три тижні у пацієнта стався новий інсульт в басейні лівої середньої мозкової артерії (тонка стрілку). (ADC – очевидний коефіцієнт дифузії; DWI – зображення із зваженою дифузією) [за Dr. BenjaminA. Cohen, DepartmentofRadiology, NewYorkUniversityLangoneMedicalCenter].
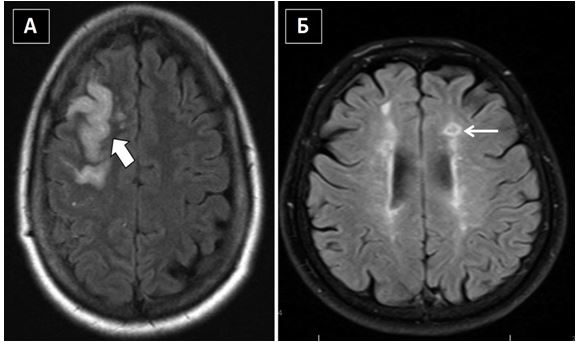
Рис. 9. МРТ мозку при не емболічних інсультах (відновлена інверсія з поверненням рідини). А. Товста стрілка указує на набряк в зоні інфаркту на межі басейнів правих передньої та середньої мозкових артерій у жінки середнього віку з цефалгіями. Б. Тонка стрілка указує на лакунарні інфаркти в лівій фронтальній паравентрикулярній області у пацієнта з артеріальною гіпертензією (за Dr Benjamin A. Cohen, Department of Radiology, New York University Langone Medical Center).
Наявність потенційного явного кардіального джерела емболії за відсутності значущої патології артерій лишається фундаментальним базисом діагнозу кардіоемболічного мозкового інсульту [24]. Якщо кардіальна та каротидна артеріальна патологія співіснують, визначення етіології ішемічного інсульту утруднюється.
Транскраніальна допплерографія (ТКД)
ТКД може використовуватися для визначення церебральних мікроемболів, що можуть складатися з кристалів холестерину, жиру, повітря або кальцію[25]. ТКД також може використовуватися для виявлення інтракраніальних емболів підчас хірургічних маніпуляцій на грудній аорті. ТКД також може допомогти у неінвазивній діагностиці право-лівих шунтів внаслідок відкритого овального вікна (ВОВ) при виявленні сигналів пухирців в середній мозковій артерії (СМА) після ін'єкції збовтаного фізрозчину в периферичну вену [26].
Найбільш важливим обмеженням контрастної ТКД є відсутність доброго УЗ-вікна в області скроневої кістки, що спостерігається приблизно у 10% пацієнтів з інсультами, особливо в літній популяції. Вікно скроневої кістки локалізується безпосередньо вище виличної дуги. Адекватність цього УЗ-вікна визначається можливістю виміряти адекватної якості допплерівські сигнали кровотоку в СМА [24].ТКД також не здатна діференціювати внутрішньосерцеві та екстракардіальні шунти, та не забезпечує прямої візуалізації шунту, як ЕхоКГ [27].Втім, ТКД є досить надійною неінвазивною альтернативою ЧСЕхоКГ для діагностики право-лівих шунтів з прекрасними чутливістю та специфічністю (97% та 93%, відповідно). Специфічність може бути підвищена за рахунок збільшення пухирцевого порогу, як маркера позитивного результату, з одного до 10 мікропухирців, хоча і за рахунок зниження чутливості методики [28].
Ядерна кардіологія
Оцінка перфузії міокарду та функції шлуночків може бути корисною у окремих пацієнтів (напр., у пацієнтів з ішемічною хворобою серця) [24].
КТ грудної клітки
Мультидетекторна спіральна КТ (МСКТ), синхронизована з електрокардіографією (ЕКГ) може успішно використовуватися для дослідження лівих відділів серця та великих судин у пацієнтів із підозрою на кардіоемболічні інсульти [29]. МСКТ дозволяє дуже швидке обстеження в комбінації з високою просторовою роздільною здатністю (0,4-0,6 мм). Сьогодні головним недоліком методу є відносна нестача відповідного контрасту м'яких тканин, що лімітує оцінку міокарду та ідентифікацію малого розміру тромбів. До інших недоліків можна віднести відносно вискоку експозицію до радіації та потенційну нефротоксичну дію контрастних речовин, що містять йод.
Головною перевагою МСКТ та МРТ над ЕхоКГ є їхня здатність краще візуалізувати прилеглі до серця внутрішньогрудні анатомічні структури, що також можуть частково відповідати за розвиток системних емболій (напр., прорастання в серце злоякісних пухлин оточуючих органів або тканин, візуалізація всієї грудної аорти, тощо).
МРТ грудної клітки
Рутинна серцево-судинна МРТ в контексті інсультів сьогодні не є частиною рекомендованих засобів дослідження з консенсусної точки зору, хоча сьогодні з'являється дедалі більше літературних даних на підтримку її ролі як допоміжного засобу візуалізації на додаток до ЕхоКГ у певних випадках (напр., характеристика тканин кардіальних пухлин, тощо) [24].
Рекомендації з альтернативних засобів візуалізації в діагностиці кардіальних джерел емболій
Альтернативні засоби візуалізації є рекомендованими
-
Нейровізуалізація за даними МСКТ та МРТ є важливими при обстеженні пацієнтів з неврологічною симптоматикою, що може бути наслідком кардіальних джерел емболії.
-
МСКТ, МРТ та інші радіологічні методи візуалізації серця та магістральних судин можуть бути корисними у певних пацієнтів з кардіальними джерелами емболії.
Альтернативні засоби візуалізації не є рекомендованими
-
Альтернативні засоби візуалізації серця та магістральних судин не є рекомендованими, якщо висновки ЕхоКГ є достатньо діагностичними.
Тромбоемболії з ЛП та ВЛП
Тромби, локалізовані в ЛП або, точніше, в ВЛП є найчастішим джерелом кардіоемболічних подій, та типово асоціюються з передсердними аритміями, такими як ФП та ТП. ЧСЕхоКГ є методом вибору для оцінки анатомії та функції ВЛП. ВЛП може бути однокамерним або багаточастинним [24].Для класифікації анатомії ВЛП описано чотири типи морфології ВЛП: «кактус», «куряче крило», «шкарпетка-флюгер» та «цвітна капуста».У пацієнтів з ВЛП за морфологією «курячого крила» тромбоемболічні події розвиваються не так часто порівняно з іншими типами анатомії ВЛП[31].
Патогенез тромбоутворення та тромбоемболій з передсердь
В наших знаннях щодо тромбогенезу та тромбоемболій з передсердь та найбільш адекватних та клінічно ефективних діагностичних та терапевтичних опцій досі лишаються певні пробіли. Частота ФП в загальній популяції складає 0,4 – 1,0%, але збільшується до 9% у пацієнтів, старших 80 років [32]. Ризик розвитку інсульту або системної емболії у пацієнтів з ФП складає від 1% на рік при низькому ризику до 15% при високому. Встановлено, що приблизно у 75% пацієнтів з кардіоемболічними епізодами тромби беруть своє походження у ВЛП, тобто викликані ФП. Втім, багато з цих пацієнтів старші за 75 років, мають супутні артеріальну гіпертензію (АГ), цукровий діабет (ЦД) та ураження сонних артерій, всі з яких є незалежними предикторами розвитку інсульту. Хоча фундаментальні механізми тромбогенезу були описані більше 150 років тому у вигляді тріади Вірхова (стаз крові, ушкодження ендотелію та гіперкоагуляція), точні умови, за яких відбувається тромбоутворення та тромбоемболії з ЛП, досі лишаються досі спекулятивними. Принципи гіпотези Вірхова сьогодні просто екстраполюються на ситуацію з ЛП та ФП. Тромбоутворення відбувається протягом всього патогенетичного континууму, починаючись з ФСК (феномен «диму»), тобто формування минущих агрегатів формених елементів крові, що вказують на застій (стаз) крові, прогресуючи до формування «сладжу» (дуже густого ФСК), та завершуючись остаточним формуванням тромбів (Рис. 10) [33]. Персистуючий ФСК в ЛП підчас ЧСЕхоКГ асоціюється з пізнішим тромбоутворенням та підвищеним ризиком системних емболій. «Сладж» є ехокардіографічним феноменом, що є більш густий та в'язкий, ніж ФСК, але менш густий та щільний, ніж тромб густий та щільний, ніж тромб [34].
Анатомічна структура ВЛП та набуте збільшення порожнини та розтягнення ЛП або ВЛП при клапанних та неклапанних серцевих хворобах створюють середовище та субстрат для застою крові.
Описані певні мікроскопічні зміни ендокарду ВЛП при ФП порівняно з таким при синусовому ритмі, та при МС порівняно з таким при мітральній регургітації (МР). У пацієнтів з ФП та тромбоемболіями описані набряк, фібринозна трансформація та оголення ендотелію в тканині ЛП [35]. Крім того, описане порушення оновлення екстрацелюлярного матриксу, як фактору, що сприяє структурним змінам ЛП. Пацієнти з ФП мають надлишок колагену та продуктів дегенерації тканин в стінці ЛП, а також збільшену концентрацію матріксних металопротеїназ [36].
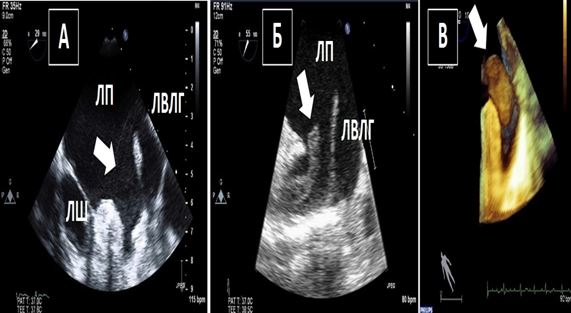
Рис. 10. Двохвимірна та 3D ЧСЕхоКГ феномену спонтанного контрастування (ФСК, «диму») та тромбозу вушка ЛП (ВЛП). А. Двовимірний середньо-стравохідний зріз ЛП, ВЛП та лівої верхньої легеневої вени (LUPV) в середньо-стравохідному зрізі демонструє ФСК (стрілка) у пацієнта з ФП. ФСК є персистуючим та присутній як в ЛП, так і в ВЛП. Б. Двовимірний середньо-стравохідний зріз ЛП, ВЛП та LUPV на 55о демонструє чіткий мобільний тромб ВЛП (стрілка) у пацієнта з ФП. В. Трьохвимірна ЧСЕхоКГ ВЛП демонструє великий мобільний тромб в отворі ВЛП у пацієнта з з ФП.
Стаз кровотоку в ЛП може відбуватися не тільки підчас ФП внаслідок зменшення ефективної скоротливої функції міокарду ЛП, про що свідчить ФСК, але й відбуватися і при синусовому ритму при відповідній асоційованій патології, тобто при значущому збільшенні порожнини ЛП, напр., при МС [37].
Додаткові дані про патогенез тромбоутворення та тромбоемболій були отримані підчас досліджень з використанням ЧСЕхоКГ для вивчення ефектів електричної кардіоверсії при ФП [38, 39].Тромбоемболії після електричної кардіоверсії (нормалізаційні тромбоемболії) с приводу ФП булодобре описано ще в 1960-х рр ще до винайдення ЧСЕхоКГ. Втім, ключові аспекти для розуміння підлеглих механізмів були винайдені тільки при використанні ЧСЕхоКГ в даній популяції пацієнтів [40, 41].
Феномен «оглушення» ВЛП був продемонстрований підчас ЧСЕхоКГ за допомогою підвищення інтенсивності ФСК (Рис. 11) та зниження швидкостей вигнання крові з ВЛП (Рис. 12) безпосередньо після кардіоверсії до синусового ритму з приводу ФП [38].
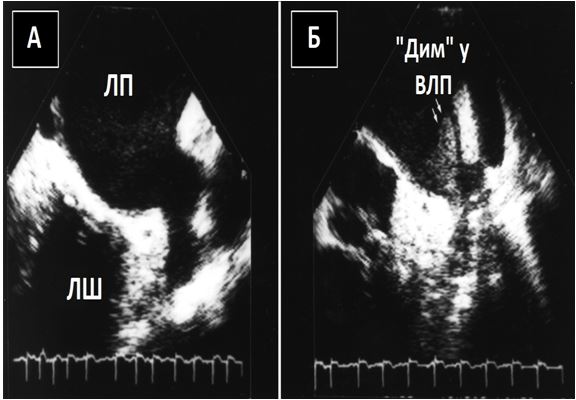
Рис. 11. ФСК (“smoke”) ВЛП після кардіоверсії. Середньо-стравохідний зріз з ФСК до (А) та безпосередньо після (Б) електричної кардіоверсії з приводу ФП.
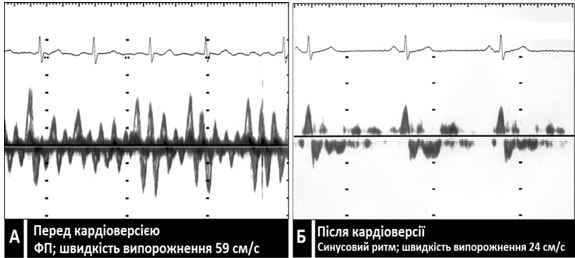
Рис. 12. Швидкість вигнання з ВЛП. Допплерівські імпульсно-хвильові спектри. А. Пацієнт з ФП (швидкість вигнання 50 см/с). Б. Той самий пацієнт безпосередньо після кардіоверсії з синусовим ритмом (швидкість вигнання з ВЛП 24 см/с). Ця послідовність демонструє феномен «оглушення» міокарду ЛП, в тому числі і вушка, що, як вважають пов'язаний з «нормалізаційними» тромбогенезом та емболіями після кардіоверсії.
До цих спостережень підчас ЧСЕхоКГ головною теорією тромбоемболічних ускладнень кардіоверсії було припущення, що інсульт розвивався внаслідок зсуву вже передіснуючого тромбу, що був сформований вже до кардіоверсії підчас ФП [42]. Доказові дані щодо ролі оглушення після кардіоверсії з'явилися після свідчень про розвиток інсульту у пацієнтів після кардіоверсії, у яких напередодні підчас ЧСЕхоКГ не було виявлено жодних тромбів в ЛП або ВЛП [43].Даны цих рандомізованих досліджень з використанням ЧСЕхоКГ сформували певний базис та обгрунтування для стратегії призначення антикоагулянтів на основі результатів ЧСЕхоКГ, що сьогодні використовуються при веденні пацієнтів з ФП перед проведенням електричної кардіоверсії.
Окрім анатомічних та гемодинамічних змін, що додають до схильності до тромбогенезу ЛП, також певну роль можуть видігравати порушення білкім коагуляційного каскаду та функції тромбоцитарної ланки гемостазу. Підвищення осідання фібрину та фрагментів протромбіну 1 та 2 асоціюються з ФП у пацієнтів з мозковим інсультом [44, 45].Крім того, протромботичні стани корелюють з дисфункцією ВЛП за даними ЧСЕхоКГ та наявністю ФСК [46].Рівень D-дімеру також асоціюється з тромбоемболічними подіями навіть у пацієнтами з неклапанною ФП [47], що також може бути корисним в діагностиці станів гіперкоагуляції. Сивороткові рівні фактору Віллебранда, маркеру ендотеліального ушкодження або дисфункції, також підвищуються за наявності тромбозу ВЛП та ФП [48].Хоча в багатьох дослідженнях продемонстрована потенційна роль тромбоцитів в тромбоутворенні при ФП, точне залучення та зв'язок функції тромбоцитів зі станами гіперкоагуляції досі детально не з’ясовані [49].
ЕхоКГ оцінка ЛП та ВЛП
Основа візуалізації кардіальних структур при ФП базується на ідентифікації певної з кардіальних причин ФП, таких як клапанна патологія, дисфункція шлуночків або гіпертензія. Після з’ясування етіології ФП, увага далі має приділятися анатомії ЛП, особливо при його збільшенні із уточненням ступеня важкості дилатації. Дилатація ЛП має доказову значущість щодо ризику тромбоемболічних ускладнень, утримання синусового ритму та [47]. Хоча спцифічність щодо виявлення тромбозу ЛП підчас ТТЕхоКГ є високою, чутливість лишається несприйнятно низькою, частково з тієї причини, що більшість тромбів звичайно локалізується у ВЛП, а не в основній порожнині лП. Найкраще ВЛП візуалізується підчас ЧСЕхоКГ.
Розмір ЛП визначається звичайно як його передньо-задній поперечний розмір в систолу згідно існуючих рекомендацій з кількісної оцінки камер серця [51]. Дослідження продемонстрували також переваги визначення об'єму ЛП та визначення його індексу до площі поверхні тіла (ППТ), що є більш точним вижначенням морфології та стану дилатації ЛП. Крім того, об'єми ЛП мають значущу прогностичну цінність щодо ризику інсульту, смертності, повторних пароксизмів ФВ після кардіоверсії або абляції, та після хірургічних втручань. Існує переконання, що об'єми ЛП, отримані шляхом 3D-ЕхоКГ можуть найточніше визначити його анатомію, хоча це досі не втілено в рутинну клінічну практику.
Внаслідок портативності, відносної низької вартості та неінвазивності ТТЕхоКГ є сьогодні рекомендованим методом оцінки ЛП, структур серця та їх функції у пацієнтів з ФП, що підтримують дані рекомендації згідно існуючим світовим консенсусам [6, 7, 52,].
Внаслідок анатомічного розташування безпосередньо біля стравоходу ЛП є структурою, ідеальною для оцінки підчас ЧСЕхоКГ с її можливостями візуалізації кардіальних структур з високою просторовою та часовою роздільністю в режимі реального часу. Крім того, ЧСЕхоКГ надає можливість оптимальної візуалізації саме ВЛП з детальною оцінкою його анатомії, функції та гемодинаміки. Втілення в практику 3D-ЕхоКГ збільшило наші можливості оцінки ВЛП, зокрема, дозволило краще диференціювати справжні об'ємні утворення та можливі артефакти в його порожнині.
Кардіоверсія. В субдослідженні дослідження з профілактики інсульту при ФП (StrokePreventioninAtrialFibrillation), в яких пацієнти з ФП рандомізувалися у групи порівняння ефектів варфарини та аспірину з метою первинної профілактики інсульту, певні показники та індекси ВЛП за даними ЧСЕхоКГ виявилися незалежними предикторами тромбоемболічних подій [53]. Наявність тромбозу ВЛП (відносний ризик 3,5), пікова швидкість вигнання з ВЛП ≤27 см/с (відносний ризик 1,7) та аортальні атеросклеротичні бляшки (відносний ризик 2,1) асоціювалися з тромбоемболічними подіями.
Крім оцінки пацієнтів з інсультом та/або ФП на предмет діагностики тромбозів, ЧСЕхоКГ звичайно використовується у веденні пацієнтів з ФП, у яких бажано відновлення синусового ритму шляхом медикаментозної або електричної кардіоверсії, або шляхом ізоляції легеневих вен. Було продемонстровано, що ЧСЕхоКГ є корисною при динамічному спостереженні за антикоагулянтною терапією перед та після кардіоверсії. Тобто, негативний щодо тромбозу результат ЧСЕхоКГ є показом до прямої кардіоверсії за умов терапевтичної адекватної анти коагуляції перед процедурою [54].
Проспективне рандомізоване багато центрове дослідження з оцінки ефектів кардіоверсії з використанням ЧСЕхоКГ (AssessmentofCardioversionUsingTransesophagealEchocardiography)порівнювало конвенційну антикоагуляційною стратегію з застосуванням антикоагулянтів після висновку ЧСЕхоКГ у пацієнтів, яким була запланована кардіоверсія з приводу ФП. Конвенційна антикоагуляційна стратегія полягала у медикаментозній антикоагуляції (варфарин) протягом 3 тижнів перед кардіоверсією та 4 тижнів після неї. Пацієнти, рандомізовані в групу контролю ЧСЕхоКГ могли прямо направлятися на кардіоверсію одразу після досягнення рекомендованого рівня антикоагуляції, якщо підчас ЧСЕхоКГ не було виявлено ознак тромбозу. В обох групах спостерігалися низкі рівні тромбоемболічних подій (0,65%) без достовірної різниці між групами традиційної антикоагуляційної стратегії (0,5%) та контролю ЧСЕхоКГ (0,8%) відносно частоти емболічного інсульту та композитної кінцевої точки, до якої входили смертність, емболічний інсульт та кровотеча. В групі контролю ЧСЕхоКГ достовірно значно нижчою була частота кровотеч разом із коротшим часом до виконання кардіоверсії. Таким чином, первинна перевага стратегії контролю антикоагуляції за допомогою ЧСЕхоКГ полягає в тому, що це дозволяє запобігти 3-тижневого курсу антикоагуляції при відсутності ознак тромбозу підчас ЧСЕхоКГ.
Ізоляція легеневих вен. ЕхоКГ, особливо ЧСЕхоКГ, багато досліджувалася та широко використовується у пацієнтів, яким виконується ізоляція легеневих вен (ЛВ), для оцінки та діагностики тромбозу перед інструментальними втручаннями в ЛП [55]. Інтракардіальна ЕхоКГ також може бути корисною для діагностики тромбозу передсердь, та звичайно використовується підчас електрофізіологічної процедуридля допоміжного моніторингу та направлення катетера підчас процедури ізоляції ЛВ [56].
Літературні дані свідчать, що ТТЕхоКГ є корисною в оцінці відновлення функції ЛП після ізоляції ЛВ [57], а ЧСЕхоКГ є корисним для діагностики стенозів ЛВ після процедури [58, 59]. Значне зниження частоти стенозів ЛВ по мірі збільшення досвіду з проведення цієї процедури, а також відмінна діагностична точність МСКТ та МРТ серця в даних умовах дещо знизили значення ЧСЕхоКГ при проведенні процедури.
Спостереження за перкутанними процедурами на ВЛП.ЧСЕхоКГ взагалі, та 3D-ЧСЕхоКГ в режимі реального часу, зокрема, є дуже корисними методиками для спостереження за перкутаними процедурами закриття ВЛП з використаннями відповідних пристроїв, таких як нещодавно схвалений FDAСША пристрій Watchman (BostonScientific, Marlborough, MA) або інших, включаючи такі, що досі проходять клінічні випробування.
Рекомендації з призначення ЕхоКГ пацієнтам з підозрою на тромбоз ЛП та ВЛП
ЕхоКГ є рекомендованою
-
ТТЕхоКГє рекомендованою у пацієнтів із підозрою на тромбоз ЛП або ВЛП для оцінки розмірів ЛП та розмірів і функції ЛШ, а також для оцінки можливої причинної етіології ФП та визначення додаткових факторів ризику інсульту.
-
ЧСЕхоКГ має переваги перед ТТЕхоКГ в оцінці анатомії та функції ВЛП з точки зору варіабельності клінічних контекстів, в тому числі перед кардіоверсією, абляцією передсердних аритмій та перкутанного закриття ВЛП.
ЕхоКГ є потенційно корисною
-
Контрастна ЕхоКГ з використанням мікропухирцевих агентів (напр., перфлютрен) може допомогти в діагностиці тромбів ЛП та ВЛП та диференційній діагностиці аваскулярних тромбів з васкуляризованими пухлинами.
-
3D-ЕхоКГ може забезпечити більш точну оцінку ЛП та ВЛП, ії розмірів та морфології.
ЕхоКГ не є рекомендованою
-
ЕхоКГ не є рекомендованою пацієнтам, у яких дослідження не призведе до змін в прийнятих терапевтичних рішеннях.
Тромбоемболії з лівого шлуночка
Гострі коронарні синдроми
Регіональні порушення скоротливості та субендокардіальне ушкодження міокарду в умовах гострого інфаркту міокарда (ГІМ) призводять до стазу крові, що є субстратом для тромбоутворення в ЛШ. Крім того, підчас гострих коронарних синдромів (ГКС) в ЛШ спостерігається стан гіперкоагуляції із зростанням прокоагулянтних агентів та зниження концентрації фізіологічних антикоагулянтів, що створює чудове середовище для тромбогенезу. Ці тромби, що складаються з фібрину, еритроцитів та тромбоцитів, можуть утворюватися вже в перші 24 години після ГІМ, а більшість тромбів (90%) формується протягом 14 днів від розвитку ГІМ.
Частота тромбозу ЛШ в умовах ГКС є суттєво варіабельною залежно від даних різних досліджень, та складає від 7% до 46%[60, 62]. Сучасні методи реперфузійної терапії, такі як тромболізис та агресивна медикаментозна терапія, включаючи агресивну антиагрегантну та антикоагулянтну терапію, призвели до зниження частоти тромбозу ЛШ [63]. Частіше тромби ЛШ (переважно апікальні) формуються у пацієнтів з передніми ГІМ та/або апікальними ГІМ, при чому їх частота може сягати 50% за наявності хронічної аневризми ЛШ [64].
Дані з частоти тромбоутворення в ЛШ в найгострішій стадії ГІМ в сучасну еру агресивних втручань є обмеженими та переважно ретроспективними; за даними літератури частота складає від 5% до 15% [65, 66].На ці дані впливає багато інших факторів, включаючи часове вікно, в яке виконане дослідження з візуалізації з метою ідентифікації тромбу ЛШ. ЕхоКГ, що виконується в перші години-доби частіше «пропускає» наявність тромбу ЛШ.
Наявність тромбу ЛШ від 2 до 11 днів від розвитку ГІМ підтверджується в до 40% випадків гострого ГІМ. Не зважаючи на велику частоту тромбоутворення, частота тромбоемболічних ускладнень, що призводили б до інсульту, є відносно низькою [64]. Частота тромбозу ЛШ підвищується у пацієнтів з вираженою систолічною дисфункцією, попередніми ГІМ в анамнезі, великими розмірами постінфарктного рубця (що також можна ідентифікувати за відтермінуванням підсилення підчас МРТ серця) [67]. В дослідженні, в якому брали участь 8000 пацієнтів з ГІМ з елевацією сегментуST, тромбоз ЛШ спостерігався в 5% випадків.
У пацієнтів з передніми ГІМ тромбоз ЛШ розвивається частіше (11,5% порівняно з 2,3% при інших локалізаціях). Тромби ЛШ частіше спостерігають у пацієнтів з ФВ ЛШ <40% та після передніх ГІМ (17,8%)[65]. Тромби ЛШ знаходять не тільки в ділянці верхівки, вони також можуть формуватися, хоча й набагато рідше, в інших відділах ЛШ, наприклад в нижньо-діафрагмальній та перегородковій областях [62]. Дослідження постійно підтверджують, що тромби ЛШ слід частіше очікувати в зоні великого розміру ГІМ, при передніх локалізаціях ГІМ, при виражених порушеннях скоротливості верхівки ЛШ, та при формуванні аневризм ЛШ [60].
Кардіоміпатії
Пацієнти із значною дилатацією та дисфункцією ЛШ, не важливо ішемічною або неішемічною, мають підвищений ризик тромбоутворення в ЛШ. Тромбогенез в умовах нормальної регіональної скоротливості є нетиповим, за винятком ситуацій з ендоміокардіальним фіброзом, при якому тромби можуть утворюватися в лівому або правому шлуночках при нормальній сегментарній скоротливості стінок. Частота тромбозу ЛШ у пацієнтів з кардіоміопатіями (КМП) також є варіабельним залежно від даних різних досліджень, які переважно є ретроспективними за дизайном. У пацієнтів з дилатаційною КМП частота тромбоемболічних ускладнень складає від 1,8% до 18% [68].
Фактори ризику тромбоемболічних ускладнень у пацієнтів з КМП включають сегментарні порушення скоротливості, важку дилатацію ЛШ, низький серцевий викид із застоєм крові, ФСК в ЛШ та ФП. Крім того, наявність вираженої апікальної гіпертрофії при гіпертрофічній КМП з систолічною облітерацією верхівки також може бути фактором ризику верхівкового тромбозу.
Морфологія тромбів ЛШ
Існує три основні типи тромбів, що можна ідентифікувати в ЛШ:
-
Пристінкові тромби (тільки одна з поверхонь тромбу межує з током крові і порожниною камери; тробм плоский та паралельний ендокардіальній поверхні).
-
Тромби з протрузією в порожнину ЛШ (більше однієї поверхні межує з кровотоком та видається в порожнину ЛШ).
-
«Флотуючі» мобільні тромби з незалежним рухом (або частини тромбу, або увесь тромб цілком).
Дослідження показали, що пацієнти з мобільними тромбами та/або з протрузією в порожнину ЛШ мають вищий ризик розвитку тромбоемболічних ускладнень. Втім, до 40% емболічних подій трапляються у пацієнтів, які не мають мобільних тромбів та/або тромбів з протрузією. Частота емболізацій є найнижчою у пацієнтів з пристінковими фіксованими тромбами, а найвищою – з мобільними тромбами [69, 70]. Серійні ехокардіографічні дослідження показали варіабельність морфології тромбів в перші декілька місяців після ГІМ, при чому 41% тромбів змінювали свої контури, а 29% змінювалися за типом мобільності [71]. До інших характеристик тромбів, які були асоційовані з підвищеним ризиком емболізації, відносяться гіперкінез прилеглих сегментів міокарду навколо зони тромбозу, зменшення центральної «прозорості» тромбу та розміри тромбу (дискутабельно) [70-72].
Група пацієнтів з найвищим ризиком емболії включає такі стани, як ФП, важка застійна СН, значна дилатація ЛШ з важкою систолічною дисфункцією, тромбоемболічні епізоди в анамнезі та похилий і старечій вік. Тромби в аневризмах ЛШ рідко стають причиною тромбоемболій, можливо, внаслідок відсутності скоротливості в зоні аневризми.
Роль ЕхоКГ в діагностиці тромбів ЛШ
ТТЕхоКГ є методом вибору, що найбільш широко використовується в рутинній клінічній практиці, в тому числі для оцінки регіональної та глобальної функції ЛШ та ПШ, морфології та функції клапанів та діагностики внутрішньо порожнинного тромбозу. ТТЕхоКГ має чудову чутливість (95%) та специфічність (85%–90%) в діагностиці тромбів [62]. На ЕхоКГ тромб ЛШ ідентифікується як чітка масаз добре визначеними краями, відокремленими від ендокарду, що візуалізується в порожнині ЛШ, однаково добре протягом систоли та діастоли на фоні відповідних значущих регіональних та/або глобальних порушень скоротливості (Рис. 13).
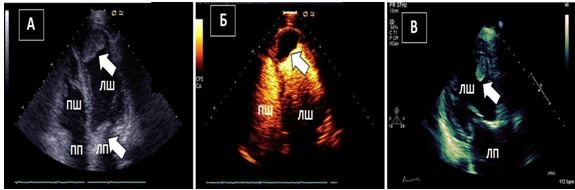
Рис. 13. ТТЕхоКГ апікального тромбу ЛШ. А. А4С позиція без контрастування демонструє великий апікальний тромб ЛШ. Б. Той самий пацієнт: ТТЕхоКГ з контрастуванням. Тромб, що не має кровопостачання виглядає підчас контрастування чорним (стрілка). В. А3С позиція демонструє мобільний тромб (стрілка), що кріпиться до апікального сегменту передньої МШП.
Для підтвердження діагнозу тромбозу ЛШ тромб має бути візуалізований не менш ніж в двох ортогональних позиціях (апікальних та по короткій осі). При цьому для точної діагностикидуже важливо чітко диференціювати можливі артефакти, включаючи інтерференції ближнього поля, хибні додаткові хорди, трабекулярність ЛШ та косий зріз через міокард верхівки [73, 74]. Для цього звичайно достатньо вдавання до досих простих заходів, таких як використання більш високої частоти сканування, фокусування на верхівці або іншій зоні зацікавленості в режимі «zoom» та використання низьких швидкостей ліміту Найквіста в КДК для визначення будь-яких дефектів наповнення. При досі неясному заключення рекомендується використання ехо-контрастів.
При технічно лімітованих дослідженнях (30%–35%), особливо якщо не вдається чітко візуалізувати верхівку, використання ехокардіографічного контрасту може значно вплинути на точність діагностики тромбозу ЛШ [67, 75, 76].
ЧСЕхоКГ відіграє обмежену рольв виявленні тромбів ЛШ внаслідок більш далекого розташування верхівки ЛШ від датчика, а також тому, що верхівка підчас ЧСЕхоКГ часто виглядає «зрізаною» та візуалізується не дуже добре. Навпаки, ТТЕхоКГ дозволяє більш близьке розташування датчика до ЛШ та його верхівки, що полегшує дослідження в декілької площинах. 3D-ЕхоКГ може надалі покращити ідентифікацію тромбів ЛШ за рахунок більш детальної оцінки верхівки ЛШ (збільшується кількість сегментів та регіонів, що оцінюються одномоментно). Втім, лишаються значними обмеження 3D-ЕхоКГ, а саме низька частота оновлення кадрів та погана роздільна здатність.
Рекомендації з ЕхоКГ у пацієнтів з підозрою на тромбозЛШ
ЕхоКГ є рекомендованою
-
ТТЕхоКГ рекомендована для діагностики у пацієнтів з відомою кардіальною патологією в анамнезі, яка є відомим фактором ризику тромбозу ЛШ (ГІМ, неішемічні КМП).
-
ТТЕхоКГ типово має переваги перед ЧСЕхоКГ в діагностиці апікального тромбозу ЛШ.
ЕхоКГ є потенційно корисною
-
Контрастна ЕхоКГ з використанням агентів з мікропухирцями (напр., перфлютрен) може допомогти у виявленні тромбів ЛШ та у диференційній діагностиці аваскулярних тромбів з васкуляризованими пухлинами.
-
3D-ЕхоКГ може допомогти в деталізації оцінки тромбу ЛШ.
ЕхоКГ не є рекомендованою
У пацієнтів, у яких результати дослідження не призведуть до змін терапевтичних рішень.
Клапанна патологія
Нативні клапани серця можуть бути джерелом як системної, так і легеневої емболії за рахунок можливості розвитку тромбів, інфекційних та неінфекційних вегетацій та кальцифікованого детриту. Крім того, як біологічні, так і механічні клапанні протези також можуть бути джерелом емболії (тромби та/або вегетації) та служити субстратом кардіоемболічного інсульту [1]. Як ТТЕхоКГ, так і ЧСЕхоКГ відіграють центральну роль в діагностиці, визначенні прогнозу та веденні і прийнятті рішень у таких пацієнтів. Декілька специфічних уражень клапанних структур асоціюються з емболія ми, включаючи ІЕ, небактеріальний тромботичний ендокардит (НБТЕ), клапанні папілярні фіброеластоми (ПФЕ), кальциноз мітрального кільця (КМК) та ендокардит або тромбоз біологічних або механічних клапанних протезів. Інші більш рідкі нозології лишаються невизначеними та протиречливими щодо визнання їх джерелами емболії (дегенеративні зміни нативних клапанних хорд, тромбоцитарні тромби механічних клапанних протезів, тощо). Далі в рекомендаціях кожна з перерахованих нозологій розглядається окремо з акцентом на ЕхоКГ діагностиці, діагностичній та прогностичній ролі ЕхоКГ та на виправданому використанні та показань до проведення кожної з існуючих ЕхоКГ методик.
Інфекційний ендокардит
Діагностика. У переважній більшості випадків у хворих виявляють позитивні результати гемо культури та ознаки ураження ендокарду, що складають визначення ІЕ [77], тому ЕхоКГ для пошуку та підтвердження інфекційних уражень ендокарду при підозрі на ІЕ є не тільки бажаним, але й обов’язковим [6, 78]. Хоча ключовою ознакою інфекційного ураження ендокарду є «клапанні вегетації», ендокардіальні інфекційні ураження також включають кардіальні абсцеси, фістули, нові вперше виявлені ознаки дисфункції клапанних протезів (зяяння, обструкція стулок та ін.) навіть за відсутності чітких вегетацій.
Критичним є ретельний збір клінічного анамнезу, тому що максимальні діагностичні переваги ЕхоКГ досягаються лише при інтерпретації знахідок підчас ЕхоКГ в світі анамнезу внаслідок того, що ЕхоКГ не забезпечую достатньо детальну характеризацію тканин, що візуалізуються (Таб. 4).
Тому усвідомлення ехокардіографічних ознак, що характеризують вегетації (Таб. 5, Рис. 14) та параклапанні ускладнення (Рис. 15) є ключовими. До патологічних знахідок на нативних клапанах, що можуть бути прийняті за інфекційні вегетації відносяться ПФЕ, клапанні хорди та тяжі та нарости Ламбла, КМК з мобільними компонентами, надлишкові клапанні хорди, та НБТЕ.
Таб. 4. Базові принципи ЕхоКГ оцінки ІЕ
-
ЕхоКГ відіграє ключову діагностичнуроль при ІЕ, в т.ч. для визначення прогнозу.
-
ЕхоКГ відіграє роль у післядіагностичному динамічному спостереженні та ключову роль у прийнятті клінічного рішення.
-
Ознайомлення з анамнезом пацієнта та наявними ризиками ІЕ (низький, помірний, високий). Інтерпретація та заключення про ЕхоКГ знахідки в світі з'ясованого анамнезу.
-
Ознайомлення з попередніми ЕхоКГ дослідженнями для визначення можливих ФР ІЕ та для підтвердження нових параклапанних токів або регургітуючих токів на нативних клапанах.
-
ТТЕхоКГ має низьку чутливість але високу специфічність для діагностики ІЕ.
-
ТТЕхоКГ визначає гемодинамічну важкість та гемодинамічні наслідки клапанної дисфункції та змін розмірів та функції порожнин, асоційованих з ІЕ, та визначає неінвазивні базові (вихідні) «відбитки пальців» вегетацій для порівняння із майбутніми спостереженнями.
-
ЧСЕхоКГ має високі як чутливість, так і специфічність у діагностиці ІЕ.
-
ЧСЕхоКГ дозволяє визначити детальні анатомічні особливості вегетацій, тому може визначити ризик емболії, а також краще ідентифікує параклапанні ускладнення.
-
ТТЕхоКГта ЧСЕхоКГ є взаємно доповнюючими методами дослідження у визначення ЕхоКГ характеристик вегетацій та параклапанних укладнень.
|

Рис. 14. Вегетація на нативному МК. Середньо-стравохідний комісуральний зріз в систолу на 50о демонструєвелику, аморфну з низькою ехо-щільністю (стрілка) структуру, прилеглу до передсердньої поверхні стулки МК, що відповідає типовій вегетації.
Таб. 5.ЕхоКГ характеристики інфекційних вегетацій та абсцесів
|
1. Вегетації
-
Ехогенність / структура: сіра шкала, ехоструктура, подібна до міокарду, втім, вилікувані («старі») вегетації звичайно більш ехогенні, та часто кальциновані.
-
Розміри: дуже варіабельні.
-
Форма / контури: звичайно аморфні, з нерівними краями («волохаті»), дольчасті, рідше лінійні або округлі.
-
Локалізація: передсердна поверхня АВ-клапанів, шлуночкова поверхня АК, хоча теоретично можуть локалізуватись з будь-якої сторони.
-
Рух: високочастотне тріпотіння, осциляції, хаотичній, по певній орбіті, незалежно від руху стулок клапану; великі вегетації часто пролабують в шлуночки в діастолу.
-
Асоційовані з: клапанна регургітація, клапанні мікотичні аневризми, деструкція клапану, параклапанні абсцеси, зяяння клапанного протезу
-
Диференційна діагностика на нативних клапанах: неінфекційні вегетації, ПФЕ, фібринові ниті, нарости Ламбла, КМК з мобільними компонентам, кальцифікати ВТЛШ з мобільними компонентами. Протези: тромбоз, залишкові нативної підклапанної тканини МК, тромбоцитарні тромби та мікрокавітації, асоційовані з механічними клапанними протезами.
-
«Виліковані вегетації»: подібно до будь-якого запального процесу, що розрішився, інфекційні вегетації можуть рубцюватися та виглядати досить ехогенними з вузлами кальцинатів.
|
|
2. Абсцеси
-
Ехо-прозорі або ехо-гетерогенні порожнини або потовщення тканини, що можуть заповнюватися (або ні) спектрами при КДК, прилеглі до клапанної структури. Звичайно параклапанні, хоча можуть формуватися в будь-якому регіоні міокарду.
-
Частіше уражує АК та може призводити до формування фістул (напр. аортально-шлуночкової, аортально-передсердної), а також псевдоаневризм (типово в корені аорти).
|
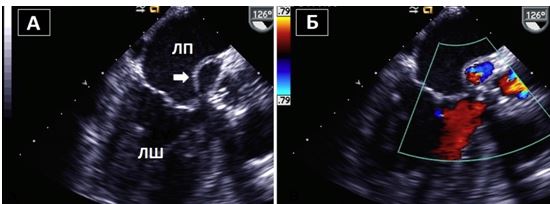
Рис. 15. Ендокардит нативного АК. А. Середньо-стравохідний зріз по довгій вісі ЛШ на 126о демонструє велику порожнину біля задньої частини кореня Ао, що відповідає абсцесу / псевдоаневризмі, типовим для ендокардиту АК. Б. КДК в середньо-стравохідному зрізі по довгій вісі ЛШ демонструє комунікацію між ЛШ та порожниною абсцесу в систолу.
Знахідки на клапанних протезах, що досить часто плутають з вегетаціями, включають протезні тяжі та нарости, тромбоз протезу, залишкові мітральні підклапанні тканини (Рис. 16), та мікрокавітації. Досвідчений ехокардіографіст звичайно здатен відразу розпізнати мікрокавітації та їх доброякісну природу (Рис. 17). Мікрокавітації є високошвидкісними дуже дрібними яскравими ехо-сигналами, що виникають в зоні притоку механічних клапанних протезів (як в аортальній, так і в мітральній, но частіше в мітральній позиції) в момент закриття клапану, коли швидкість та тиск потоку різко падають. Вони представляють собою нормальний феномен, що може зникати при обструкції або тромбозі клапанного протезу, та відновлюватися після успішного тромболізису [80].
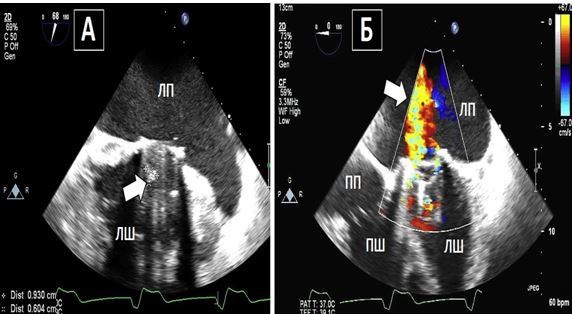
Рис. 16. Порівняння залишку мітральної під клапанної тканини з вегетацією. А. Середньо-стравохідний зріз наприкінці діастоли на 68о демонструє ехогеннупорівняно великої щільності тканину в межах механічного протезу в мітральній позиції розміром близько 0,9 х 0,6 см, що відповідає залишку під клапанної нативної тканини. На основі ЕхоКГ знахідки пацієнту було призначено антибіотики, після чого у нього розвинулася ятрогенна медикаментозна лихоманка, внаслідок чого його продовжили лікувати, як пацієнта з ендокардитом. Відсутність позитивної посівної культури та миттєва ремісія лихоманки після відміни антибіотика, а також хірургічні знахідки підтвердили, що це була не вегетація, а залишкова нативна тканина МК. Б. КДК демонструє переривчасту інтерференцію з закриттям окклюдера протезу, що викликає переривчасту мітральну регургітацію в межах протезу.
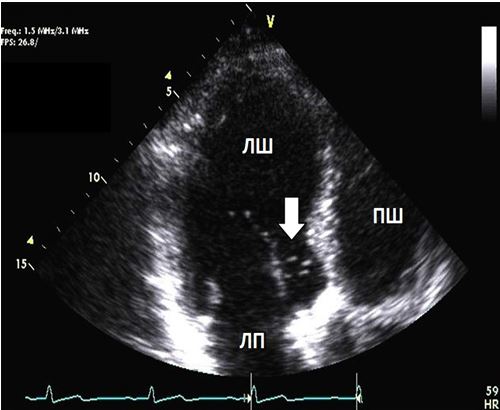
Рис. 17. Мікрокавітації механічного протезу. Цей ТТЕхоКГ зріз в А3С позиції демонструє значну кількість мікрокавітацій від великого розміру двостулкового механічного протезу в аортальній позиції. Мікрокавітації візуалізуються як «пухирці» в порожнині ВТЛШ.
Є загальновідомим, що хоча ТТЕхоКГ має специфічність щодо діагностики вегетацій >90%, її обмежена просторова роздільна здатність призводить до нижчої чутливості (62% – 79% за даними мета-аналізів [81-82]. Насправді, вегетації розміром<2-3 мм підчас ТТЕхоКГ можуть пропускатися оператором [83]. І навпаки, як чутливість, так і специфічність ЧСЕхоКГ складає >90% [84, 85]. Навіть сьогодні, після втілення в рутинну практику зображення з використанням «гармоніки», ТТЕхоКГ лишається менш діагностично чутливою методикою порівняно з ЧСЕхоКГ [21].
Переваги ЧСЕхоКГ ще більш значущі та очевидні при оцінці ІЕ клапанних протезів та ускладнень ІЕ, таких як перфорації стулок та абсцеси. При дослідженні протезів в мітральній та аортальній позиції чутливість ТТЕхоКГ падає на приблизно 20-40%, в той час як чутливість ЧСЕхоКГ лишається вище 80-90%[81, 86].
Механічні протези в мітральній позицій представляють особливу складність щодо діагностики ІЕ, внаслідок того, що артефакти реверберацій від протезу підчас ТТЕхоКГ, ефективно маскуючи можливі патологічні потоки (інтра- та параклапанні), а також зяяння клапанного кільця та вегетації, в той час як пряма візуалізація сзаду ЛП (ЧСЕхоКГ) елімінує ці утруднення. Цікаво, що при цьому підчас ЕхоКГ протез в мітральній позиції затінює ЛШ, принаймні в середньо-стравохідній 4-камерній позиції. Тому для адекватної оцінки розмірів та функції ЛШ все ж таки потрібна ТТЕхоКГ.
Агресивні мікроорганізми, такі як стафілокок, можуть викликати розвиток гнійних абсцесів як на нативних клапанах, так і на клапанних протезах(більше схильність на аортальному клапані [14]. Чутливість та специфічність діагностики абсцесів складає 28% та 98%, відповідно, для ТТЕхоКГ, та 87% та 95% для ЧСЕхоКГ [87].
Подібно, чутливість та специфічність при діагностиці ІЕ нативних клапанів або перфорації стулок складає близько 45% та 98%, відповідно, для ТТЕхоКГ, та 95% та 98%, відповідно, для ЧСЕхоКГ [88]. ЧСЕхоКГ сьогодні вважається методикою першою лінії при підозрі на ускладнення ІЕ (перфорації, абсцеси), ендокардит клапанних протезів, бактеріемію, викликану Staph.aureus, ендокардит внутрішньосерцевих пристроїв (напр., електроду ШВР), а також у випадках, коли висновки та заключення ТТЕхоКГ є незадовільними внаслідок субоптимальної якості візуалізації. ТТЕхоКГ є методикою візуалізації першої лінії в усіх інших ситуаціяї, та буває достатньою для специфічного висновку про необхідність пошуку інших джерел інфекції, якщо рівень підозри щодо ІЕ є низьким, а результати лабораторних досліджень є негативними.
За наявності помірного або високого рівня клінічної підозри щодо ІЕ при негативних результатах ТТЕхоКГ завжди слід призначати ЧСЕхоКГ. Крім того, доцільним є повторна ЧСЕхоКГ через приблизно 7 днів, якщо при первинних негативних результатах ЧСЕхоКГ рівень підозри на ІЕ лишається високим [81].
Прогноз. Варіабельність літературних даних про частоту системних емболічних ускладнень при ІЕ (13% – 49%) вібиває їх гетерогенну природу [89]. Системні емболічні ускладнення та результуючий інсульт найчастіше спостерігається при лівобічному ІЕ. Втім, правобічний ендокардит також потенційно може призводити до мозкового інсульту за наявності ВОВ або інших міжпередсердних шунтів. Дослідження з використанням МРТ дозволили зробити припущення, що хоча клінічні симпотоми та ознаки церебральної емболії спостерігаються у меншості пацієнтів (~20%–30%), у значно більшої кількості пацієнтів з ІЕ спостерігаються безсимптомні церебральні емболії та інші мозкові ураження, пов’язані з ІЕ (~30%–50%)[90, 91].
Найвищий ризик емболічних ускладнень спостерігається у пацієнтівдо того, як діагноз ІЕ є веріфікованим. В перші 2 тижні після встановлення діагнозу та початку антибактеріальної терапії емболічний ризик лишається значущим, але драматично знижується через 2 тижні. Сам факт виявлення вегетацій при ІЕ є фактором ризику емболічних ускладнень [89].Хоча літературні дані про дослідження з обмеженим використанням ЧСЕхоКГ з ретроспективним дизайном, гетерогенними визначеннями ІЕ та обмеженою кількістю пацієнтів дозволяють припустити, що розмір вегетацій не є предиктором емболії при ІЕ, два великих проспективних рандомізованих дослідження свідчать про достовірну асоціацію між розміром вегетацій та ризиком емболічних ускладнень [89, 92].
Проспективне дослідження з участю 211 пацієнтів з лівобічним ІЕ показало, що частота емболічних ускладнень після призначення антибіотиків було пропорційним розмірам вегетацій з достовірним значущим зростанням емболічних ризиків при розмірі вегетацій>10 мм у пацієнтів із стафілококовою інфекцією та у пацієнтів з ІЕ мітрального клапану [93]. В недавньому проспективному багатоцентровому європейському дослідженні з участю 384 послідовно рандомізованих пацієнтів з систематичним використанням ЧСЕхоКГ для діагностики та встановлення діагнозу ІЕ розмір вегетацій>10 мм та виражена мобільність вегетацій була незалежними предикторами нових емболічних подій після призначення антибіотиків [92].
Терапевтичні рекомендації щодо ведення хворих ІЕ не входять в завдання даних рекомендацій та є предметом відповідних рекомендацій з лікування ІЕ, наведених в літературних джерелах. Якщо коротко, то розмір вегетацій >15 ммє незалежним предиктором смертності. Крім того, ЧСЕхоКГ у 178 послідовно рандомізованих пацієнтів з доведеним ІЕ дозволило зробити висновок, що у пацієнтів з високо мобільними вегетаціями розміром >15 ммпрогноз поліпшується при ранньому хірургічному втручанні [94].Критичним є той факт, що характеристики вегетацій в цих дослідженнях визначалися переважно за допомогою багатопланової ЧСЕхоКГ, а «висока мобільність» вегетацій визначалася як педункульовані вегетації з їх пролабуванням через площину коаптації клапанних стулок протягом кардіального циклу (напр., вегетації МК з пролабуванням в ЛШ в діастолу та в ЛП в систолу). Згідно сучасних рекомендацій, раннє хірургічне втручання при ІЕ є рекомендацією класу IIBдля вегетаційз розміром >10 ммнезалежно від наявності клінічних ознак емболічних подій. ЕхоКГ предиктори емболізації при ІЕ наведені в Таб. 6.
Повторні емболії при персистуючих вегетаціях, діагностованих за допомогою ЕхоКГ є рекомендацією для хірургічного втручання класу ІІА [95].
Рекомендації з ЕхоКГ у пацієнтів з підозрою на ІЕ.
ЕхоКГ є рекомендованою
ТТЕхоКГ є рекомендованою
-
Оцінка першої лінії (початкова) при підозрі на ІЕ з позитивною гемокультурою або новим аускультативним шумом.
-
Повторна оцінка стану при ІЕ високого ризику щодо прогресування або ускладнень або при змінах в об'єктивному стані або результатах інших додаткових обстежень.
-
Оцінка гемодинамічних наслідків ІЕ (напр., клапанна регургітація, формування деструктивних шунтів або фістул, дилатація камер, та порушення функції).
-
Повторна ТТЕхоКГ наприкінці антибактеріальної терапії для динамічної оцінки та вихідних даних для наступних спостережень.
ЧСЕхоКГ є рекомендованою
-
Діагностика ІЕ та його ускладнень, коли рівень клінічної підозри є проміжним або високим, незалежно від негативних результаті.
-
Дослідження першої лінії при підозрі на ускладнення ІЕ, таких як абсцеси, фістули, перфорація стулок клапанів, або при клінічній підозрі на ендокардит клапанного протезу.
-
Динамічне спостереження плину ІЕ з високим ризиком прогресування або ускладнень, або при змінах к об'єктивному статусі або даних інших додаткових обстежень (напр., персистуюча лихоманка та / або позитивна гемокультура, персистуючі емболічні події, планування хірургічного втручання, підозра на погіршення клапанної функції або СН).
-
Повторна ЧСЕхоКГ через декілька днів після першого негативного результату (≈7 днів), якщо рівень підозри щодо ІЕ лишається високим.
ЕхоКГ не є рекомендованою
-
Транзиторна лихоманка без бактеріемії та нових шумів.
-
Транзиторна бактеріемія з нетиповим для ІЕ збудником та / або документоване невнутрішньосудинне джерело інфекції.
-
Рутинне спостереження неускладненого ІЕ, коли додаткова візуалізація очевидно не призведе до зміни тактики лікування.
Таб. 6. ЕхоКГ та інші предиктори системної емболії та інсульту
|
ЕхоКГ предиктори системної емболії та інсульту
|
-
Видимі вегетації підчас ТТЕхоКГ та ЧСЕхоКГ
-
Формування асбцесу
-
Високо мобільна вегетація
-
Розмір вегетації >10-15 мм
-
Ендокардит МК, особливо передньої стулки
-
Вегетації на двох клапанах
|
|
Інші предиктори
|
-
Грибковий ІЕ
-
ІЕ, викликаний S. aureus
-
ІЕ, викликаний Streptococcus bovis
-
Антибіотикотерапія (ризик інсульту знижується через 1-2 тижні)
|
Небактеріальний тромботичний ендокардит
Верукозний (бородавчастий) ендокардит або ендокардит Лібмана-Сакса.
Вперше описані Лібманом та Саксом в 1924[96], ці звичайно малого розміру (1- 4 мм), але часто досить великі «горбки»складаються з гранулярного матеріалу, що містить імунні комплекси, тільця гематоксиліну та тромбоцитарні тромби без бактеріального вмісту. Ехокардіографічно, не зважаючи на «ехо-структуру», що нагадує вегетації при ІЕ (Таб. 5) та таку саму, як і при ІЕ, локалізацію, вони звичайно виглядають менш аморфними, більш округленими та не асоціюються з клапанною деструкцією. Їх знаходять у до 43% пацієнтів із системним червоним вовчаком (СЧВ) підчас ЧСЕхоКГ, типово уражують вільні краї мітральних стулок (зона високої швидкості кровоточу; Рис. 18), але можуть вражати будь яку частину стулки, а також аортальний та трикуспідальний клапани [97].
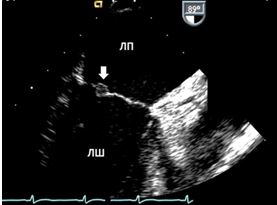
Рис. 18. Рис. 18. Антифосфоліпіднийсиндром. ЧСЕхоКГмолодоїдорослоїжінкизантифосфоліпіднимсиндромомпісляемболічногоінсульту. Середньо-стравохідний зріз на 89о в систолудемонструє маленьку округлу м’якуехогенну масу (стрілка) на кінці передньої стулки МК. Це утворення підчас ТТЕхоКГ не візуалізувалося. Маса розсмокталася після призначення варфарину.
Ці ураження звичайно є безсимптомними, але можуть ускладнюватися ІЕ, дисфункцією клапану (взагалі, нетипово) та системними емболія ми. В великому дослідженні з ЧСЕхоКГ пацієнти з СЧВ з клапанними «горбки», потовщенням клапанних стулок або клапанною дисфункцією мали зростання на 22% частоти комбінованої кінцевої точки, до якої входили інсульт, периферичні емболії, СН, ІЕ та показання до протезування клапану, порівняно з ризиком 8% у пацієнтів без клапанних дефектів [25]. Хоча дуже вірогідно, що вегетації Лібмана-Сакса представляють собою вальвуліт у субстраті [96], досі не знайдено асоціації між клінічними або лабораторними маркерами активності захворювання та частотою розвитку цих уражень.
Подібно до «вилікованих» вегетацій при ІЕ (Таб. 5), ліковані «горбки»можуть виглядати як ехогенні кальциновані вузлики, що іноді призводять до резидуальної клапанної дисфункції, здебільшого до регургітації. Рутинне ЕхоКГ обстеження є рекомендованим для хворих з СКВ. Втім, для клініциста звичайно є замало об’єктивних показань для призначення ЕхоКГ (напр., лихоманка, емболічні феномени та нові аускультативні шуми).
Існуєбагато достовірних доказовихлітературних даних, що свідчать про те, що хворі з СЧВ з антифосфоліпідними антитілами (СЧВ антикоагулянтними та/або імуноглобулінами Gантикардіоліпінами) мають ризик розвитку ендокардиту Лібмана-Сакса втричі вищий порівняно з пацієнтами без наявності антифосфоліпідних антитіл [98]. Тому у пацієнтів з вовчаком з антифосфоліпідними антитілами рекомендоване рутинне динамічне ЕхоКГ спостереження. Ми також рекомендуємо рутинне ЕхоКГ спостереження у пацієнтів з первинним антифосфоліпідним синдромом, зважаючи на високу частоту розвитку НБТЕ (32%) у таких пацієнтів [99].
Дегенеративний ендокардит або НБТЕ. Хоча термін «марантичний» (дегенеративний) також застосовувався для люпус-асоційованих верукозних клапанних уражень [96], сьогодні його частіше застосовують для описання неінфекційного тромботичного ендокардиту, асоційованого із злоякісними утвореннями, особливо такими, що пов’язані з солідними метастатичними карциномами та легеневими, панкреатичними, шлунковими та кріптогенними аденокарциномами (Рис. 19) [100]. Цікаво, що мієлодиспластичні синдроми також асоціюються із розвитком НБТЕ з високою частотою розвитку марантичних вегетацій [99]. Фульмінантні стани, такі як сепсис та опіки також можуть асоціюватися з розвитком НБТЕ. Злоякісні пухлини часто асоціюються з гіперкоагулянтними станами. Так, відомо, що в 15% випадків у таких пацієнтів трапляються тромбоемболічні події підчас хвороби, а дослідження postmortemвиявляють до 50% випадків глибоких венозних тромбозів [101].
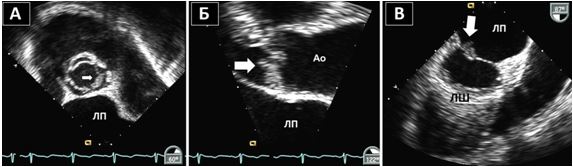
Рис. 19. Дегенеративний ендокардит. Зображення отримані у чоловіка з раком сечового міхура та багато клапанного (поєднаного) дегенеративного ендокардиту. А. Перегорнуте зображення середньо-стравохідного зрізу АК в систолу на 60о, що демонструє виражене потовщення лівої коронарної стулки (стрілка). Б. На перевернутому зображенні середньо-стравохідного зрізу по довгій вісі ЛШ на 122о очевидно, що до лівої коронарної стулки прикріплена м’яка велика маса (стрілка). В. Також видно, що до стулки МК також прикріплена маса середньої ехогенності (стрілка) – середньо-стравохідний 2-камерний зріз.
Встановлено, що у до 50% пацієнтів з НБТЕ можутьяк наслідок розвиватисясистемні емболічні події. Марантичні вегетації складаються з тромбоцитів та фібрину, дуже рідко викликають значущу клапанну дисфункцію, та класично уражують передсердну поверхню МК та шлуночкову поверхню АК. Їх ехо-структура та локалізація не відрізняється від таких для вегетацій при ІЕ, а розмір також може варіювати від маленького до досить великого. Втім, при НБТЕ звичайно присутні також значне та дифузне потовщення стулок залученого клапану, що допомогає в диференційній діагностиці ІЕ та НБТЕ [99].
Як і при ІЕ, ЧСЕхоКГ має значно вищу чутливість в ідентифікації НБТЕ порівняно з ТТЕхоКГ, тому при негативних результатах ТТЕхоКГ пацієнтам з клінічною підозрою на НБТЕ слід призначати ЧСЕхоКГ [102, 103]. Зважаючи на те, що здатність до характеристики тканин у ЕхоКГ є обмеженою, рекомендується спочатку ретельно описувати ЕхоКГ характеристики будь-яких об'ємних утворень, пов’язаних з клапанами, а потім в описані бажано наводити диференційну діагностику, базуючись на об’єктивному статусі пацієнта (Таб. 7).
Таб. 7. Рекомендації щодо винесення до заключення об'ємних утворень, асоційованих з клапанами.
|
1. Ретельне ЕхоКГ описання
|
-
Ехогенність / ехо-структура: спроба диференціювати «міокард-подібну» ехогенність бід більш ехогенних сигналів та гіперехогенних утворень з ревербераціями (тінями), що найчастіше представляють собою кальциноз
-
Розмір: довжина та ширина в мм
-
Форма / контури:«сидячі» на широкій основі або на ніжці; аморфні, з нерівними краями, дольчасті, довгасті, лінійні, округлі, «волохаті», ниткоподібні, подібні до морської анемони, тощо.
-
Локалізація: передсердна або шлуночкова поверхня АВ-клапанів, на АК з боку аорти або з боку ЛШ, на вільному краю стулки, на основі стулки, прикріплення до хорд.
-
Рух: залежний або незалежний від руху клапану; мобільність слабка, помірна або висока (див. текст)
-
Асоційовані з: клапанна регургітація, клапанний стеноз, мікотична аневризма клапану, деструкція клапану, параклапанний абсцес, перфорація стулки, зяяння протезу
-
Описання положення кільця клапанного протезу (напр., добре позиціоноване), наявність «гойдання», стан відкриття та закриття механічних протезів (напр. нормальна або обмежена екскурсія протезу в мітральній позиції в діастолу, тощо)
|
|
2. Диференційний діагноз
|
-
Завжди намагайтеся відповісти на запитання клініциста або дати відповідь на безпосереднє показання до проведення ЕхоКГ.
-
Звичайно слід навести дві або три найбільш вірогідні причини, або привести суть диференційного діагнозу в заключенні. Якщо симптоматика пацієнта є досить типовою, а ЕхоКГ знахідки дають високу ступінь підозри конкретної патології, можна використовувати формулювання «висока ступінь підозри» або «найбільш вірогідно» відповідно до конкретної нозології.
-
Якщо клінічна об'єктивна симптоматика є нечіткою, та / або ЕхоКГ характеристики є нечіткими, в заключення можна виносити 2-3 нозології, що потребують дифдіагнозу відповідно до вигляду об'ємного утворення, віку пацієнта, потенційних факторів ризику та відомої епідеміології.
|
Рекомендації з ЕхоКГ у пацієнтів з підозрою на неінфекційний ендокардит
ЕхоКГ є рекомендованою
-
Динамічне спостереження (ТТЕхоКГ) у пацієнтів з первинним антифосфоліпідним синдромом (АФЛС), зважаючи на високу частоту небактеріального тромб-ендокардиту у даної групи пацієнтів.
-
Динамічне спостереження (ТТЕхоКГ) у пацієнтів із СЧВ із вторинним АФЛС.
ЕхоКГ не є рекомендованою
-
Пацієнтам із СЧВ за відсутності клінічних ознак загострення (лихоманка, емболічні події та нові аускультативні шуми).
Папілярні фіброеластоми
ПФЕ обговорюються окремо в розділі «Пухлини серця» даних рекомендацій.
Клапанні тяжі та нарости Ламбла
Клапанні нарости або тяжі визначаються ехокардіографічно як ниткоподібні структури з хвилеподібнимрухом, шириною ≤2 мм та довжиною приблизно 3 – 10 мм, локалізовані областью лінії закриття стулок клапану (Рис. 20) [104].Вони звичайно множинні, типово уражують лівобічні клапани (найчастіше МК, та вірогідніше за все представляють собою залишкові рудименти фенестрацій (частковоavulsedфенестрацій). Звичайно вони візуалізуються, як структури з хвилеподібним рухом з передсердного боку МК та шлуночкового боку АК. Нарости Ламбла також локалізуються близько лінії закриття стулок залученого клапану, а назва за автором закріплена як за тяжами, так і наростами.Втім, вірогідно, що вони не є гістологічно ідентичними, тому що нарости Ламбла виявляються гамартоматознимирозростаннями із структурою, гістологічно подібною до ПФЕ, на відміну від проривнихфенестрацій, якими є тяжі. За нашими даними, ЕхоКГ не здатна диференціювати тяжі та нарости Ламбла між собою.
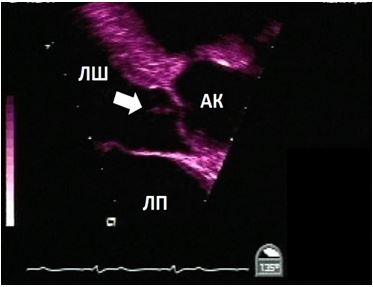
Рис. 20. Наріст Ламбла. Дане перевернуте черезстравохідне зображення по довгій вісі ЛШ демонструє АК з типовими наростами Ламбла (стрілка), що виглядають як лінійно ехо-позитивні утворення з хвилеподібним рухом під впливом коаптації стулок при закритті клапану. Звичайно особливо добре візуалізуються в діастолу.
В проспективному дослідженні підчас ЧСЕхоКГ тяжі знаходили у 40-50% всіх пацієнтів незалежно від віку та статі, а також анамнезу попередніх емболічних подій, що не змінювалися протягом часу та не були повя’зані з ризиком системних емболій [104]. Інші дослідження з ретроспективним дизайном [105] та нечітким визначенням тяжів [102], в які включалися випадки досліджень клапанних протезів [105], винайшли певні асоціації між наявністю тяжів та емболіями. Нам здається, що трактування цих останніх досліджень було суттєвоbiased. Хоча асоціація між тяжами МК та попередніми емболічними подіями була описана в літературних джерелах [106], це не означає обовязкового причинно-слідчоговзаємозв'язку, особливо у випадку знахідок мітральних тяжів, що не є незалежно асоційованими з майбутніми емболічними подіями [107]. Така сама асоціація між діагностованими підчас СЧЕхоКГ тяжами та емболічними подіями в анамнезі була описана для ситуацій з імплантованими механічними клапанними протезами за даними ретроспективних оглядів [108,109]. Узагальнюючи вищенаведене, слід зазначити, що до сьогодні не існує найдійних доказів щодо припущення про те, що тяжі на нативних клапанах або на клапанних протезах можуть бути причиною системних емболій.
Кальциноз мітрального кільця
КМК визначається як відкладення кальцію в мітральному кільці, структурі у формі літери С, що пролягає від фіброзного трикутника до фіброзного трикутника МК та, таким чином, лишає незачіпленою передню частину МК, де немає фіброзного кільця (є подовженням АК – «аорто-мітральна штора») [110]. Важкий КМК звичайно залучає більше двох третин С-подібного фіброзного кільця, що найкраще візуалізується підчас ТТЕхоКГ в PLAXта PSAX (Рис. 21).PSAX дозволяє візуалізувати товстий, грудкуватий та високо ехогенний обід, що оточує зовнішній периметр задньої стулки МК. Також звичайно візуалізуються множинні акустичні тіні та реверберації, особливо в апікальних позиціях підчас ТТЕхоКГ та в середньостравохідних зрізах по довгій осі підчас ЧСЕхоКГ. Найкраще наявність, протяжність та ступінь важкості КМК оцінювати за допомогою ТТЕхоКГ. Крім того, слід пам'ятати, що КМК може добре маскувати абсцеси задньої порції мітрального кільця при ІЕ підчас ЧСЕхоКГ [111].
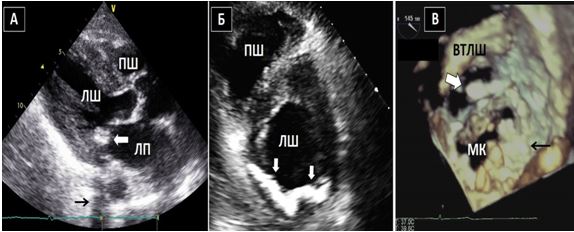
Рис. 21 Кальциноз мітрального кільця (КМК). А. ТТЕхоКГ в парастернальній позиції по довгій вісі ЛШ в діастолу демонструє велику гіперехогенну структуру задньої стулки МК, типову для КМК. Також відмітьте артефакт реверберації (маленька чорна стрілка). Б. Парастернальий зріз по короткій вісі ЛШ демонструє С-подібне гіперехогенне утворення (стрілки), що відповідає значному КМК. В. ЧСЕхоКГ у 3D МК та ВТЛШ з перспективи порожнини ЛШ. Відмітьте маленькі мобільні компоненти, асоційовані з задній мітральним кільцем та великий мобільний комісуральний компонент, що пролабує в виносний тракт ЛШ (ВТЛШ) в систолу (велика біла стрілка). Мобільнікомпонентибуливидаленіпацієнтухірургічно.
При оцінці КМК особливу увагу слід приділяти можливим низькоехогенним мобільним компонентам (вегетації, тромби), а також високоехогенним (кальцінованим) мобільним компонентам. КМК може слугувати морфологічним субстратом для розвитку ІЕ [110, 112], асоціюється з випадками значної атеросклеротичної обструкції коронарних артерій [113], та є незалежним предиктором значущого атероматозного ураження аорти [114], а також асоціюється з ризиком інсульту в популяційних дослідженнях [115, 116].
Існує багато можливих механізмів патогенезу інсульту, пов’язаного з КМК, зокрема6 1) емболізація вегетаціями при ІЕ; 2) атеросклеротичний фактор ризику ішемічного тромботичного інсульту; 3) тромбоз виразкового КМК з системною тромбоемболією; 4) емболія кальцинованими мобільними компонентами КМК; та 5) збільшення трансмітрального градієнта з послідовною дилатацією ЛП та розвитком ФП [117].
Рекомендації з ЕхоКГ у пацієнтів з КМК
ЕхоКГ є потенційно корисною
-
ЕхоКГ може визначити наявність, ступінь розповсюдженості та важкості КМК.
-
Втім, КМК типово є випадковою знахідкою і рідко буває незалежним кардіальним джерелом емболії.
Тромбоз клапанних протезів
Діагностика. Ризик тромбозів клапанних протезів складає 1 – 2% на рік, частіше вражаючи трикуспідальні та мітральні позиції, порівняно з аортальною, незалежно від режиму антикоагулянтної терапії. Для біопротезів цей ризик складає 0,5 – 1%. Тромбоз клапанних протезів може маніфестувати легеневою (при правобічних протезах) або системною (при лівобічних та рідко правобічних протезах) емболією та / або симптомами обструкції та патологічної регургітації на протезі, переважно у вигляді задишки, зазвичай за відсутності лихоманки.
Тромбоз механічних протезів, хоча і не обов'язково, часто відбувається в умовах субтерапевтичного режиму антикоагуляції. Клінічний анамнез та асоційовані знахідки підчас візуалізації є критичними, тому що часто неможливо надійно диференціювати тромб та вегетації. Як вегетації, так і свіжі тромби мають м’яку (середньої ехогенності) ехо-структуру, подібну до текстури міокарду (Таб. 5), можуть бути варіабельними за розміром та, як правило, є мобільними.Втім, тромби звичайно мають краще визначені контури порівняно з більш аморфними та високомобільними вегетаціями. На біопротезах тромби можуть відкладатися на біологічних стулках, викликаючи обмеження їх рухливості та фіксацію стулки (Рис. 22).
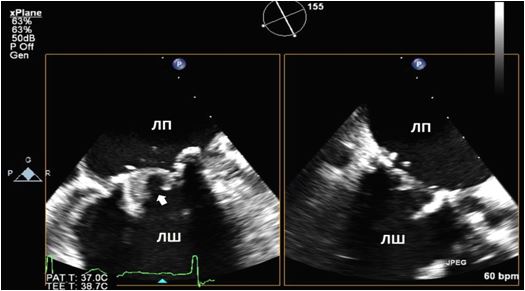
Рис. 22. Тромб протезу МК. Зображення отримані у жінки через 6 місяців після протезування МК, яка була госпіталізована із задишкою та великим діастолічних градієнтом тиску на МК. Середньо-стравохідні біпланові зрізи МК демонструють тромботичні нашарування під клапаном на передній стулці клапанного протезу та опорному кільці (стрілка). Пацієнтці було призначено антикоагулянти із зникненням тромбів через 3 місяці.
Подібно до лікованих вегетацій, «старий тромб» може бути досить ехогенним та не дуже мобільним. Тому ехокардіографіст має застосовувати системний підхід до аналізу та формування заключення, починаючи з ретельного ехокардіографічного описання знахідок (Таб. 7) та закінчуючи викладенням диференційного діагнозу в заключенні із встановленням найбільш вірогідного діагнозу, якщо це можливо. Визначення наявності та гемодинамічної значущості дисфункції протезу є першим кроком в оцінці клапанного протезу при підозрі на його тромбоз. При цьому золотим стандартом є ТТЕхоКГ. Втім, чутливість визначення тромбозу (з або без дисфункції протезу) є найбільш високою у ЧСЕхоКГ [118]. Крім того, ЧСЕхоКГ дозволяє краще оцінити відповідні порушення оклюдеру або стулки протезу.
Крім того, ефективно оцінити рухи компонентів клапанного протезу можна за допомогою МСКТ серця або рентгеноскопії. При зростанні градієнтів на клапанному протезі за рахунок його оклюзії, а не за рахунок неспівпадіння діаметру протезу площі поверхні тіла пацієнта, може виникнути складнощі при диференційній діагностиці тромбозу та формуванні панусу (хронічного розрастання фіброзної тканини в просвіт протезу), що може розвиватися як на механічному, так і на біологічному протезі (Рис. 23), а також структурного дегенеративного стенозу біопротезу [119-121].
Змішана патологія у вигляді поєднання панусу та тромбозу є нетиповою. Коректна ідентифікація механізму обструкції (порівняно зі знахідками підчас хірургічного втручання) згідно літературних даних відбувається лише в 10% випадків для ТТЕхоКГ та в 49% випадків для ЧСЕхоКГ при дисфункції механічних протезів в мітральній позиції (р<0,0001), та в 63% випадків для ТТЕхоКГ та 81% випадків для ЧСЕхоКГ при дисфункції протезів в аортальній позиції (р=0,18) [120]. Переваги ЧСЕхоКГ в ідентифікації механізмів дисфункції, в тому числі особливо для механічних протезів в мітральній позиції, обговорюється в розділі діагностики ІЕ. Клінічні та ехокардіографічні характеристики, що допомагають диференціювати механізми обструкції клапанних протезів таведені в Таб. 8.
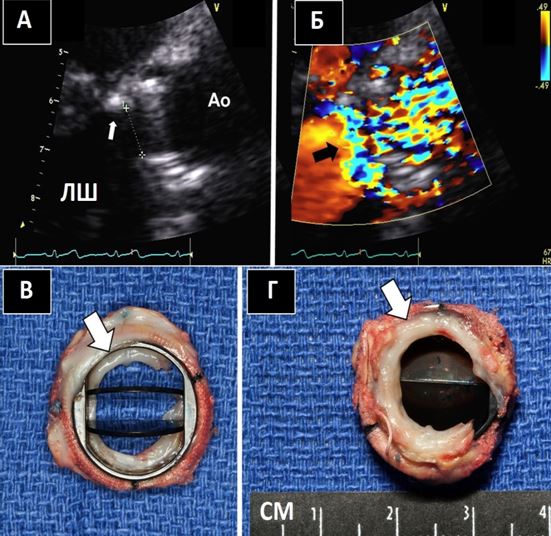
Рис. 23. Панус протезу АК. Зображення отримані у пацієнта із важкою обструкцією протезу в аортальній позиції. А. ТТЕхоКГ в парастернальній позиції по довгій вісі ЛШ демонструє нерухому ехо-позитивну (стрілка) масу безпосереднь під протезом АКщо вдається до порожнини та перешкоджає відтоку з ВТЛШ, формуючи під клапанний стеноз. Б. КДК демонструє турбулентний потік з конвергенцією (стрілка), що формується в ВТЛШ під клапаном безпосередньо перед ехо-позитивним утворенням, показаним на зображенні А. В. Експлантований протез (аортальна поверхня), на якому добре видно утворення панусу (стрілка) зверху опорного кільця. Г. Експлантований протез (шлуночкова поверхня) демонструє формування вираженого циркулярного панусу (стрілка).
Тромбоз клапанного протезу також може маніфестувати у вигляді поєднання обструкції та регургітації, у вигляді «чистої» регургітації, яка звичайно пов'язана з тим, що тромботична маса механічно заважає нормальному закриттю оклюдера (механічні протези) або коаптації стулок (біопротези), хоча інфекційні вегетації такоє можуть викликати регургітацію на протезі з таких самих механічних причин або за рахунок деструкції стулок та інших компонентів біопротезу.
Таб. 8. ЕхоКГ оцінка механізму обструкції клапанного протезу.
|
Свідчення на користь панусу
|
-
Механічний протез в аортальній позиції
-
Немає значного обмеження руху оклюдера (диску або стулок)
-
Адекватний стан антикоагуляції
-
Іденитифікована маса не є значно мобільною.
|
|
Свідчення на користь панусу
|
-
Механічний протез в позиції МК або ТК.
-
Аномальний діастолічний рух оклюдера (диску або стулок) з обструкцією.
-
Прикріплення об'ємного утворення безпосередньо до оклюдера
-
Неадекватний стан антикоагуляції
-
Ідентифікована маса є великою за об'ємом та мобільною
|
Крім того, дегенеративне порушення анатомії біопротезу (розрив стулки) може маскувати вегетацію або тромбоз, та звичайно проявляється дуже важкою регургітацією (Рис. 24) [122]. При цьому важкіть регургітації краще визначати за даними ТТЕхоКГ, а механізм дисфункції клапанного протезу – за даними ЧСЕхоКГ. Таким чином, при підозрі на тромбоз клапанного протезу показано проведення як ТТЕхоКГ, так ч ЧСЕхоКГ. Крім того, при тромбозі клапанного протезу доцільним є повторні дослідження з метою динамічної оцінки та спостереження, якщо це може призвести до змін терапевтичної тактики [6].
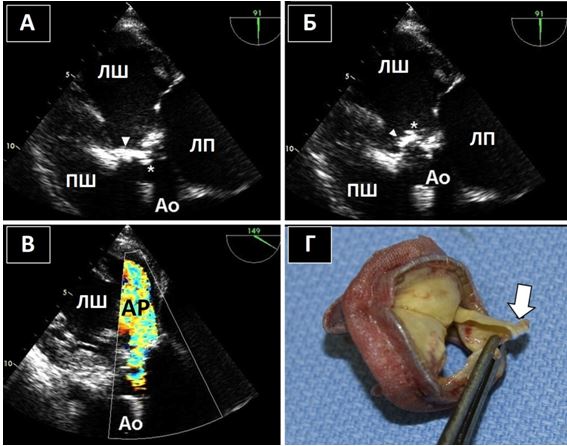
Рис. 24. Дегенерація та розрив стулки біологічного протезу АК. Зображення підчас ЧСЕхоКГ отримані у чоловіка з розривом дегенеративної стулки, у якого на початку підозрювали ендокардит. А. Глибокий трансгастральний зріз у систолу демонструє розірвану стулку (стрілка) з вузлуватим кінцем (зірочка). Б. Зображення у діастолу того ж самого зрізу демонструє важкий пролапс розірваної стулки (стрілка) разом із вузлуватим краєм (зірочка). В. КДК демонструє наявність важкої регургітації на протезі АК. Г. Інтраопераційне фото демонструє розірвану стулку з вузлуватим кінцем (стрілка).
Діагностика тромбозів клапанних протезів за допомогою ЧСЕхоКГ
Ідентифікація механізму обструкції або регургітації на клапанному протезі за допомогою ЧСЕхоКГ (Таб. 8) є критично важливою, внаслідок того, що тромбоз може бути усунутий шляхом тромболізису або хірургічно (Рис. 25). Крім того, ЧСЕхоКГ може допомогти надійно ідетифікувати пацієнтів з низьким ризиком емболії, що асоційований з проведенням тромболізису, що допомагає визначитися щодо тактики та вибору між тромболізисом та повторним хірургічним втручанням. Мобільні тромби розміром 5-10 мм в довжину асоціюються із збільшеним ризиком тромбоемболічних ускладнень підчас тромболізису.
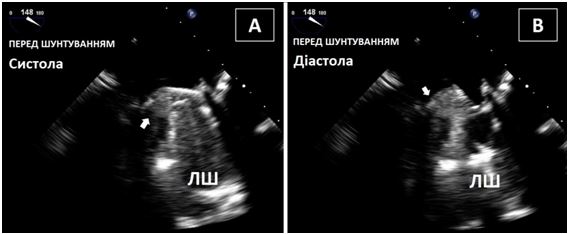
Рис. 25. Тромбоз клапанного протезу. Інтраопераційний середньо-стравохідний зріз перед операцією АКШ демонструє двостулковий механічний протез в мітральній позиції. Відмітьте закриті оклюдери (механічні стулки) в систолу (А) з заокругленою, незначної ехогенності мобільну масу з шлуночкового боку задньої стулки (стрілка). В діастолу (Б) передній оклюдер відчиняється, в той час як задній лишається зачиненим. Пацієнтувиконаноуспішнере-протезуваннябіологічнимпротезом.
Багатоцентрове дослідження 107 пацієнтів з тромбозами клапанних протезів (≈80% з яких механічні в мітральній позиції) показало, що площа тромбу за даними ЧСЕхоКГ<0,8 см2може бути незалежним предиктором низького ризику ускладнень підчас проведення тромболізису незалежно від наявної симптоматики [123]. Єдиними незалежними предикторами ускладнень тромболізису були площа тромбу за даними ЧСЕхоКГ (відношення шансів, 2.4 наприріст 1-см2) та анамнез інсультуofstroke (відношення шансів, 4.5).Як ТТЕхоКГ, так і ЧСЕхоКГ є надійними в оцінці успішності тромболітичної терапії, що призводить до покращення гемодинаміки на клапанному протезі з лізисом тромбу.
Емболічні ускладнення інтервенційних втручань
Використання ЧСЕхоКГ в комбінації з рентгеноскопією стало інтегральною частиною алгоритму візуалізації для контролю перкутанних клапанних втручань, які можуть включати транскатетерне протезування АК (TAVR або TAVI), закриття параклапанних отворів регургітації на клапанних протезах та імплантацію мітральних кліпс MitraClip (AbbottVascular, SantaClara, CA). Підчас таких процедур критичною є верифікація позиції інструментарію (напр., проводникових катетерів та ін.) та постійний моніторинг щодо тромбоутворення [124]. Хоча й рідко, але тромби також можуть утворюватися на біопротезах після їхньої доставки в ВТЛШ (Рис. 26). Врешті решт, ретельна оцінка нативного АК підчас ЧСЕхоКГ перед процедурою є також критичною, тому що вона може допомогти виявити великий мобільний кальцинований детрит, асоційований з патологічно зміненим клапаном (Рис. 27), що може бути джерелом емболії підчас розгортання клапанного протезу і, таким чином, бути протипоказом до проведення процедури TAVR[124].
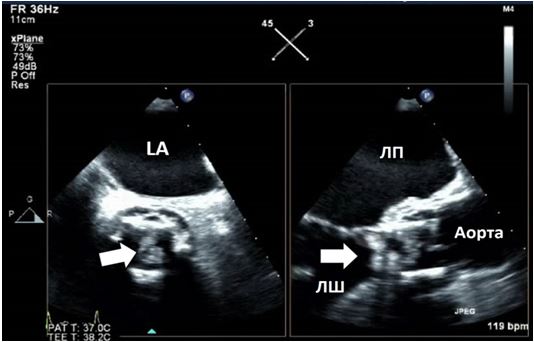
Рис. 26. Тромбоз протезу АК після транскатетерної імплантації. Середньо-стравохідні біпланові зрізи демонструють нещодавно транскатетерно імплантований протез АК із гострим вираженим тромбозом. Відмітьте великий (високо мобільний) «свіжий» тромб (стрілки).
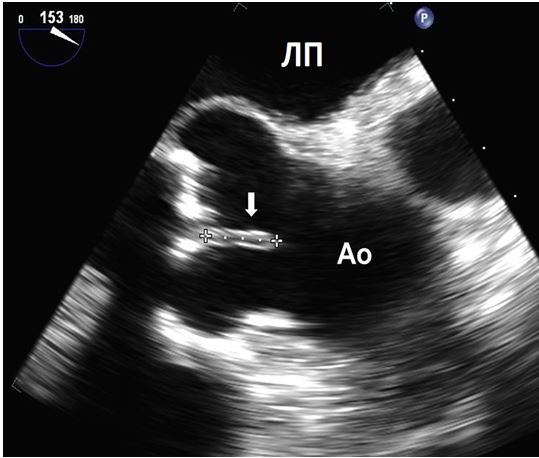
Рис. 27. Кальцинований детрит АК. Середньо-стравохідний зріз у діастолу перед транскатетерною імплантацією протезу АК демонструє подовжену (1,3 см) ерогенну масу (стрілка), прикріплену до аортального боку кальцинованого АК. Це є типовим для кальцинованого детриту. Згідно протоколу, транскатетерна імплантація протезу була відмінена.
Рекомендації з ЕхоКГ у пацієнтів з тромбозом клапанних протезів
ЕхоКГ є рекомендованою
-
Як ТТЕхоКГ, так і ЧСЕхоКГ є показаними при підозрі на тромбоз протезу клапану.
-
Повторні дослідження вважаються доцільними для повторної оцінки тромбозу клапанних протезів, якщо це може призвести до відповідної зміни тактики лікування.
-
ТТЕхоКГ та / або ЧСЕхоКГє рекомендованими для оцінки ефективності тромболітичної терапії (оцінка поліпшення гемодинамики на протезі та факту лізису чи зменшення розміру тромботичних мас).
Пухлини серця
Первинні пухлини серця є дуже рідкою знахідкою з частотою, що не перевищує 0,05% (7 випадків на >12000 аутопсій). Більшість первинних кардіальних пухлин є доброякісними, але вони можуть мати злоякісний клінічний перебіг завдяки їх частому високому емболічному потенціалу. Найбільш частими первинними пухлинами серця у дорослих є міксоми та ПФЕ, при чому обидві часто є джерелом розвитку інсульту або інших емболічних проявів. Інсульт може розвинутися внаслідок емболії компонентом пухлини або внаслідок емболії асоційованим тромбом. Первинні злоякісні пухлини серця є дуже рідкою знахідкою (переважно саркоми). Внаслідок більш частого розташування в правих відділах серця, вони частіше можуть призводити до емболії гілок ЛА, а не системних емболій.
Вторинні пухлини серця внаслідок метастазування зустрічаються приблизно в 20 разів частіше (до 1% аутопсій), ніж доброякісні первинні кардіальні пухлини, але вони де часто є джерелами емболічних ускладнень. До найчастіших злоякісних пухлин серця відносяться меланома та метастази з легенів, молочної залози, товстої кишки та шлунку.
ЕхоКГ оцінка пухлин серця
ЕхоКГ з допплерографією, включаючи КДК, має бути проведеною у всіх пацієнтів з підозрою на кардіальну пухлину. Двохвимірна та 3D-ЕхоКГ можуть визначити локалізацію, зовнішній вигляд, розмір та мобільність кардіальних пухлин [125, 126]. КДК та спектральна допплерографія є корисними щодо визначення гемодинамічних наслідків пухлин, таких як гемодинаміка мітрального стенозу при великих міксомах ЛП або патології функції АК при ПФЕ [127].
Використання контрастування з перфлютреном може допомогти у визначенні судинної природи пухлини та у диференційній діагностиці між васкуляризованою пухлиною та тромбом або вегетацією [128]. Введення мікропухирцевого контрасту може допомогти у диференційній діагностиці між неваскуляризованими об'ємними утвореннями (такими, як тромби та вегетації, що погано накопичують контраст) та високо васкуляризованими структурами (такими, як злоякісні пухлини, із значним накопиченням контрасту, що детально обговорюється у відповідних рекомендаціях з контрастної ЕхоКГ [10]. ЕхоКГ-візуалізація значно поліпшує описання пухлин, включаючи точну локалізацію стебла пухлини та тканинну структуру об'ємного утворення, значно поліпшуючи діагностичну точність та допомагає кардіохірургам у планування оперативно втручання з приводу пухлини [130].
Міксоми. Міксоми серця в 75% випадків розвиваються в ЛП, переважно із стеблиною, що росте з зони fossaovalis (>90%), хоча вони можуть розвиватися і в інших локусах (ЛШ, ПП та дуже рідко в ПШ). Міксоми можуть бути множинними у до 5% випадків. Приблизно 7% всіх міксом серця асоціюються з синдромокомплексом Carney, аутосомно-домінантною хворобою, що характеризується розвитком кардіальних та шкіряних міксом, гіперпігментацією шкіри та первинною пігментною вузловою адренокортикальною хворобою, що призводить до синдрому Кушинга.
Частіше міксоми розвиваються у жінок. Вони виглядають як об'ємні педункульовані утворення желатинозної консистенціїз гладкою, ворсистою або пухкою поверхнею. Гістологія виявляє типові розрізненні клітини міксоми в мукоїдній стромі, що часто асоційована з тромбами на поверхні пухлини (Рис. 28). Звичайно міксоми є більш-менш васкуляризованими, та можуть містити зони некрозу або фокальні кальцифікації.
З часом міксома може виростати до дуже великих розмірів, спричиняючи обструкцію отвору МК та призводячи до гемодинаміки МС та асоційованих симптомів, таких як задишка при навантаженні або при прийнятті певного положення в просторі. Звичайно міксоми є досить або дуже мобільними, часто лобулярними або пухкими, що призводить до збільшення ризику емболічних ускладнень (Рис. 28 та 29).
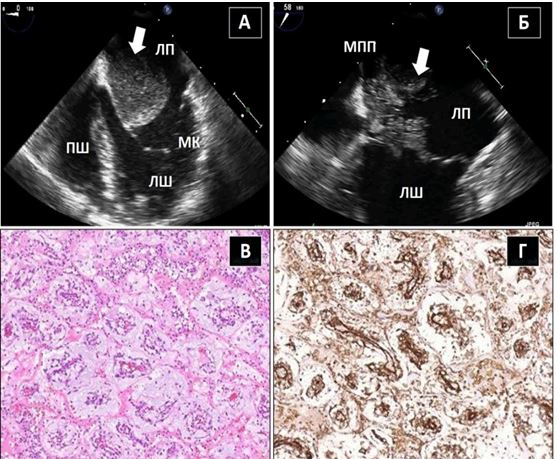
Рис. 28. Міксома ЛП підчас ЧСЕхоКГ. А. Середньо-стравохідний 4-камерний зріз великої міксоми ЛП (стрілка) в діастолу. Б. Середньо-стравохідний зріз рихлої міксоми ЛП з множинними структурами з ламаними контурами в нижній частині МПП. В, Г. Біопсія: фібротична та міксоїдна строма з ліпідними (міксома) клітинами, перемішаними з мононуклеарами, типова для міксоми (В. Гематоксилін та еозин, 100-кратне збільшення. Г. Забарвлення за Ван Гісоном, 200-кратне збільшення).
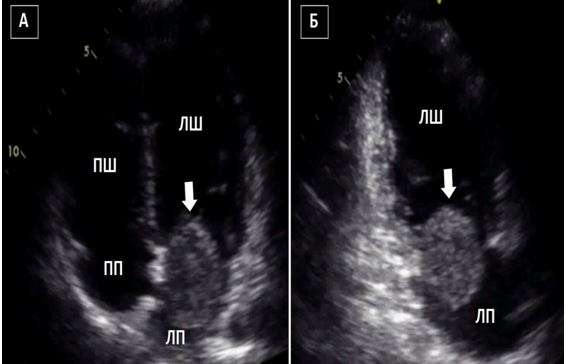
Рис. 29. ТТЕхоКГ міксоми ЛП. А. В-режим в А4С позиції демонструє, що міксома займає більшість порожнини ЛП. Б. Вигляд міксоми ЛП в А2С позиції.
До однієї третини випадків міксом ускладнюються симптомами емболізації, включаючи мозкову, що може бути німою або супроводжуватися неврологічною симптоматикою. Раптовий розвиток неврологічного дефіциту часто може бути першим маніфестним симптомом міксоми серця. Піся хірургічного видалення міксоми можуть рецидивувати. Для запобігання рецидиву міксоми звичайно потрібна широка екцизія пухлини разом з оточуючими тканинами.Хірургічне втручання є загально показаним одразу після встановлення діагнозу міксоми незалежно від наявних симптомів та емболічних ускладнень в анамнезі [130-132].
Внаслідок різного ступеня васкуляризації, підчас ЕхоКГ с контрастуванням міксоми виглядають частково непрозорими внаслідок проникнення контрасту в тіло пухлини, що допомагає диференціювати міксоми від тромбів (що не забарвлюються контрастом) та злоякісних об'ємних утворень (завжди забарвлюються контрастом цілком та повністю).
Папілярна фіброеластома. ПФЕ є другою найбільш типовою первинною кардіальною пухлиною в дорослій популяції. Переважно ПФЕ локалізується на серцевих клапанах (80%), найчастіше на АК (МК на другому місті за частотою). Втім, описані випадки ПФЕ на ендокарді будь-якої локалізації. При локалізації на клапанах, ПФЕ типово знаходять на аортальному боці АК або на шлуночковому боці МК (нижче по течії антероградного плину крові). Слід відмітити, що ця типова для ПФЕ локалізація є цілком протилежною типовій локалізації клапанних ушкоджень при ІЕ, що є доброю диференційно-діагностичною ознакою. ПФЕ рідко викликають значущу клапанну дисфункцію.
На вигляд ПФЕ є типово з гомогенною ехо-структурою, округлою, овальною, рідше неправильної форми [133], з добре демаркованою межою, та часто мобільною. Ця доброякісна пухлина звичайно має добре визначене центральне стебло з подовженням на кшталт листя пальми варіабельних розмірів (від декількох міліметрів до декількох сантиметрів, в середньому близько 1 см). При чому ризик емболічних ускладнень при ПФЕ є дуже високим. Внаслідок пальмовидних розростань ця аваскулярна доброякісна пухлина, що є дериватом ендокарду, часто нагадує морскі анемони (Рис. 30) [134].

Рис. 30 Папілярна фіброеластома (ПФЕ). А. Середньо-стравохідний зріз по довгій вісі ЛШ на 118о – АК в діастолу демонструє ПФЕ (стрілка), що прикріплюється на «стебельці» до аортальної поверхні клапану. Б. Середньо-стравохідний зріз по короткій вісі на 74о в діастолу також демонструє ПФЕ (стрілка), що прикріплюється до вільного краю лівої коронарної стулки. В, Г. ЧСЕхоКГ у 3D у іншого пацієнтадемонструє ПФЕ (стрілки) з боку висхідної аорти підчас діастоли (В) та систоли (Г). Д. Гістологія ПФЕ демонструє численні голкоподібні розростання (гематоксилін та еозин, 100-кратне збільшення).
Першою маніфестацією ПФЕ може бути інсульт, ТІА або ГІМ внаслідок емболізації коронарних артерій. До третини випадків є безсимптомними. Гістологія виявляє папілярний генез пухлини. ПФЕ звичайно сягяють <20 мм у розмірі (в середньому ~8–9 мм), та є поодинокими в>90% випадків. Чутливість ТТЕхоКГ та ЧСЕхоКГ в діагностиці ПФЕ складає, відповідно, 62% та 77% [133].
Існує потужна асоціація між лівобічними мобільними ПФЕ на стеблі та ризиком емболічних подій у прогнозі [135]. Симптомні пацієнти з великими або дуже рухливими пухлинами є підлеглими до планового хірургічного втручання безпосередньо після встановлення діагнозу, в той час, як виявлення маленьких “сидячих» нерухомих пухлин у безсимптомних пацієнтів може бути підставою для динамічного спостереження, особливо у пацієнтів з високим хірургічним ризиком [133, 135].
Рекомендації щодо медикаментозного або хірургічного лікування ПФЕ є за межами даного документу. Диференційний діагноз ПФЕ підчас ЕхоКГвключає міксоми, клапанні тяжі та нарости Ламбла.
Рекомендації з ЕхоКГдіагностики та оцінки пухлин серця
ЕхоКГ є рекомендованою
-
Повнообсягова ТТЕхоКГ рекомендована у всіх пацієнтів з підозрою на пухлини серця.
-
ЧСЕхоКГ може мати переваги перед ТТЕхоКГ в оцінці пухлин серця, особливо міксом та ПФЕ.
-
Для динамічного спостереження після хірургічного видалення пухлини з високим потенціалом рецидиву (міксоми).
ЕхоКГ є потенційно корисною
-
Контрастна ЕхоКГ з використанням агентів з мікропухирцями (напр., перфлютрен) може допомогти у виявленні тромбів ЛП та ВЛП та у диференційній діагностиці васкуляризованих пухлин з аваскулярними об'ємними утвореннями(вегетації, тромби).
-
3D-ЕхоКГ може покращити діагностичну точність при виявленні пухлин серця.
ЕхоКГ не є рекомендованою
-
У пацієнтів, у яких результати дослідження не призведуть до змін терапевтичних рішень.
Емболії з грудної аорти
Візуалізація аорти є важливою частиною інструментальної діагностики при емболічному інсульті або периферичних емболічних подіях. За визначенням грудний відділ аорти не є кардіальною структурою, втім, емболії з грудного відділу аорти включені в дані рекомендації внаслідок «географічної» близкості цієї анатомічної структури до серця, та того факту, що аорта є структура, що рутинно досліджується підчас проведення ТТЕхоКГ та ЧСЕхоКГ. Загальні аспекти візуалізації відділів грудної аорти підчас ЕхоКГ викладені у відповідних рекомендаціях з якісної та кількісної оцінки кардіальних структур [136].
Атеросклеротичні бляшки є найпоширенішим джерелом емболії з аорти. В дуже рідких випадках джерелом емболій є пухлини аорти [137].
Атеросклеротичні бляшки в аорті можуть бути субстратом для двох різних типів емболії (тромбоемболії та емболія кристалами холестерину) та двох різних синдромів артеріоартеріальних емболій (аортальний тромбоемболічний синдром [АТС] та синдром холестеринової емболії[СХЕ]).
При АТС тромб, що покриває атеросклеротичну бляшку, відривається та «мандрує» дистальніше з ітоговою оклюзією дистальнішої артерії великого калібру (сонна артерія та її гілки, тощо) [138]. При аортальній тромбоемболії типово відбувається раптовий відрив тромбу, що призводить до гострої ішемії органу-мішені. Клінічні прояви АТС включають інсульт, ТІА, інфаркт нирок та інфаркти інших басейнів кровопостачання. При СХЕ множинні маленькі емболи з холестеринових кристалів вивільняються з атероматозної бляшки протягом первного періода часу («емболічний душ») [139]. Ці емболи потрапляють в артерії маленького та середнього калібру, призводячи до ушкодження органу-мішені внаслідок механічної обструкції та/або запальної відповіді [140]. Синонімами СХЕ є атероемболізм, емболізація кристалами холестерину та синдром атероматозної емболії [141]. Клінічні прояви СХЕ включають розвиток ниркової недостатності, синдром блакитних пальців ніг, гіпереозінофільний синдром та скоріше дифузні, ніж фокальні неврологічні симптоми (напр., прогресуючі когнитивні розлади розвиваються частіше, ніш маніфестний інсульт). Патофізіологія як АТС, так і СХЕ включає шість базових елементів: 1) наявність атеросклеротичної бляшки в аорті; 2 та 3) розрив бляшки та/або тромбоутворення; 4) емболізація компонентами бляшки; 5) розташування ембола в дістальних артеріях; та 6) ураження органу-мішені.
Атеросклеротичні бляшки є проявом загального атеросклеротичного процесу, та асоціюються з відомими факторами ризику атеросклерозу, таким як артеріальная гіпертензія (АГ), цукровий діабет (ЦД), похилий та літній вік, гіперхолестеринемія та тютюнопаління. Бляшки розташовані в товщі інтими аорти, а їх розвиток є процесом, що розтягнутий на все життя (Таб. 9). На ранніх стадіях бляшки містять інтрацелюлярні та екстрацелюлярні відкладення ліпідів, є клінічно «німими», та типово починають розвиватися протягом дитинства та молодого дорослого віку. На більш просунутих стадіях бляшки стають більш складними за будовою та проходять через прогресивні зміни від атером до фіброатером та складних бляшок з крововиливами, утворенням виразок та нашарованих тромбів [142]. У деяких випадках складних атером в бляшках розвиваються кальцинюючі процесу. «Просунуті» складні ураження типово починають спостерігатися у осіб середнього та похилого віку, коли вони вже стають субстратом як для АТС, так і СХЕ.
Атероми містять некротичне ядро, що вкрите фіброзною покришкою – в такому випадку вони носять назви фіброатером. Некротичне ядро складається з пінистих кліто, клітинного детриту та ліпідів. Покришка складається з ендотеліальних та гладком’язових клітинта певної кількості сполученої тканини. Розрив фіброзної покришки призводить до тромбозу insituта «початкової події», що може призводити то ускладнення емболізацією, що може бути результатом сил власно у бляшці (напр., запалення та крововилив) або внаслідок подій на бляшці з боку просвіту аорти (напр., механічний розрив або викид компонентів в кровоток в просвіті аорти). Типово, кількість бляшок зростає від більш проксимальних до більш дистальних сегментів аорти [142]. Ризик АТС та СХЕ прямо корелює з загальним рівнем розповсюдженості атеросклерозу. Як і в інших басейнах кровопостачання, розрив бляшки в аорті може бути спонтанним, травматичним, та/або можливо бути пов’язаним з проведенням тромболітичної або антикоакулянтної терапії.
Таб. 9.Класифікація атеросклеротичних бляшок.
|
Початок
|
Стадія
|
Клінічні прояви
|
Назва ураження
|
Описання
|
|
Ранні ураження
|
I
|
Типово «німі»
|
Початкове ураження
|
Маленька кількість внутрішньоклітинних ліпідних депозитів
|
|
II
|
Ліпідні стрічки
|
Більша кількість внутрішньоклітинних ліпідних депозитів
|
|
III
|
Проміжне ураження
|
Невелика кількість екстрацелюлярних ліпідних депозитів
|
|
Пізні ураження
|
IV
|
«Німі» або клінічно маніфестні
|
Атерома
|
Екстрацелюлярне ліпідне ядро
|
|
V
|
Фіброатерома
|
Ліпідне ядро з фібротичними змінами
|
|
VI
|
Складна бляшка
|
Дефекти поверхні бляшки (виразки, геморагії, тромби; мобільна бляшка, як маркер важкого атеросклерозу, що здебільшого складається з тромботичних мас
|
Роль ЕхоКГ в візуалізації атеросклеротичних бляшок аорти
Виявлення, характеристика та кількісна оцінка аортальних бляшок може бути виконана за допомогою ЧСЕхоКГ, МСКТ або МРТ [7, 144]. ЧСЕхоКГ разом з МСКТ та МРТ є первинною ланкою візуалізації атеросклеротичних бляшок в аорті [136]. Існує декілька систем класифікації атеросклеротичних бляшок за різними параметрами, що включають товщину бляшки, характеристику поверхні та наявність або відсутність мобільних компонентів. Деталі щодо класифікації атеросклерозу аорти наведені у відповідних останніх рекомендаціях з патології аорти [145].
Найважливішими ЧСЕхоКГ зрізами для візуалізації бляшок висхідної аорти, кореня аорти та АК є середньо-стравохідні зрізи по довгій (120 – 150о) та короткій (30 – 60о) осі.Маленький дистальний сегмент висхідної аорти беспосередньо проксимальніше відходження безіменної артерії (брахіоцефального стовбура) є «сліпою плямою» ЧСЕхоКГ внаслідок інтерпозиції прового бронху та трахеї, що наповнені повітрям між стравоходом та аортою. Дуга аорти візуалізується в верхніх ЧСЕхоКГ зрізах. Нисхідна аорта може бути візуалізована від відходження підключичної артерії до відходження верхньої брижової артеріх в зрізах по короткій (0о) та довгій (90о) осі. Головним недоліком ЧСЕхоКГ є її нездатність візуалізувати абдомінальний відділ аорти дистальніше війстя верхньої брижової артерії [146].
Товщина бляшка підчас візуалізації висхідної аорти та її дуги ≥4 мм має потужну кореляцію з ризиком церебральних емболічних подій [147-149]. Виявлення складної атероми підчас ЧСЕхоКГ також асоціюється з ризиком СХЕ в нирки та шкіру, які були підтверджені даними біопсії [150, 151]. 3D-ЧСЕхоКГ може забезпечити ще більше інформації щодо деталей морфології атеросклеротичних бляшок (Рис. 31).
МСКТ та МРТ також використовуються для візуалізації атеросклеротичних бляшок в аорті [152, 153] та дозволяють долати певні недоліки ЧСЕхоКГ, такі як нездатність візуалізувати абдомінальний відділ аорти та сліпу зону, що створюється повітрям в трахеї внаслідок її інтерпозиції між дугою аорти та стравоходом). Аортографія значно програє описаним методикам щодо чутливості виявлення бляшок в аорті [154].
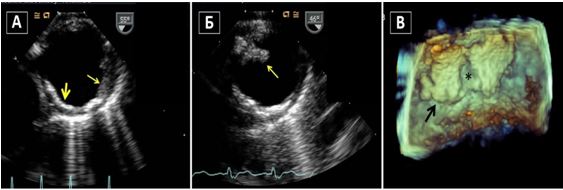
Рис. 31. Атерома аорти. А. Вехньо-стравохідний поперечний зріз у В-режимі демонструє виражену нерухому бляшку (тонка стрілка) дуги аорти, що частково кальцинована (товста стрілка). Б. Верхньо-стравохідний зріз демонструє мобільну бляшку (стрілка) дуги аорти. Мобільний компонент– це нашарування тромбу бляшки. В. ЧСЕхоКГ у 3D демонструє поверхню складної бляшки (стрілка) дуги аорти з великим центральним звиразкуванням (зірочка).
Рекомендації з ЕхоКГдіагностики та оцінки аортальних джерел емболії
Echocardiography Recommended
-
ЧСЕхоКГ є методом першої лінії для діагностики аортальних джерел емболій.
ЕхоКГ є потенційно корисною
-
Підчас ТТЕхоКГ аортальну бляшку можна виявити досить рідко. ТТЕхоКГ має низьку чутливість щодо діагностики патології аорти, а саме аортальних бляшок, порівняно з ЧСЕхоКГ.
ЕхоКГ не є рекомендованою
-
У пацієнтів, у яких результати дослідження не призведуть до змін терапевтичних рішень.
Парадоксальна емболія
Парадоксальна емболія трапляється, коли існує шлях для транзиту емболу з системної венозної циркуляції в системну артеріальну через право-лівий шунт, такий як ВОВ та дефект міжпередсердної перегородки (ДМПП). ВОВ є наслідком незлиття septumprimumтаseptumsecundumpostpartum. Анатомія та фізіологія ВОВ детально описана у відповідних рекомендаціях [155].
ВОВ є інтегральною частиною нормального кровообігу плода (Рис. 32). Воно працює як кондуїт для внутрішньоматкового кровообігу, який дозволяє оксигенованій крові, що viasinistraпокидає пупкову вену, через венозний протік (ductusvenosus) досягати овального вікна, ЛШ та аорти, таким чином забезпечуючи оксигенованою кров’ю коронарне та церебральне артеріальні кола [156].Серцевий викид (СВ) та розподіл кровотоку в организмі плоду людини демонструє домінування правих відділів серця. На середніх термінах гестації ПШ відповідає приблизно за 60 – 65%, а ЛШ – за 35 – 40% СВ. Питання, чи таке співвідношення лишається стабільним по мірі прогресування гестації, є досі дискутабельним [157].
Рис. 32. Ембріологія МПП та відкритого овального вікна (ВОВ). А. Первинна перегородка (septum primum, SP) росте з криши передсердь. Б. В septum primum розвиваються фенестрації. В. Вторинна перегородка(septum secundum) розвивається із рахунок формування внутрішньої складки стінок передсердь. Вторинний дефект середньої третини МПП (ostium secundum) у ембріона працює як кондуїт зліва на право для оксигенованої крові. Г. Передній верхній край овального вікна (fossa ovalis, ОВ) первинна та вторинна перегородки у ембіона лишаються незлитими (незрощеними), формуючи ВОВ. Стрілка вказує на напрям току крові через ВОВ з ПП в ЛП ембріону. Сині та рожева точки визначають розвиток венозного притоку в передсердя через порожнисті та легеневі вени. ЕП – ендокардіальна подушка, ОВ – овальне вікно, ОР - ostium primum; OS – ostium secundum; SP – septum primum; SS – septum secundum [229].
ВОВ формується в результаті перекриття septumsecundumта верхнього апікального рудименту septumprimum. Якдобревідомо з ембріології, septumprimumформується на ранніх термінах гестації з даху передсердя та росте в напрямку ендокардіальних подушок. Після злиття septumprimumfusesз ендокардіальними подушками, в її верхній частині утворюється серія фенестрацій, що формують ostiumsecundum. Septumsecundumформується з інвагінації стінки передсердя пізніше у гестації правіше від верхнього залишку septumprimum. Foramenovaleє розривом (проміжком) або тунелем між нижнім краємseptumsecundumта верхнім краємseptumprimum.
Системний судинний опір, що є досить низьким у плода внаслідок низького опору плацентарного кровообігу, після пологів та перев’язки пуповини різко зростає [158]. Раптове зростання постнавантаження призводить до драматичного зростання діастолічного тиску в ЛШ та, відповідно, тиску у ЛП. Це призводить до зростання легеневого венозного повернення в ЛП та зниження внутрішньогрудного комплаєнсу, що призводить до функціонального закриття foramenovale, що типово відбувається протягом декількох хвилин після пологів. Анатомічне закриття foramenovaleтипово відбувається протягом 9 – 30 місяців після народження, хоча може тривати й довше [159, 160].
Серії аутопсій 965 індивідів показали, що частота ВОВ знижується звіком від 34,3% в групі молодих від 0 до 30 років до 20,2% в групі літніх пацієнтів, що померли у віці від 80 до 99 років [161]. Таким чином, виявлення ВОВ може вважатися скоріше варіантом норми, ніж патологічною знахідкою.
Типово ВОВ лишається закритим внаслідок певного градієнту тиску між ЛП та ПП, тому ніякого ліво-правого шунтування не спостерігається. При певних умовах відбуваються такі зміни гемодинаміки, при яких з’являється транзиторний позитивний градієнт між ПП та ЛП, наприклад, при збільшенні тиску в ПП, що спостерігається при гострій або хронічній легеневій гіпертензії або підчас проби Вальсальви. В результаті ВОВ може відкриватися з появою право-лівого шунтування крові.
Анатомія ВОВ є дуже варіабельною: від анатомічного клапанного тунелю, що щільно прилягає до міжпередсердної перегородки (МПП), до широко відкритого ВОВ внаслідок формування гребінця з боку ЛП, що призводить до постійного ліво-правого шунтування крові.
Наявність аневризми МПП (АМПП) збільшує вірогідність ВОВ порівняно з рештою популяції. АМПП діагностується за наявності чітково зсуву або мобільної екскурсії області septumprimum, що відповідаєfossaovalis, МПП в напрямку ПП або ЛП, або при комбінованій екскурсії вправо та вліво (частіше залежно від фаз дихання) на ≥15 мм від середньої лінії [155, 162 – 164].
Мобільний аневризматичний сегмент знаходиться в товщі septumprimum та може викликати ретракцію septumprimum, призводячи до значного шунтування між передсердями. Вважається, що АМПП може виконувати роль сітки, що уловлює тромби або детрит з їх подальшим транзитом через ВОВ. При наявності надлишкового Євстахіїва клапану, що є ембріологічним рудиментом клапану нижньої порожнистої вени (НПВ) та правого клапану венозного синусу, він може направляти кровотік з НПВ в напрямку правопередсердного краю ВОВ.
Хоча ВОВ спостерігається у приблизно 25% загальної популяції, деякі дослідження виявляли його у до 40% молодих пацієнтів з кріптогенними інсультами [162, 163, 166-172].
Кріптогенний інсульт визначається як інсульт невідомої етіології, незважаючи на ретельне обстеження. Хоча ВОВ часто призначають винуватцем криптогенного інсульту, досі не знаядено чіткої асоціації між ними. Зважаючи на високу частоту безсимптомного ВОВ в популяції, клініцисти часто схильні вважати ВОВ джерелом інсульту, хоча ВОВ може бути цілком випадковою знахідкою. Припускається, що вищий ризик інсульту може бути у пацієнтів із поєднанням ВОВ та АМПП. Вважається що ВОВ у комбінації з АМПП створює середовище, що сприяє тромбоутворення подібно до ФП з дисфункцією ЛП [173, 174]. Це феномен може підсилюватися у пацієнтів із гіперкоагулянтними станами. Втім, це може бути лише ознакою більшої здатності ВОВ до більш широкого розкриття. Потужна асоціація між ВОВ та ішемічним інсультом відзначена у пацієнтів всіх вікових груп [163, 171], хоча далеко не всі дослідження підтримують наявність асоціації між криптогенними інсультами та ВОВ. Не зважаючи на непрямі доказові дані, проспективні дослідження не змогли продемонструвати взаємозв'язок між повторними інсультами та наявністю ВОВ або АМПП, або розміром право-лівого шунта [175-178].
Роль ЕхоКГ в діагностиці при підозрі на парадоксальну емболію
Для оцінки роліВОВ у розвитку криптогенного інсульту повинна бути діагностована наявність право-лівого шунтування. Якщо рутинне КДК не визначає шунту через ВОВ, його слід дослідити детальніше шляхом заниження ліміту Найквіста (з обережністю, щоб не занизити його занадто сильно) або введення збовтаного фізіологічного розчину для контрастування. Збовтаний фізрозчин вводиться внутрішньовенно відповідно до існуючих рекомендацій [10]. Ін’єкція виконується в стані спокою пацієнта з виконанням певних провокативних маневрів для підвищення тиску в ПП (кашель або проба Вальсальви). Важливо ідентифікувати відхилення МПП вбік ЛП, що підтверджує підвищення тиску в ПП. Наявність ВОВ підтверджується, якщо протягом ін'єкції контрастні пухирці збовтаного фізрозчину помічаються в порожнині ЛП протягом трьої кардіальних циклів після повного наповнення контрастом порожнини ПП (Рис. 33).
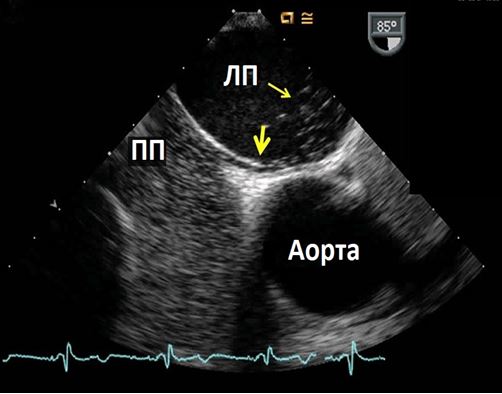
Рис. 33. Візуалізація ВОВ після в/в ін'єкції збовтаного фізіологічного розчину. ЧСЕхоКГ у В-режимі з середньо-стравохідного зрізу на 85о демонструє ВОВ (товста стрілка). Великакількістьпухирцівфізрозчину (тонкастрілка) візуалізуєтьсявЛП.
Якщо контрастування збовтаним фізрозчином помічається в ЛП через 5 кардіальних циклів після повного забарвлення контрастом порожнини ПП, то слід заподозрити наявність у пацієнта легеневих артеріо-венозних мальформацій (АВМ)[167, 179].Втім, важливо відмітити, що термін, за який в ЛП з'являється контраст використовується, як досить грубий маркер, що не є занадто надійною диференційно-діагностичною ознакою локалізації шунтування крові. У пацієнтів з тунельним типом ВОВ, низьким тиском в ПП та відтермінованим кашлем або пробою Вальсальвипоява контрасту в ЛП теж може бути відтермінованою. І навпаки, у пацієнтів із значними легеневими АВМ, які призводять до станів з високим викидом, може спостерігатися рання поява контрасту в ЛП. Найкращою диференційно-діагностичною ознакою точної локалізації шунта є власне пряма візуалізація шунта. При персистуючому вигинанні МПП в бік ПП ВОВ може бути постійно закритим, що може призводити до хибно-негативних результатів дослідження з контрастуванням. Якщо підозра на ВОВ лишається актуальною навіть після адекватно проведеного контрастного дослідження, слід призначити повторне введення збовтаного фізрозчину з більш ретельно вивіреним за часом
Важливе ретельне виконання вимог до візуалізації з контрастуванням збовтаним фізрозчином. Повинен бути виконаний запис адекватної кількості кардіальних циклів для коректної оцінки на предмет наявності ВОВ. Контрастування збовтаним фізрозчином може бути виконаним декілька разів за необхідності.
Були запропоновані різні класифікації та схеми оцінки розмірів шунтів, хоча жодна з них до сьогодні не є одностайно прийнятою [180].
Втім, наявність>20 пухирців, що пройшли черезВОВ з ПП в ЛП підчас проби, вважається ознакою шунта великого розміру. Якщо результати ТТЕхоКГ підтверджують наявність право-лівого шунта, ЧСЕхоКГ є показаним для підтвердження наявності ВОВ та для виключення іншої морфології шунтів, наприклад, вторинного ДМПП. Інші шунти, які слід виключати, включають легеневі АВМ, первинні ДМПП, дефекти венозного синусу та неприкритий коронарний синус.
Зважаючи на високу варіабельність анатомії ВОВ, 3D-ЧСЕхоКГ може бути цінною для деталізації у визначенні анатомії та структурних взаємовідносин (Рис. 34), що необхідно для успішного закриття шунта при плануванні імплантації оклюдера.
Роль ЕхоКГ в виконанні перкутанного або хірургічного закриття ВОВ лежить за межами даного документу; детальне описання ролі ЕхоКГ в таких умовах можна знайти у відповідних рекомендаціях щодо тактики ведення хворих з ВОВ та ДМПП [155].
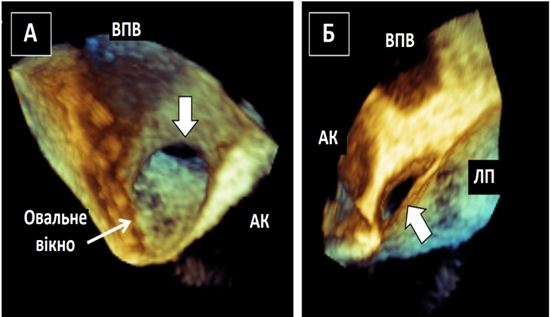
Рис. 34. ВОВ підчас ЧСЕхоКГ у 3D. В режимі “zoom” візуалізується велике ВОВ (стрілка), що візуалізується з порожнини ПП (A) та ЛП (Б).
Рекомендації з ЕхоКГдіагностики та оцінки при підозрі на парадоксальну емболію
ЕхоКГ є рекомендованою
-
ТТЕхоКГ є рекомендованою для діагностики право-лівих шунтів та оцінки анатомії МПП у пацієнтів, що поступили з криптогенним шоком, особливо за умов підвищеного тиску в ПП з документованою ТЕЛА або глибоким венозним тромбозом нижніх кінцівок або тазових вен.
-
Якщо шунт неможливо виявити за допомогою КДК, слід провести внутрішньовенне УЗ-контрастування (включаючи збовтаний фізрозчин в стані спокою та з проведенням провокаційних проб (кашель, проба Вальсальви).
-
При неінформативності ТТЕхоКГ слід провести ЧСЕхоКГ.
ЕхоКГ є потенційно корисною
-
3-D ЧСЕхоКГ набуває особливої цінності в оцінці анатомії МПП.
ЕхоКГ не є рекомендованою
-
ЕхоКГ для діагностики право-лівих шунтів не є рекомендованою у пацієнтів (типово літніх) з іншими більш вірогідними причинами інсульту або системної емболії.
Емболія гілок легеневої артерії
ТЕЛАщорічно трапляється приблизно у 250,000 пацієнтів із значною захворюваністю та смертністю, що визначає величезну актуальність цієї проблеми в сучасній охороні здоров’я [181]. Найбільша питома вага легеневих емболів (90–95%) є результатом тромбозу глибоких вен нижніх кінцівок, у більшості випадків із залученням проксимальних (підколінних або більш центральних) вен (Рис. 25). Маси з мобільними елементами, ендокардит, тромби, прикріплені до відповідних локусів, та тромби або пухлини, що походять з будь-якої локалізації в правих відділах серця (ПП, ПШ, ТК, ЛА або КЛА) також можуть бути потенціальними джерелами ТЕЛА, хоча і трапляються не так часто, як наслідки глибоких венозних тромбозів [181, 182].
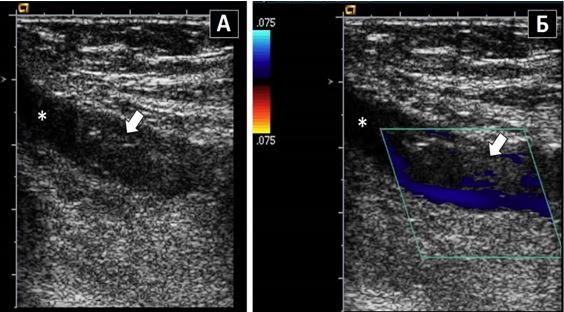
Рис. 35. Глибокий венозний тромбоз. Дуплексне сканування демонструє великий тромб (стрілки) в провій стегновій вені (зірочка) в В-режимі (А) та підчас КДК (Б).
ТЕЛА є третьою за частотою найпоширенішою причиною судинної смертності після ГІМ та інсульту, а також є ведучою причиною внутрішньошпитальної смертності, яку можна попередити. Незважаючи на ранню діагностику та лікування, клінічні виходи при ТЕЛА є досі варіабельними з дуже різними даними щодо частоти [183-186].Приблизно 10% або більше випадків симптомної ТЕЛА вважаються швидко фатальними, а ще близько 5% пацієнтів помирають після початку лікування. До третини пацієнтів, що виживають, мають резидуальні симптоми, а у 2% розвивається стійка тромбоемболічна легенева гіпертензія внаслідок рецидивуючої ТЕЛА [187].
У пацієнтів з підозрою на ТЕЛА слід швидко виконувати стратифікацію пацієнтів високого та низького ризиків, що є критичним для обрання правильної стратегії лікування [188-191].ЕхоКГ зарекомендувала себе як цінний стратифікаційний метод серед багатьох інших прогностичних маркерів, що досліджувалися в даній популяції пацієнтів [192-196].
Роль ЕхоКГ в діагностиці ТЕЛА
ЕхоКГ не є методом візуалізації першого вибору для діагностики ТЕЛА, але вона широко використовується для стратифікації ризику пацієнтів. Як ТТЕхоКГ, так ЧСЕхоКГ забезпечують неінвазивну оцінку розмірів ПШ та ЛШ, їх систолічної функції, регіональних порушень скоротливості, клапанної патології та гемодинаміки щодо тисків наповнення шлуночків та тисків в правих відділах серця. Транзит тромбів за допомогою ЕхоКГ візуалізувати вдається рідко, але якщо вдається, то звичайно вони виглядають як змієподібні тромби, що перетинають на своєму шляху праві відділи серця (Рис. 36).
Типові ЕхоКГ ознаки гемодинамічно значущої ТЕЛА (Рис. 37) включають [197]:
-
Порушення деформації (стрейну) ПШ (дилатація та дисфункція);
-
Випинання МШП в бік ЛШ;
-
Дилатація проксимальних гілок ЛА;
-
Підвищення систолічного тиску в ПШ;
-
Збільшення важкості трикуспідальної регургітації;
-
Підвищення тиску в ПП (дилатація та відсутність інспіраторного колапсу НПВ);
-
Симптом МакКонелла (гипокінез базальних та серединних сегментів вільної стінки ПШ при збереженні скоротливості верхівки);
-
Рідко візуалізація тромбів на шляху транзиту з системних вен в систему ЛА.
Дилатація ПШ визначається як збільшення співвідношення ПШ/ЛШ > 1:1. Також існують інші критерії, що детально обговорюються у відповідних рекомендаціях з кількісної оцінки камер серця [51]. Сьогодні існує доказова база, що показує, що оцінка деформації ПШ у пацієнтів з ТЕЛА є прогностично важливою, а порушення стрейну ПШ асоціюються з достовірним значним збільшенням внутрішньошпитальної смертності та є одним з найкращих предикторів поганого найближчого прогнозу [198-200].
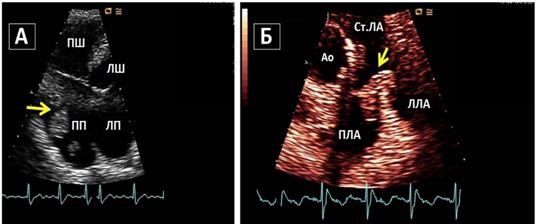
Рис. 36. Тромб в русі: рівень ПП та ЛА. А. А4С позиція демонструє великий транзитний тромб (стрілка) в ПП. Б. ЧСЕхоКГ в В-режимі на рівні ЛА демонструє тромбоембол-наїзник (стрілка) в біфуркації стовбура ЛА (СтЛА) з розповсюдження в праву та ліву ЛА.
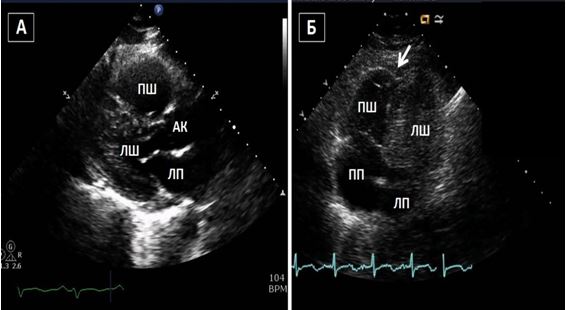
Рис. 37. ТЕЛА при ТТЕхоКГ. А. ТТЕхоКГ у PLAX демонструє значну дилатацію ПШ у пацієнта з гострою ТЕЛА. Б. ТТЕхоКГ в А4С позиції демонструє симптом МакКоннела (гіпокінез базальних та серединних сегментів вільної стінки ПШ із збереженням скоротливості верхівки).
ТТЕхоКГ не є достатньо чутливою для безпосередньої діагностики ТЕЛА [6], тому згідно рекомендацій для діагностики ТЕЛА повинні використовуватися інші візуалізаційні модальності, такі як МСКТ з контрастуванням (Рис. 38)[201]. ТЕЛА, що клінічно маніфестує з гіпотензією, визначається як масивна ТЕЛА. У пацієнтів з немасивними ТЕЛА фокусна ТТЕхоКГ повинна використовуватися для стратифікації пацієнтів на дві основні групи: субмасивна ТЕЛА – високого ризику (пацієнти без гіпотензії, абе з порушенням функції ПШ, в тому числі за даними стрейну, або з некрозом міокарду), та низького ризику (пацієнти без гіпотензії та без порушень деформації ПШ [202-205].
Звичайно, що ще однією роллю для фокусного ЕхоКГ обстеження в відділенні реанімації та інтенсивної терапії при підозрі на ТЕЛА є визначення необхідності наступних приоритетних додаткових обстежень та визначення подальшої терапевтичної тактики та стратегії, особливо у гемодинамічно нестабільних хворих [206]. Втім, слід відмітити, що збільшення співвідношення ПШ/ЛШ не є специфічним саме для ТЕЛА, а гострі та хронічні розлади структури та функції ПШ можуть існувати також у пацієнтів з хронічними обструктивними захворюваннями легенів, правошлуночковою СН, інфарктом ПШ, та деякими іншими станами [207].
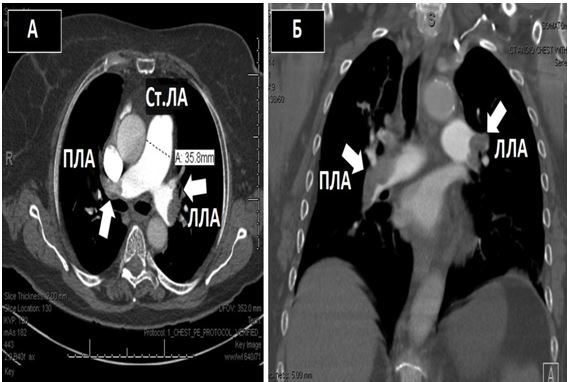
Рис. 38. ТЕЛА на МСКТ. МСКТ з контрастуванням демонструє множинні білатеральні легеневі емболи (стрілки) в аксіальному (А) та корональному (Б) проекціях.
Рекомендації з ЕхоКГдіагностики та оцінки при підозрі наТЕЛА
ЕхоКГ є рекомендованою
-
Стратифікація ризику у пацієнтів з ТЕЛА (головним чином для оцінки розмірів та функції ПШ).
-
ЧСЕхоКГ має сенс у гострих нестабільних хворих з підозрою на гемодинамічно нестабільно ТЕЛА.
ЕхоКГ не є рекомендованою
-
ЕхоКГ не є діагностичним засобом першої лінії в діагностиці ТЕЛА.
Кардіоемболії та емболії з аорти підчас кардіохірургічних та перкутанних втручань
Емболії з серця та судин є рідким ускладненням хірургічних та перкутанних втручань. До широкого розповсюдження катетеризації магістральних артерій з метою ангіографічної візуалізації та втручань, частота спонтанної емболії з аорти за даними аутопсій складала 1 – 3,4% [208-210].
Катетеризація серця
Емболії є рідким ускладненням катетеризації серця, хоча тканинний детрит вилучають з >50% направляючих катетерів [211]. Частота клінічно маніфестних емболій підчас катетеризації серця згідно літературних даних складає 1,4 – 1,9%. Найбільш вірогідно частим джерелом емболій є висхідна аорта, тому що статистично значущої різниці ризиків між використанням феморального та радіального доступів не виявлено [212]. СХЕ є дуже рідким ускладненням катетеризації серця.
Кардіохірургія
Ризик емболій з аорти підчас хірургічних втручань сильно конелює із ступенем вираженості атеросклеротичних змін аорти. Головний мозок є найчастішою мішенню таких емболій, хоча за літературними даними також реєструються емболії в різні інші периферичні органи. Хірургічна коронарна реваскуляризація несе вищий ризик емболічних ускладнень з аорти порівняно з хірургічним протезуванням або пластикою клапанів [213].За даними дослідження результатів аутопсій 221 пацієнтів в середньому віці 66 років (58,8% чоловіків) після хірургічної коронарної реваскуляризації або втручань на клапанах протягом періоду 1982-1989 рр., СХЕ спостерігався у 48 пацієнтів (21,7% даних аутопсій), в той час як тромбоемболії були знайдені в 14 з них (6,3%). Холестеринові емболії спостерігалися втричі частіше у пацієнтів, яким виконувалася хірургічна коронарна реваскуляризація (43 з 165 пацієнтів, 26,1%) порівняно з пацієнтами, яким проводилися клапанні хірургічні втручання (5 з 56 пацієнтів, 8,9%). Ризик холестеринової емболії після кардіохірургічного втручання потужно корелював із ступенем вираженості атеросклерозу висхідної аорти та віком пацієнтів. В іншом дослідженні мозок був найчастішим органом-мішеннюхолестеринових емболів (8 з 48 пацієнтів) з більш рідким ураженням селезінки (5 пацієнтів), нирок (5 пацієнтів) та підшлункової залози (3 пацієнти). 30 з 48 пацієнтів за даними аутопсій мали декілька мішеней емболізації [213].
Роль ЕхоКГ в виявленні та профілактиці підчас хірургічних втручань деталізована у відповідних рекомендаціяхASE2007 р. з відповідної інтраопераційної епіаортальної ЕхоКГ. У хірургічних пацієнтів дані ЧСЕхоКГпро ступінь вираженості атероматозного ураження аорти гарантує точну діагностику та стратифікацію ризику у таких пацієнтів при плануванні оперативного втручання [214].
Перкутанні втручання
Перкутанні катетери, проводники та інші пристрої можуть призвести до дислокації наявних інтракардіальних та інтрааортальних мас, що може викликати системні емболії. Перед будь-якими перкутанними процедурами (в тому числі перкутанна мітральна балонна вальвулопластика, закриття параклапанних патологічних токів або перкутанне закриття ВЛП) рекомендовано виключення наявності об'ємних мас, що можуть бути потенціальним субстратом емболій, шляхом ЧСЕхоКГ, наприклад інтракардіальні тромби, особливо тромбоз ВЛП.
Перипроцедурні інсульт та системна емболія можуть також спостерігатися підчас TAVR. У відповідному рандомізованому дослідженні інсульти спостерігалися у пацієнтів після TAVRз частотою від 1,5% до 6%. Збільшення ризику інсульту протягом 30 діб після процедури (включаючи великі, малі інсульти та ТІА) порівняно з частотою ризику після хірургічного протезування АК складало 5,5% порівняно з 2,4%, відповідно (р=0,04). Детальне висвітлення використання ЕхоКГ при транскатетерних втручаннях при клапанній патології можна знайти у відповідних рекомендаціях [216].
Рекомендації з ЕхоКГ у пацієнтів, госпіталізованих для кардіохірургічних або перкутанних втручань
ЕхоКГ є рекомендованою
-
ЧСЕхоКГ або інтракардіальна ЕхоКГ у всіх пацієнтів перед інтракардіальними перкутанними втручаннями для виключення потенційних кардіальних джерел емболії, що можна усунути підчас.
-
ЧСЕхоКГ рутинно перед операцією для ідентифікації та прийняття рішення щодо тактики при аортальному атероматозі рекомендована у пацієнтів з підвищеним ризиком емболічного інсульту, включаючи пацієнтів з анамнезом цереброваскулярної або периферичної аортальної патології, та пацієнтів з ознаками атеросклерозу аорти або кальцифікатів аорти за даними інших методів візуалізації, включаючи передопераційні МРТ, МСКТ або РГ ОГК. ЧСЕхоКГ часто дозволяє хірургу забезпечити індивідуальний підхід до вибору методу втручання та потенційно знизити ризик емболічного інсульту.
Інсульти в педіатричній популяції
Інсульт в молодій популяції (<50 років) спостерігається рідко, а в педіатричній популяції – дуже рідко. Дослідження показують, що щорічна частота інсульту у молодих дорослих складає 10 – 23 випадки на 100,000 населення відповідної вікової групи на рік [217, 218].З цих випадків 24 – 57% припадає на емболічні інсульти [220]. Емболічні інсульти у дітей можуть провокуватися станами гіперкоагуляції або бути наслідком парадоксальної емболії внаслідок інтракардіальних або інтраваскулярних шунтів. Як і у дорослих, інсульти у дітей можуть також бути наслідком уражень лівих відділів серця з емболічним потенціалом, таких як вегетації, пухлини та тромби.
Багато дитячих хвороб створюють гіперкоагуляційні стани. Серед найбільш розповсюджених є серповидно-клітинна анемія – у цих пацієнтів щорічний ризик розвитку інсульту порівняно із здоровою популяцією зростає у 220 разів [221]. До інших причин відпосяться дефицит протеїну С, гомоцистеїнурія, тромботична тромбоцитопенічна пурпура та гіперліпідемії.
Певні вроджені вади з інтракардіальними або інтраваскулярними шунтами також створюють умови для розвитку емболічних інсультів. Парадоксальні емболії взагалі обговорюються в даному документі вище. В даному розділі увага фокусується на анатомічних факторах, що створюють додаткові ризики для розвитку емболічних інсультів у дітей, серед яких найбільшу увагу слід приділити ДМПП та ВОВ.
Загально вважається, що ВОВ є присутнім у до 25% дорослої популяції, але типово частіше зустрічається в педіатричній популяції. ДМПП є одним з найчастіших ВВС (Рис. 39). Багато досліджень вивчали роль закриття ВОВ для вторинної провілактики інсульту після попереднії ішемічних церебральних подій. Втім, до сьогодні не існує консенсусу щодо необхідності закриття ВОВ при його виявленні [163, 222, 223].Хоча у дітей закриття ВОВ за допомогою спеціальних оклюдерів типово є безпечним та легко виконуваним [224], одне з досліджень виявило збільшення ризику ускладнень у маленьких дітей з вагою<15 kg[225].
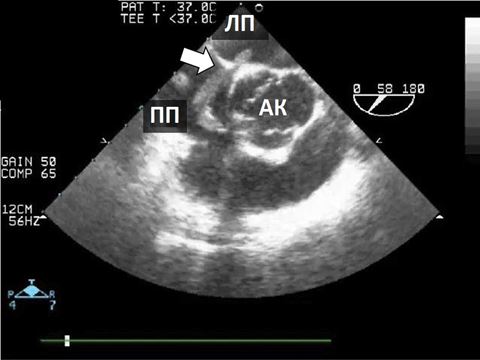
Рис. 39. ЧСЕхоКГ у дитини: середньо-стравохідний зріз по короткій вісі на рівні АК демонструє парадоксальну тромбоемболію (стрілка) черезВОВ.
Багато інших ВВС або судинних вроджених дефектів також створюють умови для легенево-системних ибо право-лівих шунтів. Крім того, наявність легеневої гіпертензії при некоригованому ВВС, такому як ДМПП або ДМШП збільшує ризик розвитку право-лівого шунту.
У пацієнтів з цианотичними ВВС часто розвивається еритроцитоз з гіперкоагуляцією, особливо у важких випадках. Хірургічна корекція загального шлуночка за Fontan часто створює фенестрацію між системним венозним кондуїтом та легеневою артерією (кондуїт за Fontan) та передсердям, виконуючи роль каналізації тиску для сприяння антероградного потоку в кондуїті, але при цьому призводячи до право-лівого шунтування крові. У таких пацієнтів також виявленно підвищення ризику інсультів [226].
Легеневі АВМ є шунтами між системою ЛА та легеневими венами, що дозволяє шунтування крові в обхід легенів. Це не тільки викликає цианоз, але може також служити обхідним шляхом для парадоксальної емболії. Існують літературні дані, згідно яких АВМ були джерелом та можливою причиною розвитку емболічних інсультів [227, 228].До інших рідких вроджених судинних аномалій, що можуть викликати емболічний інсульт, також відноситься персистуюча додаткова ліва верхня порожниста вена з дренуванням в ЛП [229].
Роль ЕхоКГ в діагностиці системних емболій у педіатричних пацієнтів
ЕхоКГ візуалізація у педіатричних пацієнтів найчастіше може бути обмежена дослідженням у В-режимі завдяки тому, що у дітей звичайно спостерігається прекрасне ехо-вікно з чудовою візуалізацією, тому ЧСЕхоКГ для верифікації потрібне дуже рідко. 3D-ЕхоКГ хоча і набуває дедальшої популярності, досі не стала основним методом діагностики ВВС в педіатричній популяції, хоча цей метод може бути дуже корисним для формування альтернативних кутів візуалізації при плануванні хірургічних та інтервенційних втручань.
Для ехокардіографістів, що не дивляться дітей рутинно, часто буває важко всебічно описати діагностовані ВВС, тому при виявленні ВВС у дитини її рекомендовано спрямовувати у відповідний провідний педіатричний заклад.
У випадках, коли стандартна візуалізація та КДК не дають адекватної відповіді, для діагностики потенціальних шляхів парадоксальної емболізації велику роль відіграє контрастування із використанням збовтаного фізрозчину (Рис. 40).
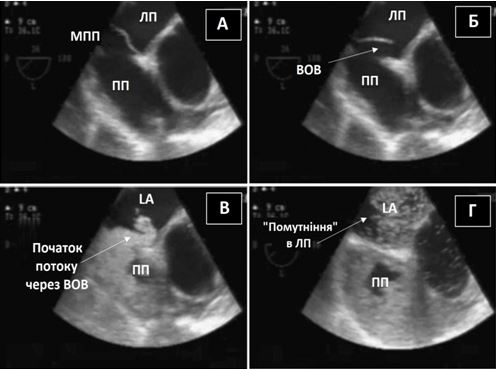
Рис. 40. ЧСЕхоКГ у дитини: ВОВ підчас контрастування з фізрозчином. Середньо-стравохідний зріз демонструє прогресування у часі пасажу контрасту з ПП в ЛП у дитини з ВОВ та великим ліво-правим шунтом.
Хоча подробиці методології виконання проби з контрастуванням описані в даних рекомендаціях вище, слід пам'ятати певні особливості при виконанні контрастування в педіатричній популяції:
1. Часто малі діти не можуть виконати інструкції з проведення проби Вальсальви, тому альтернативною для цієї проби у них може бути механічне перетискання НПВ шляхом тиску на печінку підчас введення збовтаного фізрозчину.
2. Для виявлення легеневих АВМ шляхом контрастування збовтаним фізрозчином дослідних має чітко візуалізувати МПП та відокремлювати її від місць впадіння легеневих вен, з яких звичайно реєструється попадання мікропухирців при позитивні пробі на АВМ. У дітей це часто вдається досягнути підчас візуалізації довгої осі з субкостального доступу із фокусом на ЛП або з «крабовидного» зрізу з яремної ямку супрастернально, де у дітей часто вдається добре візуалізувати місця впадіння кожної з легеневих вен в ЛП (останній доступ використовується останнім після отримання даних з усіх інших можливих позицій).
3. Персистуюча додаткова ліва верхня порожниста вена з дренуванням в ЛП може бути виявлена шляхом контрастування збовтаним фізрозчином тільки за умови введення контрасту в вену лівої руки.
Рекомендації з ЕхоКГ у педіатричних пацієнтів з підозрою на системну емболію
ЕхоКГ є рекомендованою
-
ТТЕхоКГ для всіх дітей із підозрою на емболічний інсульт.
-
Контрастування збовтаним фізрозчином може бути необхідним для діагностики право-лівого шунту.
-
ЕхоКГ у дітей із підозрою на кардіальні джерела емболії повинні проводитися у педіатрічних лікувальних закладах / відділеннях.
Echocardiography Potentially Useful
-
Емболічна природа інсульту у дітей зустрічається дуже рідко, тому ЧСЕхоКГ рекомендоване тільки при поганому «вікні» підчас ТТЕхоКГ.
Література
-
Saric Mю, Armour A.C., Arnaout M.S.Guidelines for the Use of Echocardiography in theEvaluation of a Cardiac Source of Embolism. J Am Soc Echocardiogr 2016;29:1-42.
-
Centers for Disease Control and Prevention. Stroke facts. Available at:http://www.cdc.gov/stroke/facts.htm. Accessed October 28, 2015.
-
Adams HP Jr., Bendixen BH, Kappelle LJ, Biller J, Love BB, Gordon DL,et al. Classification of subtype of acute ischemic stroke. Definitions foruse in a multicenter clinical trial. TOAST. Trial of Org 10172 in AcuteStroke Treatment. Stroke 993;24:35-41.
-
Strandberg M, Marttila RJ, Helenius H, Hartiala J. Transoesophageal echocardiographyin selecting patients for anticoagulation after ischaemicstroke or transient ischaemic attack. J Neurol Neurosurg Psychiatry2002;73:29-33.
-
American Heart Association & American Stroke Association. Cryptogenicstroke initiative. Available at: http://www.strokeassociation.org/STROKEORG/AboutStroke/TypesofStroke/CryptogenicStrokesofUnknownCause/Cryptogenic-Stroke-Initiative_UCM_471631_Article.jsp#.VjD9L7erR9M. Accessed October 28, 2015.
-
Douglas PS, GarciaMJ, Haines DE, LaiWW, Manning WJ, Patel AR, et al.ACCF/ASE/AHA/ASNC/HFSA/HRS/SCAI/SCCM/SCCT/SCMR2011 Appropriate Use Criteria for Echocardiography. A Report of theAmerican College of Cardiology Foundation Appropriate Use CriteriaTask Force, American Society of Echocardiography, American Heart Association,American Society of Nuclear Cardiology, Heart Failure Societyof America, Heart Rhythm Society, Society for Cardiovascular Angiographyand Interventions, Society of Critical Care Medicine, Society ofCardiovascular Computed Tomography, Society for CardiovascularMagnetic Resonance American College of Chest Physicians. J Am SocEchocardiogr 2011;24:229-67.
-
Pepi M, Evangelista A, Nihoyannopoulos P, Flachskampf FA,Athanassopoulos G, Colonna P, et al. Recommendations for Echocardiographyin the Diagnosis and Management of Cardiac Sources of Embolism.Eur J Echocardiogr 2010;11:461-76.
-
Ustrell X, Pellis_e A. CardiacWorkup of Ischemic Stroke. Current CardiologyReviews 2010;6:175-83.
-
Lang RM, Badano LP, Tsang W, Adams DH, Agricola E, Buck T, et al.EAE/ASE Recommendations for Image Acquisition and Display UsingThree-Dimensional Echocardiography. J Am Soc Echocardiography2012;25:3-46.
-
Porter TR, Abdelmoneim S, Belcik JT, McCulloch ML, Mulvagh SL,Olson JJ, et al. Guidelines for the Cardiac Sonographer in the Performanceof Contrast Echocardiography: A focused update from the AmericanSociety of Echocardiography. J Am Soc Echocardiogr 2014;27:797-810.
-
Bavalia N, Anis A, Benz M, Maldjian P, Bolanowski PJ, Saric M. Esophagealperforation, the most feared complication of TEE: Early recognitionby multimodality imaging. Echocardiography 2011;28:E56-9.
-
Hahn RT, Abraham T, Adams MS, Bruce CJ, Glas KE, Lang RM, et al.Guidelines for performing a comprehensive transesophageal echocardiographicexamination: recommendations from the American Society ofEchocardiography and the Society of Cardiovascular Anesthesiologists.J Am Soc Echocardiogr 2013;26:921-64.
-
McNamara RL, Lima JA, Whelton PK, Powe NR. Echocardiographicidentification of cardiovascular sources of emboli to guide clinical managementof stroke: A cost-effectiveness analysis. Ann Intern Med 1997;127:775-87.
-
Meenan RT, Saha S, Chou R, Swarztrauber K, Pyle Krages K, O’Keeffe-Rosetti MC, et al. Cost-effectiveness of echocardiography to identifyintracardiac thrombus among patients with fi rst stroke or transientischemic attack. Med Decis Making 2007;27:161-77.
-
de Bruijn SF, Agema WR, Lammers GJ, van der Wall EE,Wolterbeek R, Holman ER, et al. Transesophageal echocardiographyis superior to transthoracic echocardiography in management of patientsof any age with transient ischemic attack or stroke. Stroke2006;37:2531-4.
-
Ulrich JN, Hesse B, Schuele S, Vlassak I, Sila CA, Jaber WA. Single-vesselversus multivessel territory acute ischemic stroke: Value of transesophagealechocardiography in the differentiation of embolic stroke. J Am SocEchocardiogr 2006;19:1165-9.
-
De Abreu TT, Mateus S, Correia J. Therapy implications of transthoracicechocar-diography in acute ischemic stroke patients. Stroke 2005;36:1565-6.
-
Leung DY, Black IW, Cranney GB, Walsh WF, Grimm RA, Stewart WJ,et al. Selection of patients for transesophageal echocardiography afterstroke and systemic embolic events. Role of transthoracic echocardiography.Stroke 1995;26:1820-4.
-
Warner MF, Momah KI. Routine transesophageal echocardiography forcerebral ischemia. Is it really necessary? Arch Intern Med 1996;156:1719-23.
-
Wolber T, Maeder M, Atefy R, Bluzaite I, Blank R, Rickli H, et al. Shouldroutine echocardiography be performed in all patients with stroke? JStroke Cerebrovasc Dis 2007;16:1-7.
-
Reynolds HR, Jagen MA, Tunick PA, Kronzon I. Sensitivity of transthoracicversus transesophageal echocardiography for the detection ofnative valve vegetations in the modern era. J Am Soc Echocardiogr2003;16:67-70.
-
Ha JW, Shin MS, Kang S, Pyun WB, Jang KJ, Byun KH, et al. Enhanceddetection of right-to-left shunt through patent foramen ovale by transthoraciccontrast echocardiography using harmonic imaging. Am J Cardiol2001;87:669-71.
-
Schwammenthal E, Schwammenthal Y, Tanne D, Tenenbaum A,Garniek A, Motro M, et al. Transcutaneous detec-tion of aortic arch atheromasby suprasternal harmonic imaging. J Am Coll Cardiol 2002;39:1127-32.
-
Arboix A, Ali_o J. Acute cardioembolic stroke: an update. Expert RevCardiovascTher 2011;9:367-9.
-
Aaslid R, Markwalder TM, Nornes H. Noninvasive transcranial Dopplerultrasound recording of flow velocity in basal cerebral arteries. J Neurosurg1982;57:769-74.
-
Komar M, Olszowska M, Przew1ocki T, Podolec J, Ste˛pniewski J,Sobie_n B, et al. Transcranial Doppler ultrasonography should it be thefirst choice for persistent foramen ovale screening? Cardiovasc Ultrasound2014;12:16.
-
Serena J, Jim_enez-Nieto M, Silva Y, Castellanos M. Patent foramen ovalein cerebral infarction. Current Cardiol Rev 2010;6:162-74.
-
Mojadidi MK, Roberts SC, Winoker JS, Romero J, Goodman-Meza D,Gevorgyan R, et al. Accuracy of transcranial Doppler for the diagnosisof intracardiac right-to-left shunt: a bivariate meta-analysis of prospectivestudies. JACC Cardiovasc Imaging 2014;7:236-50.
-
Jin KN, Chun EJ, Choi SI, Ko SM, HanMK, Bae HJ, et al. Cardioembolicorigin in patients with embolic stroke: spectrum of imaging findings oncardiac MDCT. AJR Am J Roentgenol 2010;195:W38-44.
-
Veinot JP, Harrity PJ, Gentile F, Khandheria BK, Bailey KR, Eickholt JT,et al. Anatomy of the normal left atrial appendage: a quantitative studyof age-related changes in 500 autopsy hearts: implications for echocardiographicexamination. Circulation1997;96:3112-5.
-
Di Biase L, Santangeli P, Anselmino M, Mohanty P, Salvetti I, Gili S, et al.Does the left atrial appendage morphology correlate with the risk ofstroke in patients with atrial fibrillation? Results from a multicenter study.J Am Coll Cardiol 2012;60(6):531-8.
-
Go AS, Hylek EM, Phillips KA, Chang Y, Henault LE, Selby JV, et al. Prevalenceof diagnosed atrial fibrillation in adults: national implications forrhythm management and stroke prevention: the AnTicoagulation andRisk Factors in Atrial Fibrillation (ATRIA) Study. JAMA 2001;285:2370-5.
-
Lowe BS, Kusunose K, Motoki H, Varr B, Shrestha K, Whitman C, et al.Prognostic significance of left atrial appendage ‘‘sludge’’ in patients withatrial fibrillation: a new transesophageal echocardiographic thromboembolicrisk factor. J Am Soc Echocardiogr 2014;27:1176-83.
-
Hajjiri M, Bernstein S, Saric M, Benenstein R, Aizer A, Dym G, et al. Atrialfibrillation ablation in patients with known sludge in the left atrialappendage. J Interv Card Electrophysiol 2014;40:147-51.
-
Masawa N, Yoshida Y, Yamada T, Joshita T, Ooneda G. Diagnosis of cardiacthrombosis in patients with atrial fibrillation in the absence of macroscopicallyvisible thrombi. Virchows Arch A Pathol Anat Histopathol1993;422:67-71.
-
Tziakas DN, Chalikias GK, Papanas N, Stakos DA,Chatzikyriakou SV, Maltezos E. Circulating levels of collagen type Idegradation marker depend on the type of atrial fibrillation. Europace2007;9:589-96.
-
Pollock C, Taylor D. Assessment of left atrial appendage function bytransesophageal echocardiography. Implications for the developmentof thrombus. Circulation 1991;84:223-31.
-
Grimm RA, Stewart WJ, Maloney JD, Cohen GI, Pearce GL, Salcedo EE,et al. Impact of electrical cardioversion for atrial fibrillation on left atrialappendage function and spontaneous echo contrast: characterizationby simultaneous transesophageal echocardiography. J Am Coll Cardiol1993;22:1359-66.
-
Fatkin D, Kuchar DL, Thorburn CW, FeneleyMP. Transesophageal echocardiographybefore and during direct current cardioversion of atrialfibrillation: evidence for ‘‘atrial stunning’’ as a mechanism of thromboemboliccomplications. J Am Coll Cardiol 1994;23:307-16.
-
Lown B, Perlroth MG, Kaidbey S, Abe T, Harken DE. Cardioversion ofatrial fibrillation. A report on the treatment of 65 episodes in 50 patients.N Eng J Med 1963;269:325-31.
-
Lown B. Electrical reversion of cardiac arrhythmias. Br Heart J 1967;29:469-89.
-
Grimm RA, Stewart WJ, Black IW, Thomas JD, Klein AL. Should all patientsundergo transesophageal echocardiography before electrical cardioversionof atrial fibrillation? J Am Coll Cardiol 1994;23:533-41.
-
Black IW, Fatkin D, Sagar KB, Khandheria BK, Leung DY, Galloway JM,et al. Exclusion of atrial thrombus by transesophageal echocardiographydoes not preclude embolism after cardioversion of atrial fibrillation: Amulticenter study. Circulation1994;89:2509-13.
-
Kahn SR, Solymoss S, Flegel KM. Nonvalvular atrial fibrillation evidencefor a prothrombotic state. CMAJ 1997;157:673-81.
-
Rold_an V, Mar_ın F, Marco P, Mart_ınez JG, Calatayud R, Sogorb F. ypofibrinolysisin atrial fibrillation. A Heart J 1998;136:956-60.
-
Tsai LM, Chen JH, Tsao CJ. Relation of left atrial spontaneous echocontrast with prethrombotic state in atrial fibrillation associated with systemichypertension,idiopathic dilated cardiomyopathy, or no identifiablecause (lone). Am J Cardiol 1998;81:1249-52.
-
Nozawa T, Inoue H, Hirai T, Iwasa A, Okumura K, Lee JD, et al. D-dimerlevels influences thrombotic events in patients with atrial fibrillation. Int JCardiol 2006;109:59-65.
-
Heppel RM, B. K, McLenachan JM, Davies JA. Hemostatic and hemodynamicabnormalities associated with left atrial thrombosis in nonrheumaticatrial fibrillation. Heart 1997;77:407-11.
-
Choudhury A, C., Blann AD, Lip GY. Elevated platelet microparticlelevels in nonvalvular atrial fibrillation; relationship to p-celecton andanti thrombotic therapy.Chest 2007;131:809-15.
-
Tsang TS, Abhayaratna WP, Barnes ME, Miyasaka Y, Gersh BJ,Bailey KR, et al. Prediction of cardiovascular outcomes with left atrialsize: is volume superior to area or diameter? J Am Coll Cardiol2006;47:1018-23.
-
Lang RM, Badano LP, Mor-Avi V, Afilalo J, Armstrong A, Ernande L, et al.Recommendations for cardiac chamber quantification by echocardiographyin adults: an update from the American Society of Echocardiographyand the European Association of Cardiovascular Imaging. J Am SocEchocardiogr 2015;28:1-39.
-
Fuster V, Ryd_en LE, Cannom DS, Crijns HJ, Curtis AB, Ellenbogen KA,et al. 2011 ACCF/AHA/HRS focused updates incorporated into theACC/AHA/ESC 2006 Guidelines for the management of patientswith atrial fibrillation: a report of the American College of CardiologyFoundation/American Heart Association Task Force on Practice Guidelinesdeveloped in partnership with the European Society ofCardiologyand in collaboration with the European Heart Rhythm Association andthe Heart Rhythm Society. J Am Coll Cardiol 2011;57:e101-98.
-
Zabalgoitia M, Halperin JL, Pearce LA, Blackshear JL, Asinger RW,Hart RG, et al. Transesophageal echocardiographic correlates of clinicalrisk of thromboembolism in nonvalvular atrial fibrillation. Stroke Preventionin Atrial Fibrillation III Investigators. J Am Coll Cadriol 1998;31:1622-6.
-
Klein AL, Grimm RA, Murray RD, et al., Assessment of CardioversionUsing Transesophageal Echocardiography Investigators. Use of transesophagealechocardiography to guide cardioversion in patients with atrialfibrillation. N Engl J Med 2001;344:1411-20.
-
Munir S, Chang JH, Salahudeen SR, Baranchuk A, Morris C, O’Reilly M,et al. Atrial thrombi detection prior to pulmonary vein isolation: cardiaccomputedtomography versus transesophageal echocardiography. CardiolJ 2015;http://dx.doi.org/10.5603/CJ.a2015.0017 [Epub ahead ofprint].
-
Schmidt M, Daccarett M, Marschang H, Ritscher G, Turschner O,Brachmann J, et al. Intracardiac echocardiography improves proceduralefficiency duringcryoballoon ablation for atrial fibrillation: a pilot study.J Cardiovasc Electrophysiol 2010;21:1202-7.
-
Thomas L, Boyd A, Thomas SP, Schiller NB, Ross DL. Atrial structuralremodeling and restoration of atrial contraction after linear ablation foratrial fibrillation. Eur Heart J 2003;24:1942-51.
-
Jongbloed MR, Bax JJ, Lamb HJ, Dirksen MS, Zeppenfeld K, van derWall EE, et al. Multislice computed tomography versus intracardiac echocardiographyto evaluate the pulmonary veins before radiofrequencycatheter ablation of atrial fibrillation: A head-to-head comparison. J AmColl Cardiol 2005;45:343-50.
-
To AC, Gabriel RS, Park M, Lowe BS, Curtin RJ, Sigurdsson G, et al. Roleof Transesophageal Echocardiography Compared to Computed Tomographyin Evaluation of Pulmonary Vein Ablation for Atrial Fibrillation(ROTEA study). J Am Soc Echocardiogr 2011;24:1046-55.
-
Asinger RW, Mikell FL, Elsperger J, Hodges M. Incidence of left –ventricularthrombosis after acute transmural infarction. Serial evaluation bytwo-dimensionalechocardiography. N Engl J Med 1981;305:297-302.
-
Visser CA, Kan G, Lie KI, Durrer D. Left ventricular thrombus followingacute myocardial infarction: A prospective echocardiographic study of96 patients. Eur Heart J 1983;4:333-7.
-
Jugdutt BI, Sivaram CA. Prospective two-dimensional echocardiographicevaluation of left ventricular thromboembolism after acute myocardialinfarction. J Am Coll Cardiol 1989;13:554-64.
-
Kalra A, Jang IK. Prevalence of early left ventricular thrombus after primarycoronary intervention for acute myocardial infarction. J ThrombThrombolysis 2000;10:133-6.
-
Nihoyannopoulos P, Smith GC, Maseri A, Foale RA. The natural historyof left ventricular thrombus in myocardial infarction: a rationale supportof masterly inactivity. J Am Coll Cardiol 1989;14:903-11.
-
Chiarella F, Santoro E, Domenicucci S, Maggioni A, Vecchio C. Predischargetwo-dimensional echocardiographic evaluation of thrombosis afteracute myocardial infarction in the GISSI-3 study. Am J Cardiol 1998;81:822-7.
-
Solheim S, Seljeflot I, Lunde K, Bjørnerheim R, Aakhus S, Forfang K, et al.Frequency of left ventricular thrombus in patients with anterior wallacute myocardial infarction treated with percutaneous coronary interventionand dual antiplatelet therapy. Am J Cardiol 2010;106:1197-200.
-
Weinsaft JW, Kim HW, Shah DJ, Klem I, Crowley AL, Brosnan R, et al.Detection of left ventricular thrombus by delayed-enhancement cardiovascularmagnetic resonance. J Am Coll Cardiol 2008;52:148-57.
-
Koniaris LS, Goldhaber SZ. Anticoagulation in dilated cardiomyopathy. JAm Coll Cardiol 1998;31:745-8.
-
Meltzer RS, Visser CA, Fuster V. Intracardiac thrombi and systemicembolization. Ann Intern Med 1986;104:689-98.
-
Johannessen KA, Nordrehaug JE, von der Lippe G, Vollset SE. Risk factorsfor embolization in patients with left ventricular acute myocardialinfarction. Br Heart J1988;60:104-10.
-
Haugland JM, Asinger RW, Mikell FL, Elsperger J, Hodges M. Embolicpotentialof left ventricular thrombi detected by two-dimensional echocardiography.Circulation 1984;70:588-98.
-
Domenicucci S, Bellotti P, Chiarella F, Lupi G, Vecchio C. Spontaneousmorphologic changes in left ventricular thrombi two-dimensional echocardiographicstudy. Circulation 1987;75:737-43.
-
Srichai MB, Junor C, Rodriguez LL, Stillman AE, Grimm RA, Lieber ML,et al. Clinical, imaging, and pathological characteristics of left VentricularThrombus: A comparison of contrast-enhanced magnetic resonance imaging,transthoracicechocardiography, and transesophageal echocardiographywith surgical or pathological validation. Am Heart J 2006;152:75-84.
-
van Dantzig JM, Delemarre BJ, Bot H, Visser CA. Left ventricularthrombus in acute myocardial infarction. Eur Heart J 1996;17:1640-5.
-
Senior R, Becher H, Monaghan M, Agati L, Zamorano J,Vanoverschelde JL, et al. Contrast Echocardiography: Evidence-BasedRecommendations by EuropeanAssociation of Echocardiography. Eur JEchocardiogr 2009;10:194-212.
-
Kurt M, Shaikh KA, Peterson L, Kurrelmeyer KM, Shah G, Nagueh SF,et al. Impact of contrast echocardiography on evaluation of ventricularfunction and clinical management in a large prospective cohort. J AmColl Cardiol 2009;53:802-10.
-
Li JS, SextonDJ, Mick N, Nettles R, Fowler VG Jr., Ryan T, et al. Proposedmodifications to the Duke criteria for the diagnosis of infective endocarditis.Clin Infect Dis 2000;30:633-8.
-
Bonow RO, Carabello BA, Kanu C, de Leon AC Jr., Faxon DP,FreedMD, et al. ACC/AHA 2006 guidelines for the management of patientswith valvular heartdisease: a report of the American College ofCardiology/American Heart Association Task Force on Practice Guidelines(writing committee to revise the 1998 Guidelines for the Managementof Patients With Valvular Heart Disease): developed incollaboration with the Society of Cardiovascular Anesthesiologists:endorsed by the Society for Cardiovascular Angiography and Interventionsand the Society of Thoracic Surgeons. Circulation 2006;114:e84-231.
-
Oh J, Seward J, Tajik A. The Echo Manual. 3rd ed. Rochester, MN: LippincottWilliams & Wilkins; 2006.
-
Kaymaz C, Ozkan M, Ozdemir N, Kirma C, Delig€on€ul U. Spontaneousechocardiographic microbubbles associated with prosthetic mitral valves:mechanistic insights from thrombolytic treatment results. J AmSoc Echocardiogr2002;15:323-7.
-
Jacob S, Tong AT. Role of echocardiography in the diagnosis and managementof infective endocarditis. Curr Opin Cardiol 2002;17:478-85.
-
O’Brien JT, Geiser EA. Infective endocarditis and echocardiography. AmHeart J 1984;108:386-94.
-
Gilbert BW, Haney RS, Crawford F, McClellan J, Gallis HA, JohnsonML,et al. Two-dimensional echocardiographic assessment of vegetative endocarditis.Circulation 1977;55:346-53.
-
Shively BK, Gurule FT, Roldan CA, Leggett JH, Schiller NB. Diagnosticvalue of transesophageal compared with transthoracic echocardiographyin infectiveendocarditis. J Am Coll Cardiol 1991;18:391-7.
-
Erbel R, Rohmann S, Drexler M, Mohr-Kahaly S, Gerharz CD, Iversen S,et al. Improved diagnostic value of echocardiography in patients withinfective endocarditis by transoesophageal approach. A prospectivestudy. Eur Heart J 1988;9:43-53.
-
Daniel WG, M€ugge A, Grote J, Hausmann D, Nikutta P, Laas J, et al.Comparison of transthoracic and transesophageal echocardiographyfor detection of abnormalities of prosthetic and bioprosthetic valves inthe mitral and aortic positions. Am J Cardiol 1993;71:210-5.
-
Daniel WG, M€ugge A, Martin RP, Lindert O, Hausmann D, Nonnast-Daniel B, et al. Improvement in the diagnosis of abscesses associatedwith endocarditis by transesophageal echocardiography. N Engl J Med1991;324:795-800.
-
De Castro S, Cartoni D, d’Amati G, Beni S, Yao J, Fiorell M, et al. Diagnosticaccuracy of transthoracic and multiplane transesophageal echocardiographyfor valvular perforation in acute infective endocarditis:Correlation with anatomic findings. Clin Infect Dis 2000;30:825-6.
-
Habib G. Embolic risk in subacute bacterial endocarditis: determinantsand role of transesophageal echocardiography. Curr Cardiol Rep2003;5:129-36.
-
Grabowski M, Hryniewiecki T, Janas J, Ste˛pi_nska J. Clinically overt andsilent cerebral embolism in the course of infective endocarditis. J Neurol2011;258:1133-9.
-
Snygg-Martin U, Gustafsson L, Rosengren L, Alsiő A, Ackerholm P,Andersson R, et al. Cerebrovascular complications in patients with leftsidedinfective endocarditis are common: a prospective study using magneticresonance imaging and neurochemical brain damage markers. ClinInfect Dis 2008;47:23-30.
-
Thuny F, Di Salvo G, Belliard O, Avierinos JF, Pergola V, Rosenberg V,et al. Risk of embolism and death in infective endocarditis: prognosticvalue ofechocardiography: a prospective multicenter study. Circulation2005;112:69-75.
-
Vilacosta I, Graupner C, San Roman JA, Sarria C, Ronderos R,Fernandez C, et al. Risk of embolization after institution of antibiotic therapyfor infective endocarditis. J Am Coll Cardiol 2002;39:1489-95.
-
Di Salvo G, Habib G, Pergola V, Avierinos JF, Philip E, Casalta JP, et al.Echocardiography predicts embolic events in infective endocarditis. JAm Coll Cardiol 2001;37:1069-76.
-
Nishimura RA, Otto CM, Bonow RO, et al. 2014 AHA/ACC Guidelinefor the management of patients with valvular heart disease: a report ofthe American College of Cardiology/American Heart Association TaskForce on Practice Guidelines. Circulation 2014;129:e521-643.
-
Moder KG, Miller TD, Tazelaar HD. Cardiac involvement in systemiclupus erythematosus. Mayo Clin Proc 1999;74:275-84.
-
Roldan CA, Shively BK, Crawford MH. An echocardiographic study ofvalvular heart disease associated with systemic lupus erythematosus. NEngl J Med 1996;335:1424-30.
-
Zuily S, Regnault V, Selton-Suty C, Eschw_ege V, Bruntz JF, Bode-Dotto E,et al. Increased risk for heart valve disease associated with antiphospholipidantibodies in patients with systemic lupus erythematosus: metaanalysisof echocardiographic studies. Circulation 2011;124:215-24.
-
Reisner SA, Brenner B, Haim N, Edoute Y, Markiewicz W. Echocardiographyin nonbacterial thrombotic endocarditis: from autopsy to clinicalentity. J Am Soc Echocardiogr 2000;13:876-81.
-
Graus F, Rogers LR, Posner JB. Cerebrovascular complications in patientswith cancer. Medicine (Baltimore 1985;64:16-35.
-
el-Shami K, Griffiths E, Streiff M. Nonbacterial thrombotic endocarditis incancer patients: pathogenesis, diagnosis, and treatment. Oncologist2007;12:518-23.
-
Lee RJ, Bartzokis T, Yeoh TK, Grogin HR, Choi D, Schnittger I. Enhanceddetection of intracardiac sources of cerebral emboli by transesophagealechocardiography. Stroke 1991;22:734-9.
-
Dutta T, KarasMG, Segal AZ, Kizer JR. Yield of transesophagealechocardiographyfor nonbacterial thrombotic endocarditis and other cardiacsources of embolism in cancer patients with cerebral ischemia. Am J Cardiol2006;97:894-8.
-
Roldan CA, Shively BK, Crawford MH. Valve excrescences: prevalence,evolution and risk for cardioembolism. J Am Coll Cardiol 1997;30:1308-14.
-
Freedberg RS, Goodkin GM, Perez JL, Tunick PA, Kronzon I. Valvestrands are strongly associated with systemic embolization: a transesophagealechocardiographic study. J Am Coll Cardiol 1995;26:1709-12.
-
Tice FD, Slivka AP, Walz ET, Orsinelli DA, Pearson AC. Mitral valvestrands in patients with focal cerebral ischemia. Stroke 1996;27:1183-6.
-
Cohen A, Tzourio C, Chauvel C, et al. Mitral valve strands and the risk ofischemic stroke in elderly patients. The French Study of Aortic Plaques inStroke (FAPS) Investigators. Stroke 1997;28:1574-8.
-
Isada LR, Torelli JN, Stewart WJ, Klein AL. Detection of fibrous strands onprosthetic mitral valves with transesophageal echocardiography: anotherpotential embolic source. J Am Soc Echocardiogr 1994;7:641-5.
-
Orsinelli DA, Pearson AC. Detection of prosthetic valve strands bytransesophagealechocardiography: Clinical significance in patients with suspectedcardiac source of embolism. J Am Coll Cardiol 1995;26:1713-8.
-
Lin CS, Schwartz IS, Chapman I. Calcification of the mitral annulus fibrosuswith systemic embolization. A clinicopathologic study of 16 cases.Arch Pathol Lab Med 1987;111:411-4.
-
Hill EE, Herijgers P, Claus P, Vanderschueren S, Peetermans WE,Herregods MC. Abscess in infective endocarditis: the value of transesophagealechocardiography and outcome: a 5-year study. Am Heart J2007;154:923-8.
-
Eicher JC, De Nadai L, Soto FX, Falcon-Eicher S, Dobs_ak P, Zanetta G,et al. Bacterial endocarditis complicating mitral annular calcification: aclinical and echocardiographic study. J Heart Valve Dis 2004;13:217-27.
-
Antonini-Canterin F, Capanna M, Manfroni A, Brieda M, Grandis U,Sbaraglia F, et al. Association between mitral annular calcium and carotidartery stenosis and role of age and gender. Am J Cardiol 2001;88:581-3.
-
Adler Y, Vaturi M, Fink N, Tanne D, Shapira Y, Weisenberg D, et al.Associationbetween mitral annulus calcification and aortic atheroma: aprospective transesophageal echocardiographic study. Atherosclerosis2000;152:451-6.
-
Benjamin EJ, Plehn JF, D’Agostino RB, Belanger AJ, Comai K, Fuller DL,et al. Mitral annular calcification and the risk of stroke in an elderly cohort.N Engl J Med 1992;327:374-9.
-
Kizer JR,Wiebers DO,Whisnant JP, Galloway JM,Welty TK, Lee ET, et al.Mitral annular calcification, aortic valve sclerosis, and incident stroke inadults free of clinical cardiovascular disease: the Strong Heart Study.Stroke 2005;36:2533-7.
-
Shohat-Zabarski R, Paz R, Adler Y, Vaturi M, Jortner R, Sagie A. Mitralannulus calcification with a mobile component as a possible source ofembolism. Am J Geriatr Cardiol 2001;10:196-8.
-
Gueret P, Vignon P, Fournier P, Chabernaud JM, Gomez M, LaCroix P,et al. Transesophageal echocardiography for the diagnosis and managementof nonobstructive thrombosis of mechanical mitral valve prosthesis.Circulation 1995;91:103-10.
-
Barbetseas J, Nagueh SF, Pitsavos C, Toutouzas PK, Quinones MA,Zoghbi WA. Differentiating thrombus from pannus formation in obstructedmechanical prosthetic valves: an evaluation of clinical, transthoracicand transesophageal echocardiographic parameters. J Am CollCardiol 1998;32:1410-7.
-
Girard SE, Miller FA Jr., Orszulak TA, Mullany CJ, Montgomery S,Edwards WD, et al. Reoperation for prosthetic aortic valve obstructionin the era ofechocardiography: trends in diagnostic testing and comparisonwith surgical findings. J Am Coll Cardiol 2001;37:579-84.
-
Lin SS, Tiong IY, Asher CR, Murphy MT, Thomas JD, Griffin BP. Predictionof thrombus-related mechanical prosthetic valve dysfunction usingtransesophageal echocardiography. Am J Cardiol 2000;86:1097-101.
-
Michelena HI, Enriquez-Sarano M, Sundt TM 3rd. A torn 15-year-oldaortic bioprosthesis in the setting of percutaneous coronary intervention:echocardiographic diagnosis and pathologic correlation. A case report. JHeart Valve Dis 2009;18:228-31.
-
Tong AT, Roudaut R, Ozkan M, Sagie A, Shahid MS, Pontes Junior SC,et al. Transesophageal echocardiography improves risk assessment ofthrombolysis ofprosthetic valve thrombosis: results of the internationalPRO-TEE registry. J Am Coll Cardiol 2004;43:77-84.
-
Pislaru SV, Michelena HI, Mankad SV. Interventional echocardiography.Prog Cardiovasc Dis 2014;57:32-46.
-
Ragland MM, Tak T. The role of echocardiography in diagnosingspaceoccupyinglesions of the heart. Clin Med Res 2006;4:22-32.
-
Peters PJ, Reinhardt S. The echocardiographic evaluation of intracardiacmasses: a review. J Am Soc Echocardiogr 2006;19:230-40.
-
Sharma S, Tsyvine D, Maldjian PD, Sambol JT, Lovoulos CJ, Levy G, et al.An intriguing association: atrial myxoma and cerebral cavernous hemangioma:Case report and review of literature. JAmSoc Echocardiogr 2011;24:110.e1-4.
-
Lepper W, Shivalkar B, Rinkevich D, Belcik T, Wei K. Assessment of thevascularity of a left ventricular mass using myocardial contrast echocardiography.J Am Soc Echocardiogr 2002;15:1419-22.
-
Dujardin KS, Click RL, Oh JK. The role of intraoperative transesophagealechocardiography in patients undergoing cardiac mass removal. J AmSoc Echocardiogr 2000;13:1080-3.
-
Pucci A, Gagliardotto P, Zanini C, Pansini S, di Summa M, Mollo F.Histopathologicand clinical characterization of cardiac myxoma: review of53 cases from a single institution. Am Heart J 2000;140:134-8.
-
Shapiro LM. Cardiac tumours: diagnosis and management. Heart 2001;85:218-22.
-
Tolstrup K, Shiota T, Gurudevan S, Luthringer D, Luo H, Siegel RJ. Leftatrial myxomas: correlation of two-dimensional and live threedimensionaltransesophageal echocardiography with the clinical andpathologic findings. J Am Soc Echocardiogr 2011;24:618-24.
-
Sun JP, Asher CR, Yang XS, Cheng GG, Scalia GM, Massed AG, et al.Clinical and echocardiographic characteristics of papillary fibroelastomas:a retrospective and prospective study in 162 patients. Circulation2001;103:2687-93.
-
Klarich KW, Enriquez-Sarano M, Gura GM, Edwards WD, Tajik AJ,Seward JB. Papillary fibroelastoma: echocardiographic characteristicsfor diagnosis and pathologic correlation. J Am Coll Cardiol 1997;30:784-90.
-
Gowda RM, Khan IA, Nair CK, Mehta NJ, Vasavada BC, Sacchi TJ. Cardiacpapillary fibroelastoma: a comprehensive analysis of 725 cases. AmHeart J2003;146:404-10.
-
Goldstein SA, Evangelista A, Abbara S, Arai A, Asch FM, Badano LP, et al.Multimodality imaging of diseases of the thoracic aorta in adults: Fromthe American Society of Echocardiography and the European Associationof Cardiovascular Imaging: Endorsed by the Society of CardiovascularComputed Tomography and Society for Cardiovascular MagneticResonance. J Am Soc Echocardiogr 2015;28:119-82.
-
Mecklai A, Rosenzweig B, Applebaum R, Axel L, Grossi E, Chan A, et al.Intimal sarcoma in the aortic arch partially obstructing the aorta withmetastasis to the brain. Tex Heart Inst J 2014;41:433-6.
-
Tunick PA, Kronzon I. Atheromas of the thoracic aorta: clinical andtherapeuticupdate. J Am Coll Cardiol 2000;35:545-54.
-
Saric M, Kronzon I. Embolism from aortic plaque: atheroembolism(cholesterol crystal embolism). In: Basow DS, editor. UpTo- Date. Waltham:UpToDate; 2011.
-
Kronzon I, Saric M. Cholesterol embolization syndrome. Circulation2010;122:631-41.
-
Saric M, Kronzon I. Aortic atherosclerosis and embolic events. Curr CardiolRep 2012;14:342-9.
-
Stary HC, Chandler AB, Dinsmore RE, Fuster V, Glagov S, Insull W Jr,et al. A definition of advanced types of atherosclerotic lesions and a histologicalclassification of atherosclerosis. A report from the Committeeon Vascular Lesions of the Council on Arteriosclerosis, American HeartAssociation. Circulation 1995;92:1355-74.
-
Applebaum RM, Kronzon I. Evaluation and management of cholesterolembolization and the blue toe syndrome. Curr Opin Cardiol 1996;11:533-42.
-
Tunick PA, Krinsky GA, Lee VS, Kronzon I. Diagnostic imaging ofthoracic aortic atherosclerosis. AJR Am J Roentgenol 2000;174:1119-25.
-
Erbel R, Aboyans V, Boileau C, Bossone E, Bartolomeo RD,Eggebrecht H, et al. 2014 ESC Guidelines on the diagnosis andtreatment of aortic diseases: Document covering acute and chronicaortic diseases of the thoracic and abdominal aorta of the adult. TheTask Force for the Diagnosis and Treatment of Aortic Diseases ofthe European Society of Cardiology (ESC). Eur Heart J 2014;35:2873-926.
-
Hahn RT, Abraham T, Adams MS, Bruce CJ, Glas KE, Lang RM, et al.Guidelines for performing a comprehensive transesophageal echocardiographicexamination: Recommendations from the American Society ofEchocardiography and the Society of Cardiovascular Anesthesiologists.J Am Soc Echocardiogr 2013;26:921-64.
-
Tunick PA, Kronzon I. Protruding atherosclerotic plaque in the aortic archof patients with systemic embolization: a new finding seen by transesophagealechocardiography. Am Heart J 1990;120:658-60.
-
Jones EF, Kalman JM, Calafiore P, Tonkin AM, Donnan GA. Proximalaortic atheroma: an independent risk factor for cerebral ischemia. Stroke1995;26:218-24.
-
Amarenco P, Cohen A, Tzourio C, Bertrand B, Hommel M, Besson G,et al. Atherosclerotic disease of the aortic arch and the risk of ischemicstroke. N Engl J Med 1994;331:1474-9.
-
Koppang JR, Nanda NC, Coghlan C, Sanyal R. Histologically confirmedcholesterol atheroemboli with identification of the source by transesophagealechocardiography. Echocardiography 1992;9:379-83.
-
Coy KM, Maurer G, Goodman D, Siegel RJ. Transesophagealechocardiographicdetection of aortic atheromatosis may provide clues to occultrenal dysfunction in the elderly. Am Heart J 1992;123:1684-6.
-
Ko Y, Park JH, Yang MH, Ko SB, Choi SI, Chun EJ, et al. Significance ofaortic atherosclerotic disease in possibly embolic stroke: 64-multidetectorrow computed tomography study. J Neurol 2010;257:699-705.
-
Zahuranec DB, Mueller GC, Bach DS, Stojanovska J, Brown DL,Lisabeth LD, et al. Pilot study of cardiac magnetic resonance imagingfor detection of embolic source after ischemic stroke. J Stroke CerebrovascDis 2012;21:794-800.
-
Khatri IA, Mian N, Alkawi A, Janjua N, Kirmani JF, Saric M, et al. Catheter-based aortography fails to identify aortic atherosclerotic lesions detectedon transesophageal echocardiography. J Neuroimaging 2005;15:261-5.
-
Silvestry FE, Cohen MS, Armsby LB, Burkule NJ, Fleishman CE,Hijazi ZM, et al. Guidelines for the echocardiographic assessment ofatrial septal defect and patent foramen ovale: from the American Societyof Echocardiography and Society for Cardiac Angiography and Interventions.J Am Soc Echocardiography 2015;28:910-58.
-
Kiserud T. Physiology of the fetal circulation. Semin Fetal Neonatal Med2005;10:493-503.
-
Mielke G, Brenda N. Cardiac output and central distribution of bloodflow in the human fetus. Circulation 2001;103:1662-8.
-
Blackburn ST. Maternal, Fetal and Neonatal Physiology: A ClinicalPerspective. Philadelphia: Saunders; 2003.
-
Friedman AH, Fahey JT. The transition from fetal to neonatal circulation:normal responses and implications for infants with heart disease. SeminPerinatol 1993;17:106-221.
-
Mann D, Mehta V. Cardiovascular embryology. Int Anesthesiol Clin2004;42:15-28.
-
Hagen PT, Scholz DG, Edwards WD. Incidence and size of patent foramenovale during the first 10 decades of life: an autopsy study of 965normal hearts. Mayo Clin Proc 1984;59:17-20.
-
Cabanes L, Mas JL, Cohen A, Amarenco P, Cabanes PA, Oubary P, et al.Atrial septal aneurysm and patent foramen ovale as risk factors for cryptogenicstroke in patients less than 55 years of age. A study using transesophagealechocardiography.Stroke 1993;24:1865-73.
-
Overell JR, Bone I, Lees KR. Interatrial septal abnormalities and stroke: Ameta analysis of case-control studies. Neurology 2000;55:1172-9.
-
Hanley PC, Tajik AJ, Hynes JK, Edwards WD, Reeder GS, Hagler DJ, et al.Diagnosis and classification of atrial septal aneurysm by two-dimensionalechocardiography: Report of 80 consecutive cases. J Am Coll Cardiol1985;6:1370-82.
-
Pearson AC, Nagelhout D, Castello R, Gomez CR, Labovitz AJ. Atrialseptal aneurysm and stroke: a transesophageal echocardiographic study.J Am Coll Cardiol1991;18:1223-9.
-
Lechat P, Mas JL, Lascault G, et al. Prevalence of patent foramen ovale inpatients with stroke. N Engl J Med 1988;318:1148-52.
-
Webster MW, Chancellor AM, SmithHJ, Swift DL, SharpeDN, BassNM,et al. Patent foramen ovale in young stroke patients. Lancet 1988;2:11-2.
-
Job FP, Ringelstein EB, Grafen Y, Flachskampf FA, Doherty C,Stockmanns A, et al. Comparison of transcranial contrast Doppler sonographyand transesophageal contrast echocardiography for the detectionof patent foramen ovale in young stroke patients. Am J Cardiol 1994;74:381-4.
-
Di Tullio M, Sacco RL, Gopal A, Mohr JP, Homma S. Patent foramenovale as a risk factor for cryptogenic stroke. Ann Intern Med 1992;117:461-5.
-
Yeung M, Khan KA, Shuaib A. Transcranial Doppler ultrasonography inthe detection of venous to arterial shunting in acute stroke and transientischaemic attacks. J Neurol Neurosurg Psychiatry 1996;61:445-9.
-
HandkeM, Harloff A, Olschewski M, Hetzel A, Geibel A. Patent foramenovale and cryptogenic stroke in older patients. N Engl J Med 2007;357:2262-8.
-
Kent DM, Trikalinos TA, Thaler DE. Patent foramen ovale and cryptogenicstroke. N Engl J Med 2008;358:1519-20.
-
Rigatelli G, Aggio S, Cardaioli P, Braggion G, Giordan M, Dell’avvocata F,et al. Left atrial dysfunction in patients with patent foramen ovale andatrial septal aneurysm: An alternative concurrent mechanism for arterialembolism? JACC Cardiovasc Interv 2009;2:655-62.
-
Goch A, Banach M, Piotrowski G, Szadkowska I, Goch JH.Echocardiographicevaluation of the left atrium and left atrial appendage functionin patients with atrial septum aneurysm: implications forthromboembolic complications. Thorac Cardiovasc Surg 2007;55:365-70.
-
Homma S, Sacco RL, Di Tullio MR, Sciacca RR, Mohr JP, ВОВ inCryptogenicStroke Study (PICSS) Investigators. Effect of medical treatment instroke patients with patent foramen ovale: patent foramen ovale in cryptogenicstroke study. Circulation 2002;105:2625-31.
-
Mess_e SR, Silverman IE, Kizer JR, Homma S, Zahn C, Gronseth G, et al.Practice parameter: Recurrent stroke with patent foramen ovale andatrial septal aneurysm: report of the Quality Standards Subcommitteeof the American Academy of Neurology. Neurology 2004;62:1042-50.
-
Bridges ND, Hellenbrand W, Latson L, Filiano J, Newburger JW, Lock JE.Transcatheter closure of patent foramen ovale after presumed paradoxicalembolism. Circulation 1992;86:1902-8.
-
Serena J, Marti-F_abregas J, Santamarina E, Rodr_ıguez JJ, Perez-Ayuso MJ,Masjuan J, et al. Recurrent stroke and massive right-to-left shunt: Resultsfrom the prospective Spanish multicenter (CODICIA) study. Stroke2008;39:3131-6.
-
Van Camp G, Schulze D, Cosyns B, Vandenbossche JL. Relation betweenpatent foramen ovale and unexplained stroke. Am J Cardiol 1993;71:596-8.
-
Stewart MJ. Contrast echocardiography. Heart 2003;89:342-8.
-
Goldhaber SZ. Pulmonary embolism. N Engl J Med 1998;339:93-104.
-
Tapson VF. Acute pulmonary embolism. N Engl J Med 2008;358:1037-52.
-
Carson JL, Kelley MA, Duff A, Weg JG, Fulkerson WJ, Palevsky HI, et al.The clinical course of pulmonary embolism. N Engl J Med 1992;326:1240-5.
-
Goldhaber SZ, Visani L, De Rosa M. Acute pulmonary embolism: clinicaloutcomes in the International Cooperative Pulmonary Embolism Registry(ICOPER). Lancet 1999;353:1386-9.
-
Horlander KT, Mannino DM, Leeper KV. Pulmonary embolism mortalityin the United States, 1979–1998: an analysis using multiple-causemortality data. ArchIntern Med 2003;163:1711-7.
-
Nijkeuter M, Sőhne M, Tick LW, Kamphuisen PW, Kramer MH,Laterveer L, et al. The natural course of hemodynamically stable pulmonaryembolism: clinicaloutcome and risk factors in a large prospectivecohort study. Chest 2007;131:517-23.
-
Jaff MR, McMurtry MS, Archer SL, Cushman M, Goldenberg N,Goldhaber SZ, et al. Management of massive and submassive pulmonaryembolism, iliofemoral deep vein thrombosis, and chronic thromboembolicpulmonary hypertension: a scientific statement from the AmericanHeart Association. Circulation 2011;123:1788-830.
-
Beer JH, Burger M, Gretener S, Bernard-Bagattini S, Bounameaux H.Outpatient treatment of pulmonary embolism is feasible and safe in asubstantial proportion of patients. J Thromb Haemost 2003;1:186-7.
-
KovacsMJ, Anderson D, Morrow B, Gray L, Touchie D,Wells PS. Outpatienttreatment of pulmonary embolism with dalteparin. Thromb Haemost2000;83:209-11.
-
Wells PS, Kovacs MJ, Bormanis J, Forgie MA, Goudie D, Morrow B, et al.Expanding eligibility for outpatient treatment of deep venous thrombosisand pulmonary embolism with low-molecular-weight heparin: a comparisonof patient self-injection with homecare injection. Arch InternMed 1998;158:1809-12.
-
Konstantinides S, Geibel A, Heusel G, Heinrich F, Kasper W, ManagementStrategies and Prognosis of Pulmonary Embolism-3 Trial Investigators.Heparin plus alteplase compared with heparin alone in patients withsubmassive pulmonaryembolism. N Engl J Med 2002;347:1143-50.
-
Vanni S, Polidori G, Vergara R, Pepe G, Nazerian P, Moroni F, et al.Prognosticvalue of ECGamong patients with acute pulmonary embolism andnormal blood pressure. Am J Med 2009;122:257-64.
-
Konstantinides S, Geibel A, Olschewski M, Kasper W, Hruska N, Jackle S,et al. Importance of cardiac troponins I and T in risk stratification of patientswith acute pulmonary embolism. Circulation 2002;106:1263-8.
-
Kucher N, Printzen G, Goldhaber SZ. Prognostic role of brain natriureticpeptide in acute pulmonary embolism. Circulation 2003;107:2545-7.
-
Sanchez O, Trinquart L, Caille V, Couturaud F, Pacouret G, Meneveau N,et al. Prognostic factors for pulmonary embolism: the prep study, a prospectivemulticenter cohort study. Am J Respir Crit Care 2010;181:168-73.
-
Jimenez D, Aujesky D, Moores L, Gomez V, Marti D, Briongos S, et al.Combinations of prognostic tools for identification of high-risk normotensivepatients with acute symptomatic pulmonary embolism. Thorax2011;66:75-81.
-
Ribeiro A, Lindmarker P, Juhlin-Dannfelt A, Johnsson H, Jorfeldt L.EchocardiographyDoppler in pulmonary embolism: right ventricular dysfunctionas a predictor of mortality rate. Am Heart J 1997;134:479-87.
-
Goldhaber S. Pulmonary embolism thrombolysis: broadening the paradigmfor its administration. Circulation 1997;96:716-8.
-
TenWolde M, S€ohne M, Quak E, Mac GillavryMR, BullerHR. Prognosticvalue of echocardiographically assessed right ventricular dysfunction inpatients with pulmonary embolism. Arch Int Med 2004;164:1685-9.
-
Bova C, Greco F, Misuraca G, Serafini O, Crocco F, Greco A, et al. Diagnosticutility of echocardiography in patients with suspected pulmonaryembolism.Am J Emerg Med 2003;21:180-3.
-
Miniati M, Monti S, Pratali L, Di Ricco G, Marini C, Formichi B, et al.Diagnosis of pulmonary embolism: results of a prospective study in unselectedpatients. Am J Med 2001;110:528-35.
-
Kasper W, Konstantinides S, Geibel A, Olschewski M, Heinrich F,Grosser KD, et al. Management strategies and determinants of outcomein acute major pulmonary embolism: results of a multicenter registry. JAm Coll Cardiol 1997;30:1165-71.
-
Mansencal N, Vieillard-Baron A, Beauchet A, Farcot JC, El Hajjam M,Dufaitre G, et al. Triage patients with suspected pulmonary embolismin the emergency department using a portable ultrasound device. Echocardiography2008;25:451-6.
-
Grifoni S, Olivotto I, Cecchini P, Pieralli F, Camaiti A, Santoro G, et al.Short-term clinical outcome of patients with acute pulmonary embolism,normal blood pressure, and echocardiographic right ventricular dysfunction.Circulation 2000;101:2817-22.
-
Taylor RA, Davis J, Liu R, Gupta V, Dziura J, Moore CL. Point-of-carefocused cardiac ultrasound for prediction of pulmonary embolismadverse outcomes. J Emerg Med 2013;45:392-9.
-
Labovitz AJ, Noble VE, Bierig M, Goldstein SA, Jones R, Kort S, et al.Focused cardiac ultrasound in the emergent setting: a consensus statementof the American Society of Echocardiography and American Collegeof EmergencyPhysicians. J AmSoc Echocardiogr 2010;23:1225-30.
-
Madan A, Schwartz C. Echocardiographic visualization of acute pulmonaryembolus and thrombolysis in the ED. Am J Emerg Med 2004;22:294-300.
-
Flory CM. Arterial occlusions produced by emboli from eroded atheromatousplaques. Am J Pathol 1945;21:549-65.
-
Kealy WF. Atheroembolism. J Clin Pathol 1978;31:984-9.
-
Cross SS. How common is cholesterol embolism? J Clin Pathol 1991;44:859-61.
-
Keeley EC, Grines CL. Scraping of aortic debris by coronary guidingcatheters:a prospective evaluation of 1,000 cases. J Am Coll Cardiol 1998;32:1861-5.
-
Johnson LW, Esente P, Giambartolomei A, Grant WD, Loin M, RegerMJ,et al. Peripheral vascular complications of coronary angioplasty by thefemoral andbrachial techniques. Cathet Cardiovasc Diagn 1994;31:165-72.
-
Blauth CI, Cosgrove DM, Webb BW, Ratliff NB, Boylan M,Piedmonte MR, et al. Atheroembolism from the ascending aorta: anemerging problem in cardiacsurgery. J Thorac Cardiovasc Surg 1992;103:1104-11. discussion 1111–1112.
-
Glas KE, Swaminathan M, Reeves ST, Shanewise JS, Rubenson D,Smith PK, et al. Guidelines for the performance of a comprehensive intraoperativeepiaortic ultrasonographic examination: recommendations ofthe American Society of Echocardiography and the Society of CardiovascularAnesthesiologists; endorsed by the Society of Thoracic Surgeons. JAm Soc Echocardiogr 2007;20:1227-35.
-
Daneault B, Kirtane AJ, Kodali SK,WilliamsMR, Genereux P, Reiss GR,et al. Stroke associated with surgical and transcatheter treatment ofaortic stenosis: a comprehensive review. J Am Coll Cardiol 2011;58:2143-50.
-
Zamorano JL, Badano LP, Bruce C, Chan KL, Gonc¸alves A, Hahn RT,et al. EAE/ASE recommendations for the use of echocardiography innew transcatheter interventions for valvular heart disease. JAmSoc Echocardiogr2011;24:937-65.
-
Jacobs BS, Boden-Albala B, Lin IF, Sacco RL. Stroke in the young in thenorthern Manhattan stroke study. Stroke 2002;33:2789-93.
-
Marini C, Totaro R, De Santis F, Ciancarelli I, Baldassarre M, Carolei A.Stroke in young adults in the community-based L’Aquila registry: incidenceand prognosis. Stroke 2001;32:52-6.
-
Roach ES, Golomb MR, Adams R, Biller J, Daniels S, Deveber G, et al.Management of stroke in infants and children: A scientific statementfrom a special writing group of the American heart association strokecouncil and the council on cardiovascular disease in the young. Stroke2008;39:2644-91.
-
Cerrato P, Grasso M, Imperiale D, Priano L, Baima C, Giraudo M, et al.Stroke in young patients: Etiopathogenesis and risk factors in differentage classes. Cerebrovasc Dis 2004;18:154-9.
-
Dowling MM, Lee N, Quinn CT, Rogers ZR, Boger D, Ahmad N, et al.Prevalence of intracardiac shunting in children with sickle cell diseaseand stroke. J Pediatr 2010;156:645-50.
-
Bartz PJ, Cetta F, Cabalka AK, Reeder GS, Squarcia U, Agnetti A, et al.Paradoxical emboli in children and young adults: Role of atrial septaldefect and patent foramen ovale device closure. Mayo Clin Proc2006;81:615-8.
-
Carroll JD, Saver JL, Thaler DE, Smalling RW, Berry S, MacDonald LA,et al. Closure of patent foramen ovale versus medical therapy after cryptogenicstroke. N Engl J Med 2013;368:1092-100.
-
Kutty S, Sengupta P, Khandheria B. Patent foramen ovale: The knownand the to be known. J Am Coll Cardiol 2012;59:1665-71.
-
Bartakian S, Fagan TE, Schaffer MS, Darst JR. Device closure of secundumatrial septal defects in children <15 kg: Complication rates and indicationsfor referral. JACC Cardiolasc Interv 2012;5:1178-84.
-
Barker PC, Nowak C, King K, Mosca RS, Bove EL, Goldberg CS. Riskfactors for cerebrovascular events following Fontan palliation in patientswith a functional single ventricle. Am J Cardiol 2005;96:587-91.
-
Ahn KT, Choi J-H, Park SW. Pulmonary arteriovenous fistula in a patientwith cryptogenic stroke. Heart 2011;97:2093.
-
Doering F, Eicken A, Hess J. Ischaemic stroke with intact atrial septum – exclude arteriovenous malformations. Cardiol Young 2014;24:145-7.
-
Butera G, Salvia J, Carminati M.When side matters: Contrastechocardiographywith injection from the left antecubital vein to detect a persistentleft superior vena cava draining to the left atrium in a patient withcerebral stroke.Circulation 2012;125:e1.
-
Calvert PA, Rana BS, Kydd AC, Shapiro LM. Patent foramen ovale:anatomy, outcomes and closure. Nat Rev Cardiol 2011; 8:148-60.