Члени робочої групи з підготовки рекомендацій: акад. НАМН України, проф. В.М. Коваленко, проф. Сичов О.С., проф. М.М. Долженко, проф. Ю.А. Іванів, к.м.н. С.І. Деяк, к.м.н. С.В. Поташев
Ключові слова: правий шлуночок, ехокардіографія, праве передсердя, рекомендації
ЗМІСТ
Виконавче заключення
Огляд
Методологія у встановленні реферативних значень та меж
Акустичні вікна та ехокардіографічні зрізи правих відділів серця
Номенклатура сегментів правих відділів серця та їх коронарне кровопостачання
А. Праве передсердя
Тиск у ПП
Б. Правий шлуночок
Товщина стінки ПШ
Лінійні виміри ПШ
В. ВТПШ
Фракційна зміна площі та волюмометрічна оцінка ПШ
A. Площа ПШ та FAC
Б. Двовимірне визначення об’єму та оцінка ФВ
В. Трьохвимірна оцінка об’єму
Правий шлуночок та морфологія міжшлуночкової перегородки
A. Диференціація часу геометричної деформації при станах перевантаження ПШ тиском та об’ємом
Гемодинамічна оцінка правого шлуночка та циркуляції в малому колі кровообігу
A. Систолічний тиск в легеневій артерії
Б. Діастолічний тиск в легеневій артерії
В. Середній тиск в легеневій артерії
Г. Легеневий судинний опір
Д. Визначення тиску в ЛА підчас фізичного навантаження
Неолюмометрична оцінка функції правого шлуночка
A. Глобальна оцінка систолічної функції ПШ
dP/dt ПШ
ІФМ ПШ
Б. Регіональна оцінка систолічної функції ПШ
TAPSE або рух трикуспідального кільця (TAM)
Тканинна допплерографія
Міокардіальне прискорення підчас ізоволюмічного скорочення
Регіональна деформація та швидкість деформації ПШ (Strain та Strain Rate)
Двохвимірний стрейн
Підсумок рекомендацій з оцінки систолічної функції правого шлуночка
Діастолічна функція правого шлуночка
A. Діастолічна дисфункція
Б. Виміри діастолічної функції ПШ
В. Вплив віку, фаз дихання, ЧСС та умов навантаження
Г. Клінічні паралелі
Клінічне та прогностичне значення оцінки правого шлуночка
Література
Список умовних скорочень
ВТПШ – виносний тракт правого шлуночка
ГПШ – гіпертрофія правого шлуночка
ДТЛА – діастолічний тиск в легеневій артерії
ІФМ – індекс функції міокарду
ІФМ МШ – індекс функції міокарда правого шлуночка
ЛА – легенева артерія
ЛГ – легенева гіпертензія
ЛСО – легеневий судинний опір
ЛШ – лівий шлуночок
МРТ – магнітно-резонансна томографія
НПВ – нижня порожниста вена
ПП – праве передсердя
ПШ – правий шлуночок
СТЛА – систолічний тиск в легеневій артерії
СТПШ – систолічний тиск в правому шлуночку
ТР – трикуспідальна регургітація
ФВ – фракція викиду
ФЗП – фракційна зміна площі
2D – двохвимірний
3D – трьохвимірний
ASE – Американське ехокардіографічне товариство
AT – час прискорення (Acceleration time)
ET – час вигнання (Ejection time)
IVA – ізоволюмічне прискорення (Isovolumic acceleration)
IVCT – час ізоволюмічного скорочення (Isovolumic contraction time)
IVRT – час ізоволюмічної релаксації (Isovolumic relaxation time)
PLAX – парастернальна позиція по довгій вісі
PSAX – парастернальна позиція по короткій вісі
SD – стандартне відхилення (Standard deviation)
TAM – рух трикуспідального кільця (Tricuspid annular motion)
TAPSE – систолічна екскурсія трикуспідального кільця (Tricuspid annular plane systolic excursion)
Виконавче заключення
Праві відділи серця відіграють важливу роль в захворюваності та смертності пацієнтів з ознаками та симптомами кардіопульмональної патології. Втім, більшістю лікарів не виконується систематична оцінка функції правих відділів серця. Частково ця ситуація завдячує великій увазі, що віддається оцінці лівих відділів серця. Крім того, часто має місце нестача ознайомленості ехокардіографістів з ультразвуковими методиками, та недостатність ультразвукових досліджень, що б забезпечували нормальні референтні значення для розмірів та функції правих відділів серця.
Під час кожного дослідження ехокардіографіст та кардіолог повинні досліджувати праві відділи серця з використанням всіх можливих акустичних вікон, а ультразвукове заключення повинне наводити відповідну оцінку на засаді якісних та кількісних параметрів. Параметри, що оцінюються повинні включати виміри розмірів правого шлуночка (ПШ), правого передсердя (ПП), систолічну функцію ПШ (що найменш один з цих параметрів: фракційна зміна площі (ФЗП), S’, та систолічна екскурсія трикуспідального кільця (TAPSE); з чи без розрахунку індекса функції міокарда ПШ (RIMP)), та систолічний тиск в легеневій артерії (СТЛА) з визначенням тиску в ПП на основі розміру та ступеня спадіння нижньої порожнистої вени (НПВ). При багатьох станах показаними є додаткове визначення діастолічного тиску в легеневій артерії (ДТЛА) та оцінка діастолічної функції ПШ. Реферативні значення рекомендованих вимірів наведені в Таб. 1. Ці реферативні значення базуються на даних, отриманих від здорових індивідів без будь-якого анамнезу вродженої кардіальної патології. Багато з рекомендованих значень відрізняються від тих, що були опубліковані раніше та базувалися на попередніх рекомендаціях, що базувалися на рекомендаціях з кількісної оцінки порожнин серця та кардіальних структур за даними Американського ехокардіографічного товариства (ASE) [2]. Дані рекомендації базуються на сумісних Рекомендаціях ASE та Європейської ехокардіографічної асоціації 2010 р. [3], критичному огляді наявних літературних даних та експертному консенсусі членів Всеукраїнської асоціації фахівців з ЕхоКГ.
Нові значення базуються на більшій популяції пацієнтів або виведені з декількох досліджень, у той час як певні попередні нормальні реферативні значення базувалися тільки одному дослідженні. Для лікаря, що інтерпретує результати вимірів важливо відмітити, що надані значення не є індексованими до площі поверхні тіла. В результаті цього існує можливість, що пацієнти зі значеннями на межі реферативного коридору можуть бути помилково класифіковані. Наявних сьогодні даних недостатньо для класифікації аномальних вимірів на легкі, помірні та важкі. Інтерпретуючий лікар, таким чином, повинен визначати ступінь виходу за рамки реферативних меж кожного окремого параметру на свій власний розсуд. При цьому в усіх дослідженнях при прийнятті остаточної інтерпретації критичним є прийняття до уваги всієї інформації, отриманої при ехокардіографічному обстеженні.
Важливі ехокардіографічні доступи та позиції
Апікальна 4-камерна, модифікована апікальна 4-камерна, парастернальна позиція по довгій (PLAX) та короткій вісі ЛШ (PSAX), парастернальна позиція приносного тракту ПШ та субкостальні позиції забезпечують зображення для всесторонньої оцінки систолічної та діастолічної функції ПШ та оцінки систолічного тиску в ПШ (СТПШ).
Виміри правих відділів серця.
Розміри ПШ. Розміри ПШ краще визначаються наприкінці діастоли з апікальної 4-камерної позиції, сфокусованій на ПШ. Слід проявляти обережність при отриманні зображення, демонструючого максимальний діаметр ПШ, щоб його штучно не зменшити (Рис. 6). Це досягається чіткою візуалізацією верхівки серця (Рис. 7). Базальний кінцево-діастолічний розмір >42 мм та розмір на рівні середини ПШ >35 мм вказують на дилатацію ПШ. Також на збільшення ПШ вказує повздовжній розмір ПШ >86 мм.
РОЗМІРИ ПП. Апікальна 4-камерна позиція також дозволяє оцінку розмірів ПП (Рис. 3). На збільшення ПП вказують виміряні наприкінці систоли площа ПП > 18 см2, повздовжній розмір ПП (максимальний розмір) > 53 мм, та поперечний діаметр ПП (або мінімальний розмір) > 44 мм.
Виміри виносного тракту ПШ (ВТПШ, RVOT).
Зріз PSAX на рівні клапану легеневої артерії (КЛА) демонструє «дистальний діаметр» ВТПШ (Рис. 8C), у той час як доступ PLAX дозволяє вимір проксимальної частини ВТПШ, що також називають його «проксимальним діаметром» (Рис. 8A). Діаметр >27 мм в кінці діастоли на рівні прикріплення КЛА («дистальний діаметр») вказує на дилатацію ВТПШ.
Товщина стінки ПШ. Товщина стінки ПШ вимірюється в діастолу, бажано з субкостальної позиції в М- чи В-режимі (Рис. 5). В якості альтернативи для вимірювання товщини стінки ПШ можна також використовувати парастернальні доступи. Товщина >5 мм вказує на гіпертрофію ПШ (ГПШ) та може говорити про перенавантаження ПШ тиском при відсутності іншої патології.
Виміри НПВ. Субкостальний доступ дозволяє візуалізацію та вимірювання НПВ, включаючи її інспіраторне спадіння (колапс). Діаметр НПВ має вимірюватись безпосередньо проксимальніше місця впадіння печінкових вен (Рис. 4). Для спрощення та узагальнення висновків ехокардіографічного дослідження при визначенні СТЛА слід використовувати чіткі значення тиску в ПП, а не діапазон значень (від та до). Діаметр НПВ ≤2.1 cm, що спадається на вдосі >50% говорить про нормальний тиск в ПП 3 mm Hg (діапазон 0–5 mm Hg), у той час як діаметр НПВ > 2.1 см, що колабує підчас вдоху < 50% говорить про підвищений тиск в ПП 15 mm Hg (діапазон 10–20 mm Hg). У випадках, коли діаметр НПВ та ступінь спадіння не вміщуються в дану парадигму, можна використовувати для заключення проміжне значення 8 mm Hg (діапазон 5-10 mm Hg) або, що доцільно, треба залучати інші показники тиску в ПП для уточнення нормального чи підвищенного тиску в ПП Слід відмітити, що у здорових молодих спортсменів НПВ може бути розширеною при нормальному тиску в ПП. Крім того, НПВ звичайно є дилатованою та не колабує у хворих на штучній вентиляції легенів, тому її виміри та оцінка не повинні використовуватись для оцінки тиску в ПП в таких випадках.
Систолічна функція ПШ. Систолічна функція ПШ оцінюється з використанням декількох параметрів, а саме ІФМ ПШ, TAPSE, ФЗП ПШ в В-режимі, ФВ ПШ В-режимі, ФВ ПШ у 3D, систолічна швидкість трикуспідального кільця за даними тканинного допплера (S’), та повздовжній strain та strain rate. Серед них найкраще пристосовані до клінічного вживання та мають більшу цінність згідного більшої кількості досліджень ІФМ ПШ, TAPSE, ФЗП в В-режимі, та S’ трикуспідального кільця. Хоча ФВ ПШ за даними 3D здається більш надійною з меншою відтворюваністю помилок, до сьогодні немає достатньої кількості доказових данних щодо її клінічної цінності.
ІФМ є показником загальної глобальної функції ПШ. ІФМ >0,40 за даними імпульсно-хвильового та >0,55 за даними тканинного допплера вказує на дисфункцію ПШ. Вимірювання час ізоволюмічного скорочення (IVCT), ізоволюмічного розслаблення (IVRT), та час вигнання (ET) за допомогою тканинного імпульсно-хвильового допплера на трикуспідальному кільці можна запобігти похибки, пов’язаної з варіабельністю ЧСС. ІФМ ПШ може бути похибно низьким при станах, асоційованих із підвищенням тиску в ПП, при яких знижується IVRT.
TAPSE легко отримати та виміряти, та є показником повздовжньої функції ПШ. TAPSE < 16 мм вказує на систолічну дисфункцію ПШ. Цей показник вимірюється на латеральному трикуспідальному кільці. Хоча вона вказує на повздовжню функцію, втім, добре корелює з методами оцінки глобальної систолічної функції ПШ, такими як ФВ ПШ за даними радіонуклідних методів, ФЗП ПШ в В-режимі та ФВ ПШ в В-режимі.
ФЗП в В-режимі (відсоток) надає інформацію про систолічну функцію ПШ. ФЗП в В-режимі < 35% вказує на систолічну дисфункцію ПШ. При вимірюванні важливо переконатися, що в зріз потрапив увесь ПШ, включаючи верхівку та бокову стінку як у систолу, так і в діастолу. При визначенні меж ендокарду підчас обведення контуру слід ретельно виключати трабекули, що є частиною порожнини ПШ.
S’ є легким для вимірювання, надійним та відтворюваним. Швидкість <10 cm/s вказую на систолічну дисфункцію ПШ. Було показано, що швидкість S’ добре корелює з іншими методами оцінки глобальної систолічної функції ПШ. Важливо чітко дотримуватись максимальної паралельності між напрямком руху базального сегменту та трикуспідального кільця та курсором допплера (кутова корекція) для запобігання похибки виміру.
Діастолічна функція ПШ. Оцінка діастолічної функції ПШ виконується за допомогою імпульсно-хвильового допплера трикуспідального діастолічного потоку, тканинного допплера латерального трикуспідального кільця, імпульсно-хвильового допплера потоку у печінкових венах та оцінки діаметру НПВ та її здатності спадатися на вдосі. Різні параметри з верхніми та нижніми реферативними нормальними значеннями наведені в Таб. 1. Серед них співвідношення Е/А, час сповільнення раннього діастолічного потоку, співвідношення E/e’, та розміри ПП є рекомендованими до рутинного використання. Відмітьте, що ці параметри слід отримувати підчас кінця видоху при неглибокому диханні з розрахунком середнього арифметичного значення 5 послідовних кардіальних циклів, а також те, що вони можуть бути непридатними для використання при значущій трикуспідальній регургітації (ТР).
Оцінка діастолічної дисфункції ПШ. Співвідношення діастолічних швидкостей E/A на трикуспідальному клапані < 0,8 говорить про порушення релаксації, а E/A на ТК від 0,8 до 2,1 при співвідношенні E/e’ >6 або переважання діастолічного потоку в печінкових венах говорить про псевдонормальне наповнення ПШ, а E/A >2,1 при часі сповільнення раннього діастолічного потоку DT <120 мс може свідчити про рестриктивне наповнення.
Систолічний тиск в легеневій артерії / СТПШ. Швидкість ТР дозволяє надійну оцінку СТПШ при додаванні тиску в ПП за умов відсутності значущої обструкції ВТПШ. Рекомендується визначати тиск у ПП за виміром діаметру НПВ та її здатністю спадатися під впливом дихання краще, ніж використанням фіксованих значень тиску в ПП. Взагалі, швидкість ТР >2,8 – 2,9 м/с відповідає СТЛА приблизно 36 мм Hg, означаючи тиск в ПП 3-5 мм Hg, вказуючи на підвищення СТПШ та у малому колі. СТЛА може підвищуватися, зокрема з віком та при ожирінні. Крім того, СТЛА також є пов’язаним з системним ударним об’ємом та системним АТ. Тобто підвищення СТЛА не завжди повязане з підвищенням легеневого судинного опору (ЛСО). Загалом, пацієнтів з підвищенним СТЛА треба обстежувати ретельніше. Важливо також приймати до уваги, що на показники діастолічної функції ПШ та СТЛА вливають систолічна та діастолічна функція лівого серця. Тиск в ЛА треба наводити разом з системним АТ або середнім АТ.
Оскільки ехокардіографія є першим методом дослідження, що використовується для оцінки пацієнтів з симптомами з боку серцево-судинноє системи, важливо забезпечувати основну оцінку структури та функції правих відділів серця, не обмежуючись лівими відділами. У пацієнтів з встановленною правошлуночковою недостатністю та легеневою гіпертензією (ЛГ) доцільно проводити більш детальну оцінку параметрів правих відділів та малого кола кровообігу, таких як ЛСО.
Огляд
Правим відділам серця довгий час не приділялося достатньої уваги, хоча функція ПШ міцно асоційована з клінічними виходами при багатьох станах.
Є добре та екстенсивно дослідженими лівий шлуночок з встановленими нормальними реферативними межами для його розмірів, об’ємів, маси та функції, у той час як даних щодо розмірів та функції ПШ до останнього часу було недостатньо. Відносно передбачувані межі та геометрія ЛШ та наявність стандартизованих зрізів допомогли визначити нормативи в оцінці ЛШ. Однак, дані щодо нормальних розмірів ПШ є лімітованими, частково з причини його складної геометрії. ПШ складається з трьох чітких відділів: гладком’язовий приносний тракт (тіло шлуночка), відділ виносного тракту ПШ, та трабекулярна апікальна частина. Волюмометрична оцінка функції ПШ є складною з причини необхідності багатьох припущень. В результаті, багато лікарів рідко покладаються на візуальну оцінку для визначення розміру та функції ПШ.
Основні показники розмірів та функції ПШ були включені до Рекомендацій з кількісних вимірів камер та порожнин серця Українського товариства кардіологів та Асоціації фахівців з ехокардіографії 2012 р. [1], що базувалися на рекомендаціях ASE та Європейської асоціації з ехокардіографії від 2005 р. [2]. Однак, цей документ фокусувався на лівих відділах серця, а правим відділам приділявся тільки невеликий розділ рекомендацій. З часу написання попередньої публікації відбувся великий прогрес в ехокардіографічній оцінці правого серця. Крім того, існує насущна потреба по розповсюдженню деталей, що стосуються стандартизації ехокардіографічної оцінки ПШ.
Дані рекомендації слід розгладати як точку підрахунку при визначенні стандартного одностайного методу для отримання зображень правих відділів серця для оцінки розміру та функції ПШ, а також як імпульс для розвитку баз даних для визначення нормальних реферативних меж. Дані рекомендації не ставлять метою детально описати нозології, що уражають праві відділи серця, хоча дана робота містить багато відсилань на патологічні стани ПШ та як вони можуть вплинути на описані виміри.
Таб. 1.
Сумарна таблиця реферативних величин, рекомендованих для структурних вимірів та визначення функції правих відділів серця.
|
Показник
|
Розмірність
|
Патологічне відхилення
|
Ілюстрація
|
|
Розміри порожнини
|
|
Базальний поперечний розмір ПШ
|
см
|
>4,2
|
Рис. 7
|
|
Товщина стінки ПШ з субкостальної позиції
|
см
|
>0,5
|
Рис. 5
|
|
Дістальний діаметр ВТПШ з PSAX
|
см
|
>2,7
|
Рис. 8
|
|
Проксимальний діаметр ВТПШ PLAX
|
см
|
>3,3
|
Рис. 8
|
|
Максимальний розмір ПП
|
см
|
>5,3
|
Рис. 3
|
|
Мінімальний розмір ПП
|
см
|
>4,4
|
Рис. 3
|
|
Кінцево-систолічна площа ПП
|
см2
|
>18
|
Рис. 3
|
|
Систолічна функція
|
|
TAPSE
|
см
|
|
Рис. 17
|
|
Пікова швидкість руху трикуспідального кільця
|
см/с
|
<1,6
|
Рис. 16
|
|
ІФМ імпульсним допплером
|
-
|
<10
|
Рис. 16
|
|
ІФМ тканинним допплером
|
-
|
>0,40
|
Рис. 16 та 18
|
|
ФЗП
|
%
|
>0,55
|
Рис. 9
|
|
Діастолічна функція
|
|
Співвідношення E/A
|
-
|
<0,8 або >2,1
|
|
|
Співвідношення E/E’
|
-
|
>6
|
|
|
Час сповільнення хвилі Е
|
мс
|
<120
|
|
ФЗП – фракційна зміна площі; ІФМ – індекс функції міокарда; PLAX – парастернальна позиція по довгій вісі; ПП – праве передсердя; ПШ – правий шлуночок; ПРПШ – поперечний розмір ПШ; ВТПШ – виносний тракт правого шлуночка; TAPSE – систолічна екскурсія трикуспідального кільця.
Цілі даних рекомендацій наступні:
1. Описати акустичні вікна та ехокардіографічні зрізи, що потрібні для оптимальної оцінки правих відділів серця.
2. Описати ехокардіографічні параметри, що є вимогою при рутинному огляді та прицільних ехокардіографічних дослідженнях, та зрізи, з яких можна отримати ці параметри для оцінки розміру та функції ПШ.
3. Критично оцінити наявні літературні дані, та представити перемоги та недоліки кожного виміру чи методики.
4. Висвітити, які виміри правих відділів мають бути рекомендовані, як обов’язкові в стандартному ехокардіографічному заключенні.
5. Навести переглянуті реферативні значення для вимірів правих відділів серця з крайніми значенням з 95% довірчим інтервалом на основі наявних сучасних літературних даних.
Методологія у встановленні реферативних значень та меж
Для ідентифікації всіх існуючих досліджень щодо ехокардіографічних визначень розмірів правих відділів серця у здорових суб’єктів авторами був проведений поширений системний огляд літературних даних, що охоплював дослідження нормальних реферативних значань та, частіше, дослідження, що наводять дані про розміри та функцію серця у пацієнтів із специфічними захворюваннями та станами (наприклад, хонічні обструктивні захворювання легень). В остінніх для визначення нормальних реферативних меж використовувались тільки контрольні групи. Важливо відмітити, що ці реферативні значення базуються на даних, отриманих в здорових суб’єктів без якого-небудь анамнезу серцевої патології з виключення вроджених вад серця. Для кожного виміру отримувались середнє значення та стандартне відхилення, переконавшись, що техніка, що використовувалась для виміру, була порівняною в різних дослідженнях. Індивідуальні дані окремих пацієнтів були недоступними, тому не екстрагувалися. Середні значення та стандартні відхилення збиралися разом та зважувалися для обрахунків з прийняттям до уваги розміру дослідження та варіабельності між дослідженнями, як типово робиться в мета-аналізах випадкових даних. Мета-аналіз надав загальне середнє значення, нижню межу норми (тобто середнє значення мінус 2 SD), та загальну верхню реферативну межу ((тобто середнє значення плюс 2 SD). Крім того, був розрахований 95% довірчі інтервали, оточуючі середнє, верхнє та нижнє реферативні значення для більш глибокого розуміння надійності еталонних значень. Реферативні значення були переглянуті членами робочої груби з метою переконання їх відповідності реальній клінічній практиці та відбіром певних вимірів для їх обговорення із зовнішніми експертами. Таким чином, даний документ наводить середні значення разом із верхніми та нижніми межами норми в здоровій популяції з урахуванням 95% довірчого інтервалу.
Оскільки дані про пацієнтів були анонімними, визначити реферативні межі для площі поверхні тіла, залежно від статі, або етнічної належності, було неможливо. В результаті, значення може не виходити за рамки 95% довірчого інтервалу, алу бути патологічним для конкретного окремого пацієнта, і навпаки.
Подібно, також з цієї причини неможливо розділити патологічні значення на традиційні категорії легкого, помірного або важкого ступеня відхилення від норми. Ехокардіографіст, таким чином, має визначати на власний розсуд ступінь важкості відхилення будь якого параметру. В рідких ситуаціях, коли мала місце недостатня кількість даних, але робоча група вважала за необхідне рекомендувати методику (напр., визначення тиску в ПП), передивлялися сучасні наявні дані, та на основі накращих наявних даних, приймався консенсус. Багато з наведених в цьому документі значень суттєво відрізняються від тих, що наведені в рекомендаціях ASE’s з кількісних вимірів камер серця 2005 р. [2]. Нормальні значення у попередньому документі часто базувалися на обмежених даних, часто отриманих в лише одному маленькому дослідженні. Таким чином, лікарі заохочуються при оцінці та описанні розмірів та функції правих відділів серця користуватися нормальними значеннями, що наведені в цих, останніх рекомендаціях.
Акустичні вікна та ехокардіографічні зрізи правих відділів серця
Для адекватного диференціювання нормальної структури та функції ПШ від патології та для оцінки розміру, об’єму, скоротливої знатності ПШ має бути отриманий повний набір стандартизованих зрізів (Рис. 1). До них 4-камерна позиція, апікальна 4-камерна позиція, сфокусована на ПШ (Рис. 6), та субкостальні позиції. Важливо використовувати все доступні позиції, тому що кожна з них може надати цінну додаткову інформацію, дозволяючи проведення більш повного обстеження разних сегментів камер правих відділів. Це переслідує оцінку як структури, так і функції. Для оцінки СТПШ особливо важливо отримання спектрів ТР з усіх можливих позицій, тому що максимальна швидкість залежить від оптимального направлення допплерівського курсору паралельно кровопотоку. Всесторонній огляд домопагає усунути протиріччя, що можуть виникнути при дослідженні з різних позицій, внаслідок чтого інтерпретуючий може інтегрально оцінити отриману інформацію більш об’єктивної глобальної оцінки правих відділів серця.
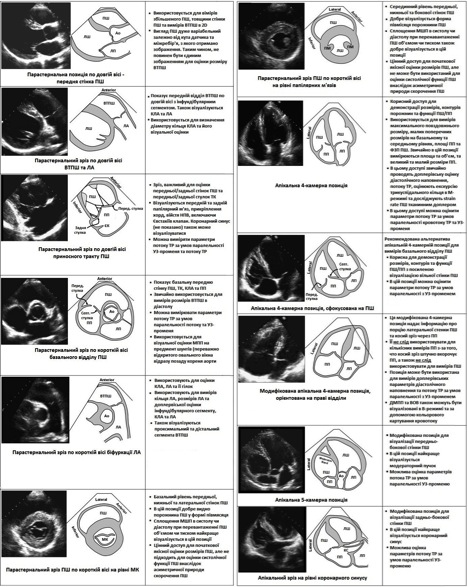
Рис. 1. Зрізи, що використовуються для виконання оцінки правих відділів серця. Кожен зріз супроводжується описом застосування, переваг та обмежень даного конкретного зрізу [1, 4]. Ао – аорта; ДМПП – дефект міжпересердної перегородки; КС – коронарний синус; ФВ – фракція викиду; ЄК – Євстахіїв клапан; ЛП – ліве передсердя; ЛШ – лівий шлуночок; МК – мітральний клапан; ЛА – легенева артерія; ВОВ – відкрите овальне вікно; ПМ – папілярні м'язи; ПП – праве передсердя; ПШ – правий шлуночок; ВТПШ – виносний тракт ПШ; Lateral – латеральна стінка; Anterior – передня стінка; Inferior – нижня стінка; УЗ - ультразвук.
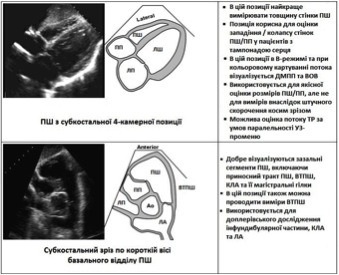
Рис. 1. Продовження [1].
Номенклатура сегментів правих відділів серця та їх коронарне кровопостачання
Права коронарна артерія є основним коронарним стовбуром до ПШ через гострі маргінальні гілки. В умовах гострого інфаркту міокарда загальне правило полягає у тому, що чим проксимальніше рівень оклюзії, тим більша маса міокарду ПШ буде ураженою. У випадку ураження задньої міжшлуночкової гілки правої коронарної артерії, зона ураження може бути обмеженою тільки частиною нижньої стінки ПШ, що найкраще візуалізується з парастернальної позиції приносного тракту ПШ. Задня міжшлуночкова гілка віддає перпендикулярні гілки. Ці задні септальні перфоратори типово кровопостачають задню третину міжшлуночкової перегородки [5]. Кровопостачання модераторного пучка іде з першої перфоруючої гілккки передньої міжшлуночкової гілки лівої коронарної артерії. Такий розподіл кровопостачання може бути відповідним до процедури у випадках необхідности алкогольної септальної абляції. В 30% випадків артерія конусу відходить окремим коронарним вістям, та кровопостачає інфундібулярних віддів. Вона може служити колатераллю передній міжшлуночковій гілкці лівої коронарної артерії [6].
В <10% випадків задньо-латеральні гілки огинаючої гілки лівої коронарної артерії кровопостачають частину задньої вільної стінки ПШ [7, 8]. Передня міжшлуночкова гілка лівої коронарної артерії може кровопостачати частину верхівки ПШ, і ця ділянка може уражатися при інфаркті в басейні ПМШВ. Крім того, є певні неішемічні захворювання, що також можуть асоціюватися з порушеннями регіональної скоротливості ПШ.
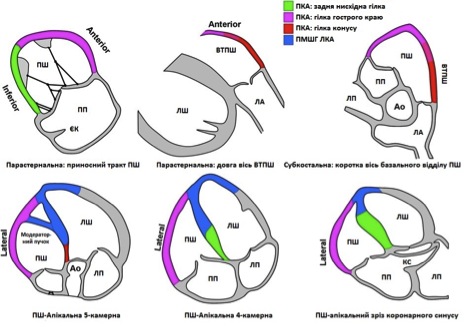
Рис. 2. Сегментарна номенклатура стінок ПШ залежно від їх коронарного кровопостачання [3].
Конвенційна двохвимірна оцінка правих відділів серця
A. Праве передсердця
Праве передсерця (ПП) допомагає у наповненні ПШ (1) виконуючи функцію резервуара для системного венозного повертання крові підчас періоду закритого ТК, (2) праціючи як пасивний кондуїт підчас раннього діастолічного наповнення ТК, та (3) виконує активну насосну функцію в пізню діастолу підчас скорочення переседь [8]. До сьогодні досить мало досліджень фокусувалися на ролі ПП при патологічних станах. Площа ПП була предиктором смертності або ризику трансплантації в дослідженні 25 пацієнтів з первинною ЛГ. Дилатація ПП була задокументована у пацієнтів з суправентрикулярними аритміями підчас двох- та тривимірної ЕхоКГ [9], а після радіочастотної абляції з приводу фібриляції передсердь відбувалося зворотнє ремоделювання [10]. Основне трансторальне окно для візуалізації ПП – апікальна 4-камерна позиція. В цій позиції площа ПП оцінюється за допомогою планіметрії [7]. Максимальна відстань по довгій вісі (повздовжній розмір) ПП від центру трикуспідального кільця до центра верхньої стінки «даху» ПП проводиться паралельно міжпередсердній перегородці. Менший поперечний розмір через середину ПП визначається від середини свобідної латеральної стінки ПП до середини межпередсердної перегородки перпендикулярно довгій вісі. Площа ПП обвидиться наприкінці систоли шлуночків (максимальний об’єм) від латерального краю трикуспідального кільця до його септального краю, виключаючи площу між стулками клапану та фіброзним кільцем по краю ендокарду ПП, виключаючи війстя НПВ та ВПВ, а також вушко ПП (Рис. 3) [8].
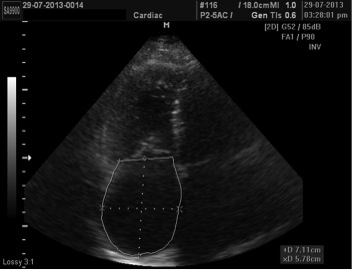
Рис. 3. Обведіння контуру ПП виконується від площини трикуспідального кільця уздовж МПП та верхньої та передньо-бокової стінки ПП. Максимальний розмір ПП представлений лінією від трикуспідального кільця до верхньої стінки ПП (7,1 см), у той час як менший діаметр представлений лінією від передньо-бокової стінки до МПП (5,8 см – дилатація ПП у пацієнта з легеневим серцем).
Слід пам’ятати, що розміри ПП можуть бути ілюзорно хибно завищеними у пацієнтів з деформаціями грудної клітини та грудного відділу хребта. Нормальні значення максимального та мінімального поперечного розмірів та кінцево-систолічної площі ПП наведені в Таб. 2.
Переваги: Розміри та площу ПП, що є надійними маркерами його дилатації, легко отримати в апікальній 4-камерній позиції.
Недоліки: Хоча площа ПП є кращим індикатором діастолічної дисфункції ПШ порівняно з тільки визначенням лінейних розмірів, її визначення віднімає більше часу.
Рекомендації: У пацієнтів, в яких оцінюється дисфункціх ПШ чи ЛШ, слід виводити позиції, адекватні для визначення площі ПП з використанням верхньої межі норми 18 см2. Оцінка розмірів ПП має проводитись у всіх пацієнтів із значною дисфункцією ПШ, в яких якість візуалізації не дозволяє визначення площі ПП. Верхні межі норми для короткої та довгої вісі складають 4,4 та 5,3 см, відповідно (Таб. 2). Оскільки сьогодні кількість даних щодо стандартизації визначення об’єму ПП за домопогою двохвимірної ЕхоКГ є дуже нечисленною, рутинне визначення об’єму ПП сьогодні не є рекомендованим.
Тиск в ПП. Тиск в ПП найчастіше визначається по діаметру НПВ та наявності її інспіраторного колапсу [11]. По мірі наростання тиску в ПП, цей тиск передається на НПВ, що призводить до зменшення ступеня колапсу підчас вдоху та дилатаціх НПВ. Комбінація цих двох параметрів дозволяє адекватно оцінити тиск в ПП у більшості пацієнтів. Нещодавно були переглянуті традиційні реферативні межі діаметру НПВ та ступеня її спадіння, тому що було з’ясовано, що ці параметри добре відтворювані у випадках низького або високого тиску в ПП, та гірше – у випадках проміжних значень [10]. Вторинні індекси тиску в ПП можуть бути корисними у неясних випадках для звуження остаточних висновків. У пацієнтів на штучній вентиляції легенів з позитивним тиском ступінь інстпіраторного колапсу НПВ не може бути використаним для надійної оцінки тиску в ПП, тому тиск у ПП має визначатися кривавим способом підчас центрального венозного доступу, якщо це можливо. Однак, діаметр НПВ ≤1,2 см у таких пацієнтів є надійною ознакою тиску в ПП <10 мм Hg [13], а малий діаметр НПВ, що спалася, в цій групі пацієнтів говорить про гіповолемію.
Субкостальні зрізі найкорисніші для візуалізації НПВ, яка виводиться по довгій вісі [14]. Вимір НПВ має проводитись наприкінці видоху трохи проксимальніше місця впадіння війсть печінкових вен, що знаходяться приблизно на відстані 0,5 – 3,0 см від місця впадіння НПВ в ПП (Рис. 4) [16, 17].
Для акуратної оцінки інспіраторного колапсу НПВ, зміни її діаметру мають оцінюватися як на глибокому вдосі, так і підчас неглибокого дихання, переконавшись, що зміни діаметру не відповідають переходу НПВ в іншу площину зрізу [7, 8, 15]. Вимір виконується перепендикульно до довгій вісі НПВ. Хоча дилатація НПВ звичайно вказує на підвищення тиску в ПП, у пацієнтов без інших патологічних знахідок може знадобиться повторна оцінка діаметру та здатності спадатися на вдосі на лівому боці, для запобігання хибного заключення про підвищення тиску в ПП.
Також НПВ може бути дилатованою у молодих здорових спортсменів, що в цій популяції не говорить про підвищення тиску в ПП.
Рис. 4. Доступ повздовжнього зрізу нижньої порожнистої вени (НПВ). Вимірювання НПВ. Діаметр (товста лінія) вимірюється перпендикулярно до повздовжньої осі НПВ наприкінці видиху безпосередньо проксимальніше до міста впадіння печінкових вен, що знаходиться на відстані 0,5-3,0 см проксимальніше війстя ПП.
Профілі кровотоку в печінкових венах забезпечують додаткову інформацію про тиск в ПП. При низькому чи нормальному тиску в ПП переважає систолічна хвиля (Vs) потоку в печінковій вені, що є більшою за швидкістю, ніж діастолічна (Vd). При підвищенні тиску в ПП швидкість хвилі Vs значно падає та співвідношення Vs/Vd стає <1. Співвідношення Vs/(Vs + Vd) визначається як систолічна фракція наповнення ПП, а його значення < 55% виявилось найбільш чутливою та специфічною ознакою підвищенного тиску в ПП [18].
Важливо, що ці показники кровотоку в печінкових венах були підтверджені у пацієнтів підчас штучної вентиляції легенів при тому, що використовувались середні значення ≥5 послідовних скорочень, що захоплювали ≥1 респіраторного циклу. Інші 2D-ознаки підвищенного тиску в ПП включають дилатацію ПП та вибухання МПП в порожнину лівого передсердя на протязі всього кардіального циклу. Ці ознаки є якісними та порівняльними, та не дозволють кількісну інтерпретацію, але їх наявність говорить про необхідність більш детальнох оцінки тиску в ПП та пошук відповідної етіології.
Переваги: Звичайно розмри НПВ з субкостального доступу досить легко отримати.
Недоліки: Колапс НПВ не відбиває тиск в ПП у пацієнтів на штучній вентиляції. Інспіраторний колапс НПВ є менш надійним при помірному підвищенні тиску в ПП.
Рекомендації: Для простоти та універсальності заключень для визначення СТЛА слід використовувати специфічні значення тиску в ПП, а не його межі («коридор» від та до). Діаметр НПВ ≤2,1 см, що колабує >50% на вдосі говорить про нормальний тиск в ПП 3 мм Hg («коридор» 0-5 мм Hg), в той час як діаметр НПВ >2,1 см, що спадається на вдосі <50% говорить про високий тиск в ПП 15 мм Hg («коридор» 10-20 мм Hg). В невизначених випадках, коли діаметр НПВ та ступінь її спадіння не вписуються в дану парадигму, може використовуватися проміжне значення 8 мм Hg («коридор» 5-10 мм Hg), або, краще слід прибігнути до вторинних показників підвищення тиску в ПП. Такі включають рестриктивну графіку діастолічного наповнення ПШ, трикуспідальне співідношення E/E’ >6, та переважання діастолічного потоку в печінкових венах (що можно кількісно визначити розрахувавши систолічну фракцію наповнення ПП < 55%). В неясних випадках, якщо не виявляється жоден з цих вторинних маркерів, тиск в ПП визначається як нормальній – 3 мм Hg. Якщо має місце мінімальних інспіраторний колапс НПВ (<35%) та наявні вторинні маркери підвищеного тиску в ПП, тиск в ПП визначається як підвищений – 15 мм Hg. Якщо певної визначеності немає, приймається проміжне значення тиску в ПП – 8 мм Hg. У пацієнтів, що не здатні адекватно зробити глибокий вдвох, та НПВ при неглибокому диханні спадається на <20% звичайно тиск в ПП підвищений. Цей петод оцінки тиску в ПП є переважним, зважаючи на фіксовані значення тиску в ПП для всіх пацієнтів (Таб. 4).
B. Правий шлуночок
Товщина стінки ПШ. Товщина стінки ПШ є корисним виміром для виявлення ГПШ, що звичайно розвивається в умовах його перенавантаження тиском (підвищення СТПШ) [19-21]. Збільшення товщини стінки ПШ можна побачити при інфільтративних чи гіпертрофічних кардіоміопатіях, а також у пацієнтів з вираженою гіпертрофією ЛШ навіть за відсутності ЛГ [19]. Товщину свобідної стінки ПШ можна виміряти в М- чи В-режимі з субкостальної позиції, бажано на рівні кінчика передньої стулки трикуспідального клапана, або з лівих парастернальних зрізів [6, 18]. З субкостальної позиції легко вирівняти напрямок ультразвукового променя перпендикулярно свободній стінці ПШ. Критичним для акуратного виміру є виключення трабекулярності та папілярних м’язів ПП з ендокардіальної поверхні ПШ. Зсув фокусу на область стінки ПШ та зменшення глибини сканування звичайно допомагає поліпшити розрішення ендокардіальної границі. Також треба ретельно слідкувати за тим, щоб виключити з виміру епікардіальний жир.
Якщо якість візуалізації дозволяє, треба використовувати базову фундаментальну частоту, тому що «гармоніка» також трошки потовщує стінку ПШ. При значному потовщені вісцерального перикарду, визначення товщини стінки ПШ може бути досить складним. Певі стани, асоційовані з потоншенням стінки ПШ – наприклад, хвороба Ула або аритмогенна правошлуночкова кардіоміопатія. Але чітких ехокардіографічних критеріїв для визначення аномально тонкої стінки ПШ не існує.
Переваги: Товщина стінки ПШ може бути виміряна в М- чи В-режимі з субкостального чи парастернального доступу.
Недоліки: Не визначає доказових прогностичних даних.
Рекомендації: Аномальне потовщення стінки ПШ має бути описане в протоколі при наявності, у пацієнта з підозрою на дисфункцію ПШ та / або ЛШ, використовуючи верхню межу норми 0,5 см з PLAX або субкостального доступу (Таб. 2).
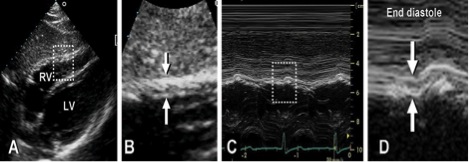
Рис. 5. Вимірювання товщини стінки ПШ. А. Субкостальне зображення у 2D стінки ПШ. В. Збільшене зображеня в режимі «zoom» регіону виділеного на зображенні А з товщиною стінки, означеною стрілками. С. Зображення в М-режимі, що відповідає стрілка на зображенні В. D. Режим «zoom» позначеного на зображенні С регіону – товщина стінки ПШ наприкінці діастоли [3].
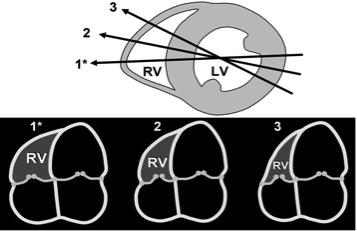
Рис. 6. Діаграма, що показує рекомендовану апікальну 4-камерну позицію (А4С), що фокусується на ПШ (1*) та залежність розміру ПШ від зміни кута зрізу (2,3) не зважаючи на подібний розмір та вигляд ЛШ. Зверху показано лінію перехресту А4С зрізів (1*,2,3) з центром ЛШ на прикладі зрізу по короткій вісі ЛШ відповідно до наведених нижче А4С зрізів. RV – ПШ; LV – ЛШ [3].
Лінійні виміри ПШ. Дилатація ПШ відбувається у відповідь на хронічне перенавантаження об’ємом та / або тиском [22] та при недостатності ПШ [23]. Індекс кінцево-діастолічного діаметру ПШ був ідентифікований, як предиктор виживання у пацієнтів з хронічною легеневою патологією [24], а співвідношення кіндево-діастолічних діаметрів ПШ/ЛШ був предиктором несприятливих клінічних подій та/або внутрішньогоспітального виживання у пацієнтів з гострою тробмоемболією гілок легеневої артерії [25, 26]. Кореляція між лінійними вимірами ПШ та кінцево-діастолічним об’ємом ПШ погіршується при підвищенні перед- [27] та постнавантаження [28]. Підчас ЕхоКГ в В-режимі розмір ПШ можна вимірят з апікальної 4-камерної позиції в кінці діастоли.
Хоча кількісна оцінка ПШ не досконала, якісно, ПШ має виглядати меншим за розмірами порівняно з лівим, та звичайно не перебільшувати 2/3 від ромірів лівого в стандартній апікальній 4-камерній позиції. Якщо правий шлуночок в цій позиції виглядає меншим за ромірами, скоріш за все має місце його значуще збільшення. Це правило може бути притінено в певних ситуаціях, таких як важке перенавантаження ПШ тиском чи об’ємом, при яких розміри ПШ можуть знаходитися в нормальних межах, але сам шлуночок виклядає більше маленького недонаповненого лівого шлуночка. В стандартній трансторакальній апікальній 4-камерній позиції в нормі верхівка серця формується лівим шлуночком. При збільшенні правого шлуночка, він може зсувати лівий шлуночок та займати собою верхівку. Це вказує на по меншій мірі помірну дилатацію ПШ, хоча це спостереження не можна підтвердити кількісно.
Одним великим обмеженням візуалізації ПШ підчас трансторакальної ЕхоКГ є недостатність фіксованих референтних точок оптимізації вимірів ПШ. В результаті оператор може виводити дуже різні зрізи і площини через ПШ, що призводить до високої варіабельності розмірів (Рис. 6). Тому при проведенні дослідження важливо збробити попитку пристосувати апікальну 4-камерну позицію для того, щоб отримати зріз «сфокусований на правому шлуночку», як детальніше наведено нижче. Для оптимізації зображення латеральної стінки ПШ, 4-камерне зображення треба оптимізувати так, щоб фокус, що звичайно локалізований на лівих відділах, змістився на правий шлуночок. При цьому датчик ротується так, щоб отримати максимальну площину порожнини ПШ, що дозволяє запобігти недооцінки розмірів. Для запобігання переоцінки, датчик слід повернути через верхівку та цент порожнини ЛШ. При цьому треба переконатися, що ПШ не зрізаний, а не візуаліється виносний тракт лівого шлуночка (тобто не перейти в 5-камерну позицію).
В цій позиціх можна виміряти базальний діаметр та поперечний діаметр посередині порожнини, а також повздовжній розмір (Рис. 7) [1]. Базальний діаметр визначається як максимальний розмір по короткій вісі в базальній третині ПШ в 4-камерній апікальній позиції [2, 27, 29].
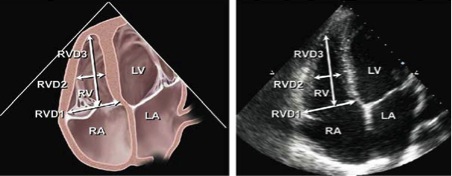
Рис. 7. Діаграма (зліва) та відповідне ЕхоКГ зображення в А4С позиції (зправа), що показують базальний (RVD1) та серединний (RVD2) поперечні та повздовжній розміри ПШ (RVD3). Датчик встановлений фокусуючись на порожнині ПШ з метою вивести максимальні розміри ПШ. В цій позиції краще візуалізується вільна стінка ПШ, що полегшує також виміри фракційної зміни його площі [1–3].
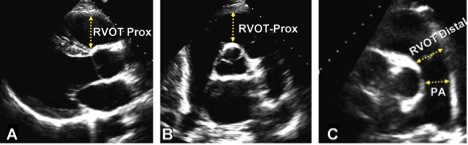
Рис. 8. Виміри розмірів виносного тракту ПШ (RVOT) на проксимальному або подклапанному рівні (RVOT-Prox) та на дистальному рівні, або дистальному рівні (RVOT-Distal) в (A) парастеранальній позиції по довгій вісі ЛШ (візуалізується передня частина ВТПШ, (B) парастернальній позиції по короткій вісі на рівні магістральних судин, та (C) парастернальній позиції по короткій вісі на рівні біфуркації ЛА. PA – поперечний розмір ЛА на рівні між КЛА та її біфуркацією.
В нормальному ПШ максимальний діаметр по короткій вісі звичайно локалізований в базальній третині порожнини шлуночка [6, 27]. Середній діаметр по короткій вісі вимірюється в середній третині ПШ на рівні папілярних м’язів. Повздовжній розмір вимірюється від площини трикуспідального кільця до верхівки ПШ.
Треба пам’ятати, що розміри ПШ можуть бути хибно завищеними у пацієнтів з деформаціями грудної клітини та грудного відділу хребта.
Переваги: Лінійні виміри ПШ, що є надійними маркерами дилатації ПШ, легко отримати з апікальної 4-камерної позиції.
Недоліки: Розміри ПШ дуже залежать від орієнтації датчика оператором, що може призвести по недооцінки розмірів порожнини ПШ.
Рекомендації: У пацієнтів з ехокардіографічними ознаками ураження правих відділів серця або ЛГ в ідеалі в ехокардіографічному заключенні повинні бути наведені виміри базального та середнього поперечного та повздовжнього розмірів ПШ в апікальній 4-камерній позиції. Базальний поперечний розмір ПШ повинен бути в будь-якому повному ехокардіографічному заключенні з вказанням позиції, в якій був проведений вимір (в ідеалі апікальний 4-камерний доступ сфокусований на ПШ) для можливості порівнянні різних заключень.
Відносний розмір ПШ повинен порівнюватися з таким лівого шлуночка, щоб визначити чи є якісні ознаки дилатації ПШ, не зважаючи на можливий нормальний розмір, базуючись на тому, що ПШ виглядає значно більшим порівняно з лівим шлуночком. Верхня межа норми для базального поперечного розміру ПШ становить 4,2 см (Таб. 2).
C. Виносний тракт ПШ
Виносний тракт ПШ (ВТПШ, RVOT) включає субпульмонарну воронку, або конус, та клапан легеневої артерії (КЛА). Субпульмонарна воронка – це м’язова структура, що тягнеться від надшлуночкового гребінця (crista supraventricularis) до КЛА. Ця структура відрізняється від решти ПШ за ембріогенезом [30] та анатомією [31]. Затримка регіональної активації ВТПШ призводить до перистальтичного характеру скорочення нормального ПШ [31, 32]. Роль ВТПШ особливо важлива у деяких пацієнтів з вродженими вадами серця [33] та аритміях [34]. При цьому ВТПШ часто є першим сегментом ПШ, де відбувається діастолічний колапс стінки підчас тампонади.
ВТПШ краще за все візуалізується з лівого парастернального та субкостального вікон, але в індивідуальних випадках у худорлявих суб’єктів чи дорослих з широкими межребір’ями може бути візуалізований і з апікального доступу. Розмір (діаметр) ВТПШ слід вимірювати наприкінці діастоли на рівні комплексу QRS при синхронному запису ЕКГ. В позиції PLAX можна виміряти проксимальну частину ВТПШ (RVOT-Prox на Рис. 8A). По короткій вісі діаметр ВТПШ може бути виміряний від (1) передньої стінки аорти до свободної стінки ПШ над аортальним клапаном (RVOT-Prox на Рис. 8B) та (2) безпосередньо проксимальніше КЛА (RVOT-Distal на Рис. 8C) [1]. Перевагу слід віддавати цьому останньому, в місці з’єднання інфундибулярної порції ПШ, особливо при визначенні ударного об’єму ПШ для розрахунку Qp/Qs або фракції регургітації. Позиція PLAX з візуалізацією ВТПШ використовується, зокрема, для оцінки ПШ при його аритмогенній дисплазіхї [33]. При черезстравохідній ЕхоКГ ВТПШ добре візуалізується з середньо-стравохідної позиції в зрізі приносний тракт-виносний тракт. Використання 3D-ЕхоКГ також виявилось корисним в оцінці ВТПШ [36].
Слід пам’ятати, що розміри ВТПШ можуть виглядати хибно збільшеними у пацієнтів з деформаціями грудної клітини та хребта.
Переваги: Розміри ВТПШ легко отримати з доступу PSAX.
Недоліки: Доступна лише обмежена база даних нормальних значень. Вікно для вимірювання ВТПШ не є стандартизованим, а косий зріз через ВТПШ може призвести до хибно заниженого або завищеного значання. Визначення межі ендокарду передньої стінки ПШ часто є субоптимальним.
Рекомендації: При дослідженні окремих пацієнтів з вродженими вадами серця або аритміями, що потенційно можуть залучати ВТПШ слід вимірювати проксимальний та дистальний діаметри ВТПШ з позицій PSAX або PLAX. Дистальний діаметр ВТПШ з позиції PSAX безпосередньо проксимальніше кільця КЛА є найбільш відтворюваним, і має використовуватися рутинно. Для вибраних випадків, таких як аритмогенна правошлуночкова кардіоміопатія, слід додавати вимір з позиції PLAX. Верхня межа норми для дистального діаметру ВТПШ з позиції PSAX складає 27 мм, а з позиції PLAX – 33 мм (Таб. 2).
Таб. 2.
Розміри порожнин правих відділів серця.
|
Розміри
|
Дослідження
|
n
|
НМН
(95% СІ)
|
ВМН
(95% СІ)
|
|
Базальний поперечний розмір ПШ (мм) (Рис. 7, RVD1)
|
10
|
376
|
24 (21-27)
|
42 (39-45)
|
|
Середній поперечний розмір ПШ (мм) (Рис. 7, RVD2)
|
12
|
400
|
20 (15-25)
|
35 (30-41)
|
|
Повздовжній розмір ПШ (мм) (Рис. 7, RVD3)
|
12
|
359
|
56 (50-61)
|
86 (80-91)
|
|
Кінцево-діастолічна площа ПШ (см2) (Рис. 9)
|
20
|
623
|
10 (8-12)
|
25 (24-27)
|
|
Кінцево-систолічна площа ПШ (см2) (Рис. 9)
|
16
|
508
|
4 (2-5)
|
14 (13-15)
|
|
Індекс кінцево-діастолічного об’єму ПШ (мл/м2)
|
3
|
152
|
44 (32-55)
|
80 (68-91)
|
|
Індекс кінцево-систолічного об’єму ПШ (мл/м2)
|
1
|
91
|
19 (17-21)
|
46 (44-49)
|
|
3D-Індекс кінцево-діастолічного об’єму ПШ (мл/м2)
|
5
|
426
|
40 (28-52)
|
89 (77-101)
|
|
3D-Індекс кінцево-систолічного об’єму ПШ (мл/м2)
|
4
|
394
|
12 (1-23)
|
45 (34-56)
|
|
Товщина стінки ПШ з субкостального доступу (мм) (Рис. 5)
|
4
|
180
|
4 (3-4)
|
5 (5-6)
|
|
Товщина стінки ПШ в позиції ВТПШ PLAX (мм) (не показано)
|
9
|
302
|
2 (1-2)
|
5 (4-6)
|
|
Діаметр ВТПШ в позиції PLAX (мм) (Рис. 8)
|
12
|
405
|
18 (15-20)
|
33 (30-35)
|
|
Проксимальний діаметр ВТПШ (мм) (Рис. 8 RVOT-Prox)
|
5
|
193
|
21 (18-25)
|
35 (31-39)
|
|
Дістальний діаметр ВТПШ (мм) (Рис. 8 RVOT-Distal)
|
4
|
159
|
17 (12-22)
|
27 (22-32)
|
|
Повздовжній розмір ПП (мм) (Рис. 3)
|
8
|
267
|
34 (32-36)
|
53 (51-55)
|
|
Поперечний розмір ПП (мм) (Рис. 3)
|
16
|
715
|
26 (24-29)
|
44 (41-46)
|
|
Кінцево-систолічна площа ПП (см2) (Рис. 3)
|
8
|
293
|
10 (8-12)
|
18 (17-20)
|
* СІ – довірчий інтервал; НМН – нижня межа норми; ВНМ – верхня межа норми.
Таб. 3
Оцінка тиску в ПП на основі діаметру та інспіраторного спадіння НПВ.
|
Показник
|
Норма (0-5 [3] мм Hg)
|
Проміжне значення (5-10 [8] мм Hg)
|
Високий тиск в ПП (15 мм Hg)
|
|
Діаметр НПВ
|
≤2,1 см
|
≤2,1 см
|
>2,1 см
|
>2,1 см
|
|
Ступінь спадіння на вдиху
|
>50%
|
<50%
|
>50%
|
<50%
|
|
Вторинні показники підвищеного тиску в ПП
|
-
Рестриктивне наповнення ПШ
-
Трикуспідальне Е/Е’ >6
-
Переважання діастолічного кровотоку в печінкових венах (систолічна фракція наповнення <55%)
|
Фракційна зміна площі та волюмометрічна оцінка ПШ
A. Площа ПШ та ФЗП
Відсоток ФЗП ПШ, що визначається за формулою «Кінцево-діастолічна площа – кінцево-систолічна площа / Кінцево-діастолічна площа х 100%», є показником систолічної функції ПШ, що добре корелює з ФВ ПШ за даними магнето-резонансної томографії (МРТ) серця [27, 37].
Було виявлено, що ФЗП ПШ є незалежним пре диктором серцевої недостатності, раптової смерті, інсульту та / чи смертності в дослідженнях пацієнтів після тромбоемболії легеневої артерії [38] та інфаркту міокарду [39, 40].
ФЗП отримується шляхом обведення ендокарду ПШ в систолу та діастолу від трикуспідального латерального кільця по боковій стінці до верхівки, після чого вниз по МШП до септального сегменту трикуспідального кільця. При цьому треба обводити свободну стінку, лишаючи трабекули в полості ПШ (Рис. 9).
Рекомендації: ФЗП в В-режимі є одним з рекомендованих методов кількісної оцінки функції ПШ з нижньою межею норми 35%.
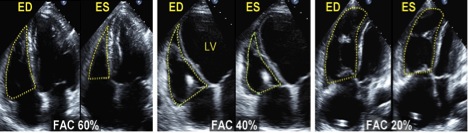
Рис. 9. Приклади фракційної зміни площі (ФЗП) ПШ. ФЗП (%) = (кінцево-діастолічна площа (ED) – кінцево-ситолічна площа (ES)) / кінцево-діастолична площа х 100%. Ендокардіальні межі обводяться в А4С позиції від трикуспідального кільця по вільній стінці до верхівки та знов до трикуспідального кільця по МШП наприкінці діастоли та наприкінці систоли. Трабекулярність, стулки ТК та хорди включаються в порожнину ПШ. Ліве зобреження: здоровий суб’єкт з ФЗП = 60%. Середнє зображення: помірно дилатований ПШ з ФЗП = 40%. Праве зображення: значна дилатація ПШ з ФЗП = 20%, при чому ЛШ є стиснутим та укороченим на вигляд в тому числі за рахунок оптимізації та фокусі на порожнині ПШ. FAC – ФЗП [3].
B. Двовимірне визначення об’єму та оцінка ФВ
Складність визначення об’єму та функції ПШ в В-режимі є добре документованою [31, 41, 42]. Якщо коротко, ехокардіографічні методи розрахунку об’єму ПШ в В-режимі можна поділити на методики площі-довжини, сумації дисків, та інші.
Методи «площа-довжина», що початково використовувались у біплановій вентрикулографії, потребують спрощення геометрії ПШ, що звичайно базується на модифікованій пірамідальній або еліпсоїдній моделях [41, 43, 45]. Вони значно недооцінюють об'єм ПШ порівняно зі значеннями, що отримують при МРТ та 3D-ЕхоКГ [45]. Метод сумації дисків також використовувався для визначення об’єму «тіла» ПШ, переважно в апікальній 4-камерній позиції [46]. При використанні цього метода об'єм такоє недооцінюється внаслідок виключення з оцінки ВТПШ та технічних обмежень ехокардіографічних зображень.
ФВ ПШ в В-режимі розраховується як «КДО – КСО / КДО х 100%». Нижня межа норми в відомих дослідженнях, що використовували ці методи для визначення ФВ ПШ становить 44% з 95% довірчим інтервалом 38-50% (Таб. 4).
Рекомендації: Визначення ФВ ПШ в В-режимі не є рекомендованим внаслідок різномаїття методик та численних геометричних припущень.
C. Трьохвимірна оцінка об’єму
Точність оцінки об’єму ПШ підчас 3D-ЕхоКГ була доведена на тваринних моделях [47, 48] та інтраопераційної оцінки об’єму ПШ у людей [51]. На сьогодні найчастіше використовані методи в 3D для розрахунку об’ємів та ФВ ПШ – це методи сумації дисків та апікальний ротаційний метод. Зображення для цього можуть бути отримані як трансторакально, так і черезстравохідно [51-53]. Методологія є досить складною та лежить за межами даного документу. Для ознайомлення з нею варто звернутися до Horton та співавт. [54].
Порівняно з моделями in vitro, апікальний ротаційний метод у 3D був найточнішим при оцінці ≥8 площин, між якими був рівний кут [48]. Трьохвимірний апікальний ротаційний метод з використанням 8 зрізів давав результат подібний до методу сумації дисків у 3D в змішаній групі дорослих пацієнтів [55]. В багатьох випадках в клінічних умовах обидва методи добре корелювали з об’ємами ПШ, отриманими підчас МРТ серця як у дітей [56-58], так і дорослих [53, 59-65].
При використанні 3D-ЕхоКГ порівняно з В-режимом спостерігається менша ступінь недооцінки КДО та КСО ПШ та краща відтворюваність при повторному обстеженні [45, 62]. Кумулятивні дані декількох невеликих та одного великого дослідження [66] вказують на верхню межу норми для індексованого КДО ПШ 89 мл/м2 та КСО ПШ – 45 мд/м2, при чому у жінок порівняно з чоловіками звичайно ці значення менші на 10-15% (Таб. 2). Нижня межа норми для ФВ ПШ складає 44% (Таб. 4).
Переваги: Об’єми та ФВ ПШ можна досить точно виміряти підчас 3D-ЕхоКГ з використанням визнаних алгоритмів в режимі реального часу.
Недоліки: Доступна лише обмежена база даних нормальних значень за даними досліджень, що використовували різні методи оцінки у невеликої кількості пацієнтів. Об’єми ПШ, визначенні як в В-режимі, так і підчас 3D-ЕхоКГ недооцінюють реальні значення порівняно з даними МРТ серця, хоча методи 3D є більш точними. Крім того, метод сумації дисків у 3D забирає відносно багато часу. Нарешті, доступно недостатньо даних щодо значно дилатованого ПШ або важкої дисфункції ПШ, що робить точність об’ємів та ФВ ПШ, отриманих за даними 3D більш сумнівними.
Рекомендації: Підчас дослідження у певних пацієнтів з дилатацією або дисфункцією ПШ може використовуватись метод сумації дисків у 3D для розрахунку ФВ ПШ з нижньою межею норми 44%. До того, як буде опубліковано більше даних результатів досліджень, доцільно зарезервувати 3D-методики для серійних визначень об’ємів та ФВ ПШ.
Правий шлуночок та морфологія міжшлуночкової перегородки
Хронічна дилатація ПШ, що може, наприклад, розвинутись при ізольованому перевантаженні ПШ об’ємом (напр., ТР) призводить до прогресуючого подовження дистанції від основи до верхівки та від вільної стінки до міжшлуночкової перегородки, в той час як верхівка серця починає формуватися ПШ, що заміщує собой лівий шлуночок. В позиції PSAX ЛШ набуває дельтовидної форми, у той час як МШП сплощується, втрачаючи своє природне вигинання у бік ПШ підчас діастоли [67-69].
Таб. 4.
Систолічна функція ПШ.
|
Показник
|
Дослідження
|
n
|
НМН
(95% СІ)
|
ВМН
(95% СІ)
|
|
TAPSE (мм) (Рис. 17)
|
46
|
2320
|
16 (15-18)
|
30 (29-31)
|
|
Систолічна швидкість трикуспідального кільця S’ імпульсно-хвильвим тканинним доплером (см/)
|
43
|
2139
|
10 (9-11)
|
19 (18-20)
|
|
Систолічна швидкість трикуспідального кільця при кольоровому картуванні тканин (см/)
|
5
|
281
|
6 (5-7)
|
14 (12-15)
|
|
ІФМ ПШ імпульсно-хвильовим доплером (Рис. 16 та 18)
|
17
|
686
|
0,15 (0,10-0,20)
|
0,40 (0,35-0,45)
|
|
ІФМ ПШ тканинним доплером (Рис. 18)
|
8
|
590
|
0,24 (0,16-0,32)
|
0,55 (0,47-0,63)
|
|
ФЗП (%) (Рис. 8)
|
36
|
1276
|
35 (32-38)
|
63 (60-65)
|
|
ФВ ПШ (%) (Рис. 8)
|
12
|
596
|
44 (38-50)
|
71 (66-77)
|
|
ФВ ПШ у 3D (%)
|
9
|
524
|
44 (39-49)
|
69 (65-74)
|
|
IVA (м/с2)
|
12
|
389
|
2,2 (1,4-3,0)
|
5,2 (4,4-5,9)
|
* СІ – довірчий інтервал; НМН – нижня межа норми; ВНМ – верхня межа норми.
Перенавантаження ПШ об’ємом також порушує нормальну циркулярну геометрію ЛШ по короткій вісі за рахунок зсуву перегородки вліво у напрямку від центру ПШ та ближче до центру ЛШ, що призводить до сплощення перегородки та дельтовидного виду порожнини ЛШ підчас систоли. Цей взаємозв’язок між лівим та правим шлуночками може бути виражений кількісно на основі співвідношення між передньо-заднім та перегородково-латеральним поперечними розмірами. Цей «індекс ексцентричності» вважається патологічним та говорить про перевантаження ПШ при досягненні значення >1,0 [70]. Конфігурація МШП залежить від відносного градієнту тиску між правим та лівим шлуночками в кожній фазі кардіального циклу. Внаслідок того, що більшістій ситуації перевантаження ПШ тиском у дорослих розвиваються вторинно відносно підвищення тиску наповнення ЛШ, аналіз геометрії МШП та взаємодії тисків у шлуночках ускладнюється накладанням систолічного перевантаження тиском ПШ та діастолічного перевантаження тиском ЛШ [71].
A. Диференціація часу геометричної деформації при станах перевантаження ПШ тиском та об’ємом
Різниці в часі руху МШП вимірюються за допомогою тканинної доплерографії та у М-режимі (Рис. 10) [72]. Хоча пацієнти з відносно ізольованим перевантаженням ПШ об’ємом мають найбільш виражений зсув МШП від центру ПШ наприкінці діастоли (з відносно близькою до нормальної геометрією наприкінці систоли), у пацієнтів з відносно ізольованим перевантаженням ПШ тиском лівий септальний зсув від центру ПШ спостерігається як наприкінці систоли, так і діастоли, з найбільш вираженою деформацією МШП наприкінці систоли. У певних популяціях пацієнтів, таких як пацієнти з ЛГ, слід розраховувати септальний індекс ексцентричності та якісно оцінювати час найбільшої деформації для забезпечення прогностичної інформації та оцінки клінічної відповіді на терапію [73, 74].
Аналіз руху МШП найкраще оцінювати за відсутності порушень провідності, особливо блокади лівої ніжки пучка Гіса.
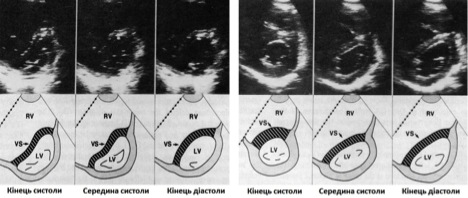
Рис. 10. Серії стоп-кадрів двохвимірних зображень по короткій вісі ЛШ на рівні хорд мітрального клапану з діаграмами у пацієнтів з ізольованим перевантаженням ПШ тиском внаслідок легеневої гіпертензії (ліва серія), та ізольованим перевантаженням ПШ тиском внаслідок резекції ТК (права серія). В той час як у здорових суб’єктів порожнина ЛШ продовжує підтримувати циркулярний профіль протягом всього кардіального циклу, при перевантаженні ПШ тиском спостерігається лівий зсув МШП та порушенням контуру МШП протягом всього кардіального циклу з найбільшим сплощенням МШП та деформацією порожнини ЛШ в кінці систоли. У пацієнта з об‘ємним перевантаженням ПШ зсув та сплощення контуру МШП відбувається переважно в середині та наприкінці діастоли з відносним зменшенням деформації контуру порожнини ЛШ в кінці систоли [69].
Рекомендації: Візуальна оцінка кривизни МШП із пошуком дельтовидного її контуру в систолу та діастолу має використовуватися як допоміжний метод діагностики перевантаження ПШ об’ємом та/чи тиском. Хоча дельтовидна МШП не означає автоматично перевантаження ПШ, її наявність є додатковим аргументом як підтвердження наявності перевантаження ПШ, так і диференційної діагностики щодо визначення типу перевантаження, етіології та ступеня важкості перевантаження правих відділів тиском ти/чи об’ємом.
Гемодинамічна оцінка правого шлуночка та циркуляції в малому колі кровообігу
A. Систолічний тиск в легеневій артерії
СТЛА може бути визначений з використанням швидкості ТР, а ДТЛА – за допомогою кінцево-діастолічної швидкості регургітації на КЛА. Середній тиск в ЛА можна визначити по часу прискорення (АТ) систолічного потоку через КЛА, або розрахувати по значенням систолічного та діастолічного тиску.
СТПШ можна надійно розрахувати по сумі пікової швидкості потоку ТР, що визначається по спрощеному рівнянню Бернуллі, та визначеного тиску в ПП: СТПШ = 4(V)2 + тиск в ПП, де V – пікова швидкість (м/с), а тиск в ПП визначається по діаметру НПВ та його дихальним коливанням, як описано вище. При відсутності градієнту тиску на КЛА або в ВТПШ СТЛА дорівнює СТПШ (Рис. 11). У випадках підвищеного СТПШ слід виключати обструкцію ВТПШ або на рівні КЛА, особливо у пацієнтів з вродженими вадами серця або після оперативних втручань на КЛА. Спрощене рівняння Бернуллі може інколи недооцінювати градієнт між ПШ та ПП внаслідок того, що воно не приймає до уваги інерційний компонент повного рівняння Бернуллі. З тієї причини, що визначення швидкості є кут-залежним, рекомендовано оцінювати спектри ТР з декількох доступів, використовуючи для оцінки найвище з отриманих значень швидкості.
Технічно адекватні допплерівські спектри з добре визначеними межами можуть бути отримані у більшості пацієнтів. Рекомендованою розгорткою допплерівського сигналу є швидкість 100 мм/с в усіх записах. Якщо сигнал слабкий, його можно підсилити в/в введенням збовтаного фізіологічного розчину, але також важливо запобігати переоцінки спектрального «конверту», переконавшись, що вимір проводиться тільки на рівні добре визначеного щільного спектрального профілю. Це важливо у випадках як без, так і з використанням контрастних агентів (Рис. 12).
Нормальним граничним значенням для інвазивно виміряного середнього тиску в ЛА є 25 мм Hg. Підчас ЕхоКГ частіше вимірюють та вводять до заключення СТЛА. Нормальні значення швидкості або градієнту ТР в стані спокою становлять 2,9 см/с та 36 мм Hg, відповідно за умови тиску в ПП 3-5 мм Hg [75]. Це значення може зростати з віком та при збільшенні площі поверхні тіла, що треба враховувати, якщо ці значення перевищують верхню межу норми [76, 77] .
Останній консенсус експертів Американського коледжу кардіології та Американської асоціації серця рекомендує подальшу оцінку пацієнтів із задишкою при визначеному СТПШ >40 мм Hg [78]. Деякі кардіологи, що ведуть пацієнтів з вродженими вадами серця, вважають, що СТЛА вищий за дві третіх системного артеріального тиску є показником важкої ЛГ.
Визначення СТЛА по сумі пікового градієту ТР та тиску в ПП є надійною методикою з часів публікації Yock та Popp [79] у 1984, що було підтверджено в інших дослідженнях [80], але деякі додаткові дослідження поставили акуратність даного рівняння під питання, особливо при найвищих значеннях тиску в ЛА [81, 82]. У пацієнтів з дуже важкою ТР, допплерівський «конверт» спектру може зрізатися внаслідок раннього вирівнювання тисків в ПШ та ПП, внаслідок чого відбувається недооцінка градієнту по спрощеному рівнянню Бернуллі.
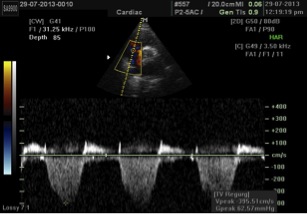
Рис. 11. Визначення СТЛА за допомогою доплерографії. Постійно-хвильовий спектр ТР відповідає градієнту тиску між ПШ та ПП. СТЛА розраховується як сума встановленого тиску в ПП та пікового градієнту між ПШ та ПП, тобто піковим градієнтом ТР, що визначається за модифікованим рівнянням Бернулі. На даному прикладі СТЛА визначається як 63 + центральний венозний тиск, або 78 мм Hg, якщо тиск в ПП дорівнює 15 мм Hg.
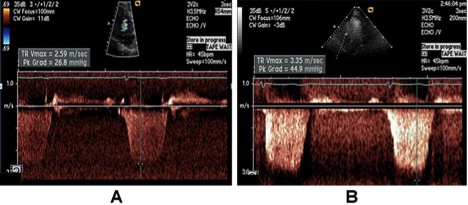
Рис. 12. A. Сигнал ТР без підсилення УЗ-контрастуванням з коректно виміряною піковою швидкістю. B. Після підсилення контрастом чіткий «конверт» спектру змішується з шумом, що призвело до хибної переоцінки пікової швидкості. Цей приклад показує, наскільки критичним є використання тільки чітко визначених меж спектру для вимірювання швидкості, тому що при розрахунку рівняння Бернуллі навіть маленька похибка возводиться в ступінь [3].
Б. Діастолічний тиск в легеневій артерії
ДТЛА може бути визначений по рівнянню суми кінцево-діастолічної швидкості регургітації на КЛА (по модифікованому рівнянню Бернуллі) та тиску в ПП: [ДТЛА = 4 (кінцево-діастолічна швидкість регургітації на КЛА)2 + тиск в ПП].
В. Середній тиск в легеневій артерії
При розрахованих систолічному та діастолічному тиску в ЛА, середній тиск в ЛА можна розрахувати за стандартною формулою: Середній тиск в ЛА = 1/3(СТЛА) + 2/3(ДТЛА). Середній тиск в ЛА також можна розрахувати, використовуючи імпульсно-хвильовий спектр систолічного потоку в ЛА по формулі: Середній тиск в ЛА = 79 – (0.45 х AT) [83]. Ті ж самі дослідники дійшли висновку, що у пацієнтів з ATs < 120 мс, для розрахунку середнього тиску в ЛА краще працює формула: Середній тиск в ЛА = 90 – (0.62 х AT) [84].
Взагалі, чим менше АТ (вимірюється з початку зубця Q синхронної реєстрації ЕКГ до пікової швидкості систолічного кровотоку), тим вище ЛСО та, відповідно таск в ЛА за умов ЧСС = 60-100 уд./хв.
Також середній тиск може бути розрахований за формулою: 4 (початкова швидкість регургітації на КЛА)2 + тиск в ПП [85].
Додатково, нещодавно був описаний метод розрахунку середнього тиску в ЛА за формулою: тиск в ПП + інтеграл лінійної швидкості (VTI) потоку ТР. Ця формула добре корелює з даними катетеризації правих відділів серця та дає значення ближчі до даних катетеризації порівняно з емпіричними методиками [86, 87]. Взагалі, коли це можливо, доцільним є використання декількох методих розрахунку середнього тиску в ЛА з метою відтворюваності та верифікації.
Рекомендації: Гемодинаміка малого кола кровообігу є доступною для дослідження різноманітними методиками у більшості суб’єктів [88]. СТЛА має бути визначений та включений до заключення у всіх пацієнтів з надійним якісним записом спектру ТР. Рекомендованим методом є визначення пікового градієнту ТР за спрощеним рівнянням Бернуллі з додаванням визначеного тиску в ПП. У пацієнтів з ЛГ або серцевою недостатність слід визначати ДТЛА або по середньому градієнту тиску ТР, або за даними регургітації на КЛА. Якщо визначений СТЛА >35-40 мм Hg, слід удаватись до більш детального дослідження ЛГ у пошуку іншої клінічної та диференційно-діагностичної інформації.
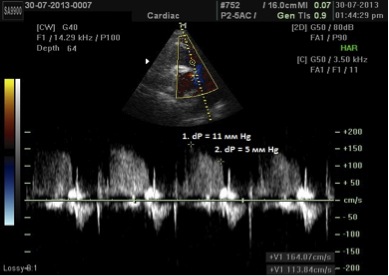
Рис. 13. Визначення ДТЛА та середнього тиску в ЛА за допомогою постійно-хвильового допплерівського спектру регургітації на КЛА (ЛР). Точка 1 визначає максимальну швидкість на початку діастоли. Середній тиск в ЛА корелює з 4 х (початкова швидкість ЛР)2 + визначений тиск в ПП. На даному прикладі 11 мм Hg + тиск в ПП. Точка 2 визначає кінцево-діастолічну швидкість ЛР. ДТЛА корелює з 4 х (кінцево-діастолічна швидкість ЛР)2 + визначений тиск в ПП. На даному прикладі 5 мм Hg + тиск в ПП.
Г. Легеневий судинний опір
Підвищення СТЛА не завжди говорить про підвищення ЛСО, як видно з відношення «Δтиску = потік х опір». ЛСО дозволяє диференціювати підвищенний тиск в малому колі внаслідок обємного його перенавантаження від такого, що виникає як прояв легеневої судинної патології. ЛСО відіграє важливу роль у пацієнтів з серцевою недостатністю з точки зору відбору їх у кандидати на трансплантацію. ЛСО може бути визначений з використанням простого співвідношення пікової швидкості ТР (м/с) до інтегралу лінійної швидкості потоку в ВТПШ (VTI, см) [89-91]. Однак, це співвідношення не є надійним у пацієнтів з дуже сильно підвищеним ЛСО, що перевищує ЛСО > 8 одиниць Вуда, визначений інвазивним гемодинамічним моніторігом [92]. Один з методів визначення ЛСО проілюстрований на Рис. 14.
В нормі інвазивно визначений ЛСО становить <1.5 одиниць Вуда (120 дін х см/с2), а визначення значної ЛГ відповідає значенню ЛСО > 3 одиниць Вуда (240 дін х см/с2), що широко використовується у клінічних дослідженнях при ЛГ.
Рекомендації: Визначення ЛСО не є адекватно відлаштованим, щоб рекомендувати його рутинне використання, але його визначення може бути розглянуте у пацієнтів, в яких систолічний тиск у малому колі кровообігу може бути перебільшеним за рахунок високого ударного об’єму, або хибно низьким (не зважаючи на підвищений ЛСО) за рахунок низького ударного об’єму. Неінвазивне визначення ЛСО не може замінювати інвазивне, коли його значення є важливим для адекватного вибору терапії.
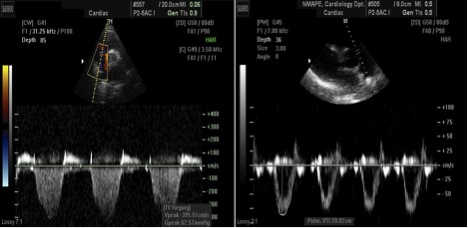
Рис. 14. Два елементи, необхідні для розрахунку неінвазивного розрахунку індексу легеневого судинного опору (ЛСО) наведені на цьому прикладі. Співвідношення пікової швидкості ТР (3,96 м/с) до інтегралу лінійної швидкості потоку (VTI) (20 cm) в ВТПШ (RVOT) дорівнює 0,20 та є патологічним (в нормі ≤0,15). Розрахунковий ЛСО при використанні формули (Vmax / VTIВТПШ) х 10 + 0,16 складає 2,14.
Д. Визначення тиску в ЛА підчас фізичного навантаження
У здорових суб’єктів фізичне навантаження призводить до збільшення ударного об’єму паралельно зниженню ЛСО. Нормальні значення СТЛП підчас фізичного навантаження становлять < 43 мм Hg [93]. У добре тренованих атлетів або у осіб >55 років на висоті навантаження СТЛА може сягати 55 – 60 мм Hg [92]. Легенева гіпертензивна відповідь може бути клінічно значущою при деяких патологічних станах, включаючи клапанну хворобу серця, серцеву недостатність [95] та ЛГ [96, 97].
З патофізіологічної точки зору на основі фундаментального рівняння потоку (F = DP/R), аномальне підвищення тиску, індуковане фізичним навантаженням, може бути віднесене до наднормального серцевого викиду (напр., у атлетів) або то нормального підвищення кровотоку, але підвищенню опору завдяки лімітованій ємності легеневого судинного поля (напр., при хронічних обструктивних захворюваннях або вроджених вадах серця). В цих умовах, відношення Δ тиску (визначеного за швидкістю ТР) до потоку (визначеного по VTI систолічного потоку в ВТПШ) може бути допоміжним у диференціації, чи підвищення тиску відбулося внаслідок збільшення кровотоку або підвищення судинного опору [98].
Рекомендації: У пацієнтів з задишкою невідомої етіології з нормальними результатами ЕхоКГ у спокої за відсутності ознак ішемічної хвороби серця варто виконати стрес-ЕхоКГ для оцінки стрес-індукованої ЛГ. Ця методика також повинна розглядатися до виконання у суб’єктів зі станами, асоційованими з ЛГ. Для визначення СТЛА методом вибору є фізичне навантаження на горизональному велоергометрі. При виконанні субмаксимального навантаження верхньою межою норми є значення СТЛА 43 мм Hg. У суб’єктів з клапанними вадами серця слід використовувати межі, наведені в рекомендаціях Американського коледжу кардіології та Американської асоціації серця.
Неволюмометрична оцінка функції правого шлуночка
Визначення систолічної функції ПШ є подібним до такої ЛШ, але більш складною. В ПШ є поверхневий циркулярний шар м’язових волокон, що відповідає за циркулярне та поперечне скорочення, та внутрішній повздовжній шар, що веде до скорочення по довгій вісі від базальних відділів до верхівки [22]. Порівняно з ЛП, повздовжнє скорочення відіграє більшу роль та робить більший внесок в ударний об'єм ПШ.
Глобальна оцінка міокардіальної функції ПШ включає індекс функції міокарда (ІФМ), dP/dt ПШ, ФВ ПШ, та ФЗП (див. вище). Оцінка регіональної міокардіальної функції включає оцінку деформації (стрейн), отриманий тканинним доплером та в В-режимі (спекл-трекінг), систолічні швидкості атріовентрикулярного кільця в режимі тканинного допплера (S’) та TAPSE. На кожен з методів впливають ті самі обмеження, що існують при оцінці лівих відділів серця. ФВ ПШ може не відображати справжню скоротливість ПШ при наявності значної ТР, так само як ФВ ЛШ обмежується мітральною регургітацією. У випадку S’ і TAPSE, регіональні швидкості чи зсув міокарду одного сегменту можуть не відображати функцію всього ПШ. Визначення регіонального стрійну має ті самі обмеження, що і в лівих відділах серця, включаючи погану відтворюваність. Існує недостатньо доказових даних по кількісній оцінці систолічної функції ПШ щодо виходів. Втім, кожен з методів описаний нижче з наведенням реферативних значень, що пропонуються даними рекомендаціями.
A. Глобальна оцінка систолічної функції ПШ
dP/dt ПШ. Швидкість наростання тиску в шлуночках (dP/dt) є інвазивним виміром, що був розроблений та валідований як показник шлуночкової скоротливості або систолічної функції. Вперше він був описаний Gleason та Braunwald [99] у 1962 р. як для лівого, так і правого шлуночків.
Хоча ПШ досліджувався набагато рідше порівняно з лівим, dP/dt ПШ також можна досить точно розрахувати по нисхідному «коліну» постійно-хвильового спектру ТР [100, 101]. dP/dt ПШ звичайно розраховується шляхом виміру часу, що потрібен, щоб швидкість ТР зросла з 1 до 2 м/с. При застосуванні спрощеного рівняння Бернуллі це відповідає зростанню градієнту тиску на 12 мм Hg. Таким чином, dP/dt розраховується як відношення 12 mm Hg до часу в секундах, з результатом з розмірністю мм Hg в секунду. Хоча найчастіше використовується час від 1 до 2 м/с, було виявлено, що найкраща кореляція з інвазивно отриманим dP/dt виходить при використанні часу зростання швидкості з 0,5 до 2 м/с [101]. В цьому випадку у чисельнику буде 15 мм Hg, відбиваючи градієнт тиску за спрощеним рівнянням Бернуллі.
Переваги: Це проста методика з ясною фізіологічною основою.
Недоліки: Існує недостатньо доказових даних як у здорових суб’єктів, так і при патологічних станах. dР/dt ПШ залежить від навантаження. dР/dt буде менш точним при важкій ТР внаслідок нівелювання інерційного компоненту повного рівняння Бернуллі та зростання тиску в ПП.
Рекомендації: Через недостатність доказових даних у здорових суб’єктів dP/dt не можна рекомендувати для рутинного використання. Його розрахунок може здійснюватися як допоміжні дані при підозрі на дисфункцію ПШ. dP/dt ПШ менше близько 400 мм Hg/с вважається патологічним.
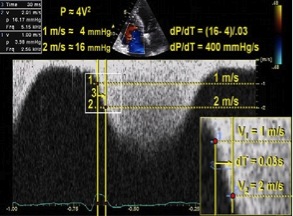
Рис. 15. Точка 1 представляє точку, в якій швидкість ТР досягає 1 м/с, точка 2 – швидкості 2 м/с. Точка три представляє час, потрібний для того, щоб швидкість ТР збільшилася з 1 до 2 м/с. На цьому прикладі цей час складає 30 мс або 0,03 сек. dP/dt, таким чином складає 12 мм Hg / 0,03 с, або 400 мм Hg/с [3].
ІФМ. ІФМ, або індекс Тея, є глобальним індексом, що оцінює як систолічну, так і діастолічну функцію шлуночків. Його розрахунок базується на взаємозв’язку між роботою серця підчас вигнання та за його межами. ІФМ розраховується як співвідношення суми ізоволюмічних періодів (розслаблення та скорочення) до часу вигнання: [(IVRT + IVCT)/ET] (Рис. 16).
Показник лишається точним в широких межах ЧСС [100], хоча компоненти мають вимірюватися в межах постійного інтервалу RR для мінімізації помилки. Хоча спочатку вважалося, що ІФМ є відносно незалежним від переднавантаження, дані останніх досліджень поставили цю тезу під питання. Крім того, було продемонстровано, що ІФМ не є надійним при підвищенному тиску в ПП (напр., інфаркт міокарду ПШ), коли вирівнювання тисків між ПШ та ПП відбувається швидше, скорочуючи IVRT, що веде до неприйнятно низького ІФМ [103].
ІФМ ПШ можна розрахувати по даним двох методів: імпульсно-хвильового та тканинного доплера. При використанні імпульсно-хвильового допплера ЕТ вимірюється імпульсним доплером в ВТПШ (час від початку до припинення систолічного кровотоку), а час перед відкриттям та після закриття ТК вимірюється або пульсовим доплером підчас діастолічного потоку через ТК (час від закінчення хвилі А до початку наступної хвилі Е), або постійним доплером потоку ТР (час від початку до закінчення спектру потоку). Ці виміри отримують з різних зрізів, тому треба намагатися використовувати кардіальні цикли з подібними інтервалами RR для отримання точнішого значення ІФМ ПШ.
При використанні тканинного доплера, всі часові інтервали вимірюються в межах одного кардіального циклу з спектрів руху трикуспідального кільця (див. нижче). Як було продемонстровано для ІФМ ЛШ [104, 105], кореляція між цими двома методами є досить невисокою, тому нормальні значення для цих двох методів відрізняються.
ІФМ має прогностичне значення у пацієнтів з ЛГ [102], а його зміни в цій групі пацієнтів корелюють із змінами в клінічному статусі [106]. Крім того, опубліковані роботи, що досліджували ІФМ ПШ при інфаркті міокарду ПШ, гіпертрофічній кардіоміопатії та вроджених вадах серця [107-112].
У здорових суб’єктів та в здорових контрольних групах ІФМ ПШ визначався в 23 дослідженнях у >1000 субєктів. Верхня межа норми ІФМ ПШ становить 0,40 для імпульсно-хвильового методу, та 0,55 для тканинного доплер (Таб. 4).
Переваги: Цей показник є доступним для визначення у переважної більшості пацієнтів з та без ТР. ІФМ є відтворюваним та допомагає запобігти геометричних припущень та обмежень внаслідок складної геометрії ПШ. Тканинний допплер дозволяє розрахунок ІФМ, як і S’, E’, та A’ в межах одного кардіального циклу з єдиного доступу.
Недоліки: ІФМ є ненадійним, коли ЕТПШ та час ТР отримуються з різних циклів з різними інтервалами RR, та при фібриляції передсердь. Крім того, ІФМ ПШ є більш залежним від переднавантаження та ненадійним при підвищенні тиску в ПП.
Рекомендації: ІФМ може використовуватися для початкових та серійних вимірів для оцінки функції ПШ в комплексі з іншими кількісними та некількісними методами. MPI may be used for initial and serial measurements as an estimate of RV function in complement with other quantitative and nonquantitative measures. Верхня межа норми ІФМ ПШ становить 0,40 для імпульсно-хвильового методу, та 0,55 для тканинного доплер. Не слід використовувати ІФМ ПШ як єдиний кількісний метод оцінки міокардіальної функції ПШ, а також у випадку аритмії.
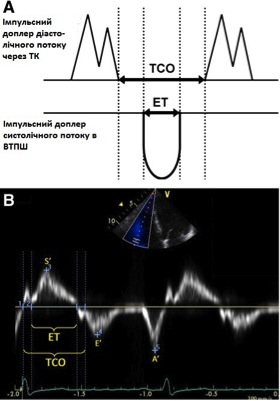
Рис. 16. Розрахунок індексу функції міокарда (ІФМ) ПШ за допомогою імпульсно-хвильового (А) та тканинного доплера (В). of right ventricular myocardial performance index (MPI) by pulsed Doppler (A) and pulsed tissue Doppler (B). Час закриття ТК (TCO) включає в себе час ізоволюмічного скорочення, час вигнання (ET), та час ізоволюмічної релаксації ПШ. При використанні імпульсно-хвильового доплера ТСО також можна виміряти по тривалості ТР в постійно-хвильовому доплері. ІФМ = (TCO – ET) / ET. Відмітьте, що на цьому самому зображенні тканинного доплерівського спектру також виміряні S’, E’, та A’ [3].
Б. Регіональна оцінка систолічної функції ПШ
TAPSE або рух трикуспідального кільця (TAM). Систолічний рух основи вільної стінки ПШ забезпечує один з найкраще візуалізуємих рухів підчас ЕхоКГ. TAPSE або TAM є методикою виміру дистанції (амплітуди) систолічної екскурсії сегменту трикуспідального кільця по повздовжній вісі зі стандартної апікальної 4-камерної позиції. TAPSE або TAM відображує повздовзню функцію ПШ так само, як систолічна екскурсія мітрального кільця – лівого. Чим більше амплітуда руху трикуспідального кільця в систолу, тим краща систолічна функція ПШ. Як і з іншими регіональними методиками, робиться припущення, що зсув базального та сусідніх сегментів в апікальній 4-камерній позиції відображує функцію всього ПШ, що не є дійсним при багатьох патологічних станах або за наявності сегментарних порушень скоротливості ПШ. TAPSE оцінюють, встановлюючи курсор М-режиму через трикуспідальне кільце та вимірюючи повздовжню амплітуду трикуспідального кільця від кінця діастоли до піку систоли (Рис. 17).
В першому початковому дослідженні Kaul та співав. [113] TAPSE високо корелювало з даними радіонуклідної ангіографії з низькою варіабельністю між різними операторами. Також була виявлена кореляція з ФВ ПШ за Симпсоном та ФЗП ПШ [114, 115].
В дослідженні 750 пацієнтів з різними кардіальними нозологіями у порівнянні з групою контролю з 150 співставимих за віком здорових суб’єктів, нижня межа TAPSE <17 мм показала високу чутливість, але низьку специфічність у виявленні патології [116]. Загалом проведено більше 40 досліджень, у яких брало участь >2000 здорових суб’єктів, в яких досліджували використання TAPSE або TAM (Таб. 4).
Переваги: TAPSE є простою, менш залежною від оптимальної якості зображення та відтворюваною методикою, та не потребує складного обладнання або пролонгованого аналізу зображення.
Недоліки: TAPSE припускає, що зсув одного сегменту відбиває загальну функцію складної трьохвимірної структури. Крім того, цей показник є кут-залежним, при чому великих когортних досліджень з його валідації не проводилося. Нарешті, TAPSE може залежити від умов навантаження.
Рекомендації: TAPSE слід використовувати рутинно як простий метод оцінки функції ПШ з нижньою межею норми 16 мм.
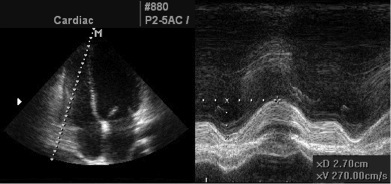
Рис. 17. Вимірювання систолічної екскурсії трикуспідального кільця (TAPSE).
Тканинна допплерографія. Трикуспідальне кільце та базальний сегмент вільної стінки є одними з найкраще візуалізуємих та відтворюваних областей ПШ. Ці сегменти можуть бути оцінені за допомогою імпульсно-хвильової доплерографії та кольорового картування тканин для визначення повздовжньої швидкості скорочення. Ця швидкість називається S’ПШ або швидкість систолічної екскурсії. Для виконання цього виміру використовується апікальна 4-камерна позиція із встановлення пробного об’єму тканинного допплера в область, що цікавить. Пробний об'єм встановлюють або на трикуспідальне кільце, або посередині базального сегменту вільної стінки ПШ (Рис. 18). Зважаючи на те, що це імпульсно-хвильова методика, слід ретельно виконувати кутову корекцію для запобігання недооцінки швидкостей. Як альтернатива може бути використаний запис кольорового картування руху тканин з високою частотою зміни кадрів з наступним аналізом сегментів, що оцінюються. Спеціальне програмне забезпечення розраховує при цьому швидкості, що генеруються протягом кардіального циклу.
Швидкість S’ – це найвища систолічна швидкість руху трикуспідального кільця. Оцінка швидкостей серединного та апікального сегменту вільної стінки ПШ не є рекомендованою внаслідок того, що часто важко отримати адекватний сигнал [117] з високою варіабельністю сигналів. Також не варто використовувати швидкість септального сегменту, оскільки МШП відбиває функцію обох шлуночків.
Було проведено декілька валідаційних досліджень, що порівнювали швидкості трикуспідального кільця за даними імпульсно-хвильової тканинної доплерографії з результатами радіонуклідної ангіографії, які показали високу кореляцію та добру розрізнювальну здатність тканинного доплера у диференціації нормальної та зниженої ФВ ПШ. Щодо S’, його досліджували в одному з небагатьох валідаційних досліджень ПВ. В загальному популяційному дослідженні серця в Умеа, Швеція регіональна функція ПШ була оцінена у 235 здорових суб’єктів віком від 20 до 90 років [117]. Середні значення у здорової людини становили близько 15 см/с для трикуспідального кільця та базального сегменту вільної стінки ПШ, з більш низькими значеннями для серединного та апікального сегментів.
Мета-аналіз 43 досліджень з >2000 здорових суб’єктів надав дещо нижчу верхню нормальну межу – 10 см/с. Кольорове картування тканин дає нижчі значення, тому що кодовані дані представляють середні швидкості. Дослідження з кольорового допплерівського картування тканин виконувалися у здорових волонтерів та в групах контролю у здорових суб’єктів. Середні анулярні швидкості в середньому складали 8,5-10 см/с, у той час як швидкості базального сегменту вільної стінки були дещо вищі та становили 9,3-11 см/с. Два дослідження продемонстрували дещо нижчі швидкості в групах похилого та літнього віку [118, 119].
Швидкості серединного та апікального сегментів було важче отримати з більшою варіабельністю. Референтна нижня межа норми за даними доступних досліджень складає 6 см/с з довірчим інтервалом дещо ширшим за 95% (Table 4).
Переваги: Імпульсно-хвильова доплерографія – проста відтворювана методика з доброю знатністью діференціації нормальної чи зниженої міокардіальної функції ПШ, що є доступною на всьому сучасному ультра хвильовому обладнанні та не потребує додаткового складного програмного забезпечення. Крім того, на деяких програмних платформах існує можливість оцінки S’ за даними кольорового картування тканин в режимі оф-лайн.
Недоліки: Ця методика є менш відтворюваною в небазальних сегментах та є кут-залежною. Нормативна база даних в усіх вікових групах в обох статей є обмеженою. Крім того, методика робить припущення, що функція одного сегменту відбиває функцію всього шлуночка, що не працює в патологічних умовах, при яких є регіональні порушення, наприклад, інфаркт ПШ чи тромбоемболія малого кола кровообігу.
Рекомендації: Досліження систолічних швидкостей S’ за даними імпульсно-хвильової доплерографії є простою та відтворюваною методикою оцінки міокардіальної функції базальної частини вільної стінки ПШ, та має використовуватися рутинно. S’<10 см/с є підставою до підозри на порушення міокардіальної функції ПШ, особливо у дорослих пацієнтів молодшого віку. Кількість даних щодо пацієнтів похилого та літнього віку є недостатньою. Аналіз кольорового картування тканин в режимі оф-лайн залишається інструментом наукових досліджень з-за малої кількості накопичених даних з широким довірчим інтервалом нормальних значень.
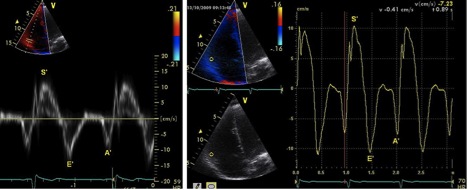
Рис. 18. Тканинна доплерографія трикуспідального кільця у суб’єкта з нормальною систолічною функцією ПШ: імпульсно-хвилова зліва та аналіз швидкостей в режимі оф-лайн при кольоровому кодуванні.
Міокардіальне прискорення підчас ізоволюмічного скорочення
Прискорення міокарду підчас ізоволюмічного скорочення (IVA) визначається, як відношення пікової ізоволюмічної швидкості до часу від початку скорочення до пікової швидкості, и типово вимірюється для ПШ за допомогою тканинної доплерографії на латеральному сегменті трикуспідального кільця (Рис. 19). При розрахунку IVA під початком міокардіального прискорення розуміють нульову точку перехресту підчас ізоволюмічного скорочення. Є дані, що IVA є менш залежним від навантаження порівнянно з показниками періоду вигнання в багатьої фізіологічних ситуаціях [120-123].
В серіях досліджень кардіологічних пацієнтів під анестезією IVA ПШ був одним з найбільш постійних та відтворюваних тканинних допплерівських показників міокардіальної функції ПШ підчас трансторакальної (латеральна стінка) або черехстравохідної (нижня стінка) ЕхоКГ [124]. Було показано, що IVA ПШ корелювало з ступенем важкості захворювань, що уражують функцію правих відділів серця, включаючи обструктивне нічне апное [125], мітральний стеноз [126, 127], стан після хірургічної корекції тетроди Фало з недостатністю КЛА [128], транспозицію магістральних артерій після хірургічного перешивання передсердь [129].
Нормальні значення IVA ПШ були отримані з досліджень, що включали контрольні групи здорових дорослих або дітей. Цей показник є залежним від віку з найвищими нормальними значеннями у віці 10-20 років [130].
Як і при всіх тканинних допплерівських методикам, для документації показника дуже важлива техніка отримання. Значення показника за даними імпульсно-хвильового доплера звичайно на 20% вищі за значення за даними кольорового картування тканин [118]. Крім того, було показано, що IVA ПШ може варіювати залежно від ЧСС [123], тому в деяких клінічних ситуаціях доцільною може бути індексація значення показника до ЧСС. Нижня межа норми для імпульсно-хвильового тканинного допплера складає за даними 10 досліджень 2,2 м/с2 з широким 95% довірчим інтервалом від 1,4 до 3,0 (Таб. 4).
Переваги: IVA ПШ є відносно незалежним від навантаження показником глобальної систолічної функції ПШ, що корелює зі ступенем важкості патологічних станів, що впливають на функцію правих відділів серця.
Недоліки: Доступна нормативна база є лімітованою. IVA ПШ є кут-залежним допплерівським виміром, що варіює залежно від віку та ЧСС.
Рекомендації: При дослідженні пацієнтів з патологічними станами, що уражують функцію ПШ може використовуватись IVA ПШ. При його використанні дані слід отримувати з латерального сегменту трикуспідального кільця. IVA ПШ не є рекомендованим скрінінговим параметром в загальній популяції досліджуваних в ехокардіографічних кабінетах. Внаслідок широкого довірчого інтервалу його нижньої нормальної межі, реферативне значення поки що не може бути рекомендованим.
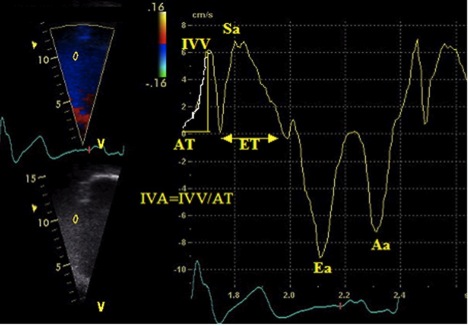
Рис. 19. Швидкості латерального сегменту трикуспідального кільця та часових інтервалів, отримані за допомогою тканинної доплерографії. Aa - пікова швидкість підчас систоли передсердь; ET – час вигнання; IVA –прискорення міокарду підчас ізоволюмічного скорочення; IVV – пікова швидкість підчас ізоволюмічного скорочення; Sa – пікова швидкість підчас систолічного періоду вигнання [182].
Регіональна деформація та швидкість деформації ПШ (Strain та Strain Rate)
Деформація (Strain) визначається як процент зміни деформації міокарда, у той час як її похідне, швидкість деформації (strain rate), відбиває швидкість деформації в часі. Strain rate добре корелював із скоротливістю міокарда в експериментальних моделях in vitro та in vivo [131]. Одновимірний strain отримують, використовуючи тканинний доплер, відповідно, він теж є кут-залежним. Strain є найбільш відтворюваним в апікальній 4-камерній позиції, де можна оцінити рух базального, середенного та, в меншому ступені, апікального сегментів вільної стінки ПШ. В дослідженнях strain та strain rate використовувались різни алгоритми, що намагалися подолати певні проблеми, пов’язані з поганим сигналом та ультразвуковими шумами з використанням різних протоколів. В результаті, виявилося, що отримані результати можуть відрізнятися в залежності від апаратів різних виробників, що ще більше ускладнило ситуацію з відтворюваністю.
Розрахунки strain вимагають високої частоти зміни кадрів, в ідеалі ≥150 кадрів/с. Тому бажано, щоб сектор сканування з фокусом на вільній стінці ПШ був максимально вузьким. Слід ретельно виставляти маркери досліджуваних сегментів з тим, щоб запобігти помилки завдяки залежності від кута між променем та напрямом руху стінки. Рекомендовано, щоб кут між напрямком руху стінки та променем становив не більше 10-15 градусів [132].При цьому зображення отримують в режимі кольорового картування тканин із записом ≥3 послідовних циклів підчас затримки дихання. Значення для strain та strain rate отримують в режимі оф-лайн на апараті або на комп’ютрі, використовуючи специфічної для кожної конкретної системи алгоритми розміщення пробних об’ємів різних розмірів посередині досліджуваних сегментів.
Значення strain і strain rate досліджувалися при різних патологічних станах, що уражують праві відділи серця, включаючи аритмогенну дисплазію ПШ [133], ТЕЛА [134], ЛГ [135], системний правий шлуночок [136], та амілоїдоз [137-139].
Нормативна база для деформації міокарду та її швидкості в ПШ є обмеженою, а більшість значень у здорових суб’єктів представлені за даними з малих груп пацієнтів з контрольних груп у дослідженнях з вивчення патології. Значення для базального, серединного та апікального сегментів вільної стінки ПШ представлені в Таб. 5.
Дані мета-аналізів дають результати з дуже великими стандартними відхиленнями середніх значень. Тому нижні межі норми на основі 95% довідчого інтервалу навряд чи можуть бути клінічно корисними.
Переваги: Регіональний strain представляють потенційно корисний засіб оцінки скоротливості міокарду, що є менш залежним від навантаження та може застосовуватися при широку спектрі патологічних станів.
Недоліки: Нормативна база є недостатньою. Крім того, ці виміри є кут-залежними з низким співвідношенням сигнал / шум. До того ж це складний вимір з високим ступенем варіабельності, що потребує додаткового програмного забезпечення та аналізу в режимі оф-лайн.
Рекомендації: Перераховані вище серьозні недоліки обмежують клінічне використання регіонального стрійну ПШ. Референтні значення рекомендувати не можна внаслідок дуже широких довірчих інтервалів як для середніх значень, так і референтних меж. До сьогодні strain та strain rate лишаються засобами для наукових досліджень в експертних ехо-лабораторіях до того часу, як можна буде подолати описані вище обмеження.
Двохвимірний (2D-) стрейн. Також можливим є визначення strain’у в В-режимы, що призвело до розвитку двохвимірного стрійну. Ця нова методика регіональної та глобальної скоротливості використовує по кадрове відстеження унікальних окремих відблисків міокарду за алгоритмом, що дозволяє відстеження положення відблисків на послідовних зображення з використанням критеріїв кореляції та сумації абсолютних відмінностей. Програмне забезпечення апарату використовує цей принцип для векторного аналізу швидкостей руху міокарду. Окрім генерації кривих деформації окремих сегментів, існують алгоритми, що розраховують середній стрейн всієї камери.
Значною перевагою методики визначення деформації в В-режимі є те, що вана не є кут-залежною, хоча правильне визначення зон зацікавленості (пробних об’ємів) лишається важливим. Двохвимірний стрейн був досліджений та оцінений на прикладі ЛШ, та вже нещодавно були опубліковані роботи по оцінці функції ПШ при системному ПШ та у пацієнтів при ЛГ [136].
Переваги: Ця методика є відносно кут-незалежною та має краще співвідношення сигнал / шум. Також вона може оцінювати як регіональну, так і «глобальну» функцію.
Недоліки: Існує недостатньо нормативної бази щодо методики, що також потребує додаткової валідації. Методика потребує додаткового програмного забезпечення, а її результати значно залежать від якості зображення. «Глобальна» оцінка деформації розраховується по тільки одному зрізу, так що насправді не може відбивати глобальну функцію ПШ. Крім того, різні алгоритми оцінки на різних програмних платформах можуть призводити до різних результатів нормальних значень.
Рекомендації: Внаслідок відсутності доведеної відтворюваності та недостатньої кількості доказових даних ця методика поки що не може бути рекомендованою для рутинного клінічного використання. Нормативних даних поки що рекомендувати не можна внаслідок високого ступеня варіабельності.
Таб. 5.
Повздовжні strain та strain rate.
|
Показник
|
Дослідження
|
n
|
НМН
(95% СІ)
|
ВМН
(95% СІ)
|
|
2D
|
|
Піковий strain rate базального сегменту (с-1)
|
1
|
61
|
0,70 (0,50-0,90)
|
2,54 (2,34-2,74)
|
|
Піковий strain rate серединного сегменту (с-1)
|
2
|
80
|
0,85 (0,66-1,04)
|
2,23 (2,04-2,42)
|
|
Піковий strain rate апікального сегменту (с-1)
|
2
|
80
|
0,86 (0,46-1,25)
|
2,39 (1,99-2,78)
|
|
Піковий strain базального сегменту (%)
|
5
|
183
|
18 (14-22)
|
39 (35-43)
|
|
Піковий strain серединного сегменту (%)
|
4
|
125
|
20 (15-24)
|
38 (34-43)
|
|
Піковий strain апікального сегменту (%)
|
4
|
145
|
19 (15-22)
|
39 (36-43)
|
|
Тканинна доплерографія
|
|
Піковий strain rate базального сегменту (с-1)
|
7
|
261
|
1,00 (0,63-1,38)
|
2,66 (2,28-3,03)
|
|
Піковий strain rate серединного сегменту (с-1)
|
5
|
187
|
0,98 (0,60-1,28)
|
2,79 (2,49-3,48)
|
|
Піковий strain rate апікального сегменту (с-1)
|
5
|
204
|
1,14 (0,60-1,69)
|
2,93 (34-56)
|
|
Піковий strain базального сегменту (%)
|
7
|
290
|
17 (12-21)
|
44 (39-48)
|
|
Піковий strain серединного сегменту (%)
|
11
|
385
|
13 (9-17)
|
45 (41-49)
|
|
Піковий strain апікального сегменту (%)
|
7
|
269
|
13 (9-18)
|
48 (44-52)
|
* СІ – довірчий інтервал; НМН – нижня межа норми; ВНМ – верхня межа норми.
Підсумок рекомендацій з оцінки систолічної функції правого шлуночка
Візуальна оцінка систолічної функції ПШ надає виконавцю можливість початкової якісної оцінки систолічної функції ПШ, яка є недостатньою в сьогоднішню еру стандартизації. Існує декілька простих та відтворюваних методик оцінки систолічної функції ПШ, що мають бути впровадженими до рутинного ехокардіографічного дослідження. До них віносяться ФЗП, TAPSE, швидкість S’ за даними тканинного допплера та ІФМ ПШ. Комбінація використання декількох показників, наприклад, S’ та MPI, допомогає у надійнішій диференціації норми та патології [115].
Наполегливо рекомендується, щоб хоча б один з цих кількісних показників був впроваджений в рутинне ехокардіографічне дослідження та заключення, що особливо важливо, коли йдеться про підозри на міокардіальну дисфункцію, та / або коли показання до ЕхоКГ стосуються станів, що пожуть поразити ПШ. Більш складні методики, такі як IVA, strain, та strain rate сьогодні не є рекомендованими для рутинного використання, що їх залишити для специфічних клінічних та дослідницьких цілей у досвічених ЕхоКГ-лабораторіях.
Діастолічна функція правого шлуночка
A. Діастолічна дисфункція
Правий шлуночок – це більше, ніж пасивна камера. Гостре ушкодження ПШ, переважно у контексті інфаркту ПШ, призводить до вираженої діастолічної дисфункції з підвищенням тиску наповнення з клінічно очевидним розширенням яремних вен [140-142]. Патофізіологія діастолічної дисфункції ПШ є досить складною [143-147]. З діастолічної дисфункцією ПШ сьогодні асоціюється досить велика кількість гострих та хронічних станів, включаючи ситуаціє перевантаження як тиском, так і об’ємом: легенева патологія, ішемічна хвороба серця, вроджені вади серця, кардіоміопатії, дисфункції ЛШ (за рахунок взаємозалежності між шлуночками), системні захворювання та фізіологічне старіння (Таб. 7).
Б. Показники діастолічної функції ПШ
В апікальній 4-камерній позиції курсор допплерівського променя виставляється паралельно кровотоку діастолічного наповнення ПШ. Правильне положення може бути скориговане зміщенням датчика медіальніше у напрямку нижньої парастернальної області.
Пробний об'єм має бути встановлений на рівні кінчиків стулок трикуспідального клапану [143].
За цією методикою швидкості транстрикуспідального кровотоку можуть бути визначені у більшості пацієнтів з високим ступенем відтворюваності та низькою варіабельністю значень [148]. Виміри слід проводити наприкінці видоху та/або з отриманням середнього арифметичного значення з ≥5 послідовних кардіальних циклів [149].
Наявність помірної чи важкої ТР або фібриляції передсердь значно впливає на параметри діастолічного кровотоку через ТК, тому в більшості досліджень ці пациенти виключалися. Визначення тиску в ПП по діаметру НПВ та ступеню її інспіраторного колапса, як описано вище, слід включати в оцінку діастолічної функції ПШ. Параметри, що використовують для оцінки діастолічної функції ПШ приблизно ті ж самі, що використовуються в лівих відділах. Найбільш широко описаними та валідованими є швидкості транстрикуспідального кровотоку (E, A, та E/A), швидкості руху трикуспідального кільця за даними тканинного доплера (E’, A’, E’/A’), час сповільнення раннього діастолічного потоку, та IVRT (Таб. 6). Співвідношення E/E’, площа або об'єм ПП та діастолічний strain rate виявляються багатообіцяючими та привертають велику увагу в останніх дослідженнях.
Крім того, наявність пізнього діастолічного атероградного потоку в ЛА (визначається за допомогою імпульсно-хвильового доплера з пробним об’ємом, розміщеним посередені між стулками КЛА та біфуркацією ЛА) є додатковою ознакою рестриктивного наповнення ПШ [150]. Ця ознака, переважно описана у пацієнтів після оперативного лікування тетроди Фалло, зявляється, коли підвищення кінцево-діастолічного тиску в ПШ викликає дострокове відкриття КЛА та передачу хвилі А підчас систоли передсердь в ЛА.
Таб. 6.
Діастолічна функція ПШ.
|
Показник
|
Дослідження
|
n
|
НМН
(95% СІ)
|
ВМН
(95% СІ)
|
|
Е (см/с)
|
55
|
2866
|
35 (33-37)
|
73 (71-75)
|
|
А (см/с)
|
55
|
3096
|
21 (19-24)
|
58 (55-60)
|
|
Співвідношення Е/А*
|
56
|
2994
|
0,8 (0,7-0,9)
|
2,1 (2,0-2,2)
|
|
Час сповільнення раннього діастолічного потоку DT (мс)
|
25
|
1284
|
120 (105-134)
|
229 (214-243)
|
|
IVRT (мс)
|
23
|
1241
|
23 (16-30)
|
73 (66-80)
|
|
Е’ (см/с)
|
40
|
1688
|
8 (7-9)
|
20 (19-21)
|
|
А’ (см/с)
|
37
|
1575
|
7 (6-8)
|
20 (19-21)
|
|
Співвідношення Е’/A’
|
29
|
1053
|
0,5 (0,4-0,6)
|
1,9 (1,7-2,0)
|
|
Співвідношення Е/Е’
|
3
|
359
|
2 (1-2)
|
6 (5-7)
|
*СІ – довірчий інтервал; IVRT – час ізоволюмічного розслаблення; НМН – нижня межа норми; ВМН – верхня межа норми.
*Вік-залежний параметр: середнє значення Е/А=1,6 на третьому десятку життя із зниженням на 0,1 кожні наступні 10 років.
Таб. 7.
Стани, асоційовані з діастолічної дисфункцією ПШ.
|
Стан
|
-
Емболії малого кола кровообігу
|
-
Легенева артеріальна гіпертензія
|
|
|
-
Хронічні обструктивні захворювання легенів
|
|
|
|
|
-
Інфаркт міокарда чи хронічна ішемія ПШ (атеросклеротичне ураження проксимального відділу правої коронарної артерії
|
-
Стан після хірургічної корекції Фалло
|
-
Стан після хірургічної корекції транспозиції магістральних артерій
|
-
Хронічна серцева недостатність
|
-
Стан після кардіотрансплантації
|
-
Аритмогенна правошлуночкова кардіоміопатія
|
-
Гіпертрофічна кардіоміопатія
|
|
|
|
|
|
|
|
|
|
|
-
Інфаркт міокарда в басейні передньої нисхідної гілки лівої коронарної артерії
|
|
|
|
|
|
|
|
|
|
|
-
Антифосфоліпідний синдром
|
|
|
|
|
-
Стан після нефротрансплантації
|
-
Гепатопульмонарний синдром
|
|
|
|
|
В. Вплив віку, фаз дихання, ЧСС та умов навантаження
Більшість досліджень показали, що є доволі скромна кореляція studies have shown that there is amodest correlation (r ~ 0.30) між співвідношенням Е/А та збільшенням віку пацієнта. Співвідношення Е/А з віком знижується приблизно на значення 0,1 кожні 10 років [119, 143, 151, 152]. Вдох викликає збільшення швидкостей хвилі Е та, відповідно, транстрикуспідального співвідношення Е/А.
Тахікардія призводить до збільшення швидкості хвилі Е, але й ще відносно більше – хвилі А, що веде до зниження співвідношення Е/А [143, 152, 153]. При порівнянні допплерівських параметрів між пацієнтами або у того самого пацієнта в динаміці, слід пам’ятати про вплив вище описаних фізіологічних впливів на гемодинамічні параметри. Внаслідок тонкої стінки, ПШ є дуже чутливим до пост навантаження (стінкове напруження), особливо при патології міокарда ПШ, наприклад його ішемії чи інфаркті [146, 153, 154].
ПШ також чутливий до зміни переднавантаження, а саме зниження переднавантаження призводить до зниження швидкості хвилі Е, але до відносно меншого ступеня зменшення швидкості хвилі А, що призводить до зниження співвідношення Е/А [156-158]. Тканинна доплерографія менше залежить від навантаження, тому що зниження переднавантаження призводить до рівного співставимого зниження швидкостей E’ та A’, тому співвідношення E’/A’ не змінюється. Важливо пам’ятати, що тканинна доплерографія має використовуватись для диференційної діагностики нормального та псевдонормального наповнення ПШ при підвищеному тиску наповнення разом з профілем кровотоку в печінкових венах та діаметром та інспіраторним колапсом НПВ [17].
Фізіологічною відповіддю на фізичне навантаження є збільшення як раннього швидкого наповнення Е, так і передсердного А. У пацієнтів з ішемією правих відділів патофізіологічна відповідь полягає у зниженні раннього швидкого наповнення та зростанні відсотка пересердного вкладу с залежністю від систоли передсердь та послідовному зростанні тиску в ПП [159].
Г. Клінічні паралелі
Дуже мало досліджень вивчали клінічні впливи діастолічної дисфункції ПШ. Було показано, що трикуспідальне співвідношення E/E’ та об'єм ПП добре корелювали з інвазивними гемодинамічними параметрами. Співвідношення E/E’ ≥4 має високу чутливість та специфічність щодо визначення тиску в ПП ≥10 мм Hg у пацієнтів в відділенні інтенсивної терапії [160], в той час як значення E/E’ >8 має високу чутливість та специфічність щодо визначення тиску в ПП >10 мм Hg у пацієнтів після трансплантації серця [161]. У пацієнтів з хронічною серцевою недостатністю та ЛГ наявність діастолічної дисфункції ПШ асоціювалася з гіршим функціональним класом та була незалежним пре диктором смертності [102, 162].
Діастолічні профілі наповнення відбивають відповідь на терапію, покращуючись при вдалому лікуванні при багатьох кардіальних патологічних станах [163-166].
Крім того, визначення діастолічної дисфункції ПШ може бути клінічно корисною, тому що вона служить раннім та найбільш легко визначеним маркером субклінічної міокардіальної дисфункції ПШ. Багато досліджень показали, що діастолічна дисфункції ПШ виникає набагато раніше маніфестної систолічної дисфункції ПШ, та раніше його дилатації чи гіпертрофії.
Рекомендації: Визначення діастолічної функції ПШ слід розглядати у пацієнтів з підозрою на міокардіальну дисфункцію ПШ, як марке ранньої субклінічної дисфункції, або у пацієнтів з відомим порушенням або ушкодженням ПШ, як маркер поганого прогнозу. Перевага віддається найбільш валідованим показникам: трикуспідальним співвідношенням E/A та E/E’, та розміру ПП (Таб. 6). Градація діастолічної дисфункції ПШ виглядає наступним чином: Е/А <0,8 говорить про порушення релаксації ПШ; Е/А =0,8 – 2,1 при E/E’ > 6 або переважання діастолічного потоку в печінкових венах говорить про псевдо нормальне наповнення, а E/A > 2,1 при часі сповільнення ранньо-діастолічного потоку < 120 мс говорить про рестриктивне наповнення ПШ (так як і допоміжний маркер – пізній діастолічний антероградний потік в ЛА).
Для валідації чутливості та специфічності та визначення прогностичного значення цієї класифікації потрібні подальші дослідження.
Клінічне та прогностичне значення оцінки правого шлуночка
Кількісна оцінка розмірів та функції ПШ виявилась клінічно важливою при декількох серцевих та легеневих захворюваннях. Багато публікацій демонструють прогностичне значення функції ПШ.
Нормальний ПШ пристосований до низького легеневого судинного опору, внаслідок чого має відносно податливу тонку стінку. Умови гострого підвищення ЛСО, такі як емболізація малого кола кровообігу, призводить до збільшення розмірів ПШ ще до підвищення тиску в малому колі, що може призвести до гіпертрофії ПШ [167].
Таким чином, дилатація ПШ є першим маркером збільшення ЛСО. По мірі розвитку гіпертрофії ПШ для подолання збільшеного ЛСО, розміри ПШ за даними його вимірюваних діаметрів чи об’ємів, може зменшитись, у той час як товщина стінки зросте пропорційно зростанню СТПШ.
У пацієнтів з гострою емболією ЛА початкове збільшення об’єму та розмірів ПШ часто супроводжується аномальним профілем регіональних рухів стінки, при якому серединний сегмент вільної стінки ПШ стає дискінетичним при відносному збереженні нормальної скоротливості базальних та апікальних сегментів [168]. Ці знахідки мають важливе прогностичне значення у пацієнтів з емболією ЛА [169], та є цілком зворотніми при покращенні легеневої гемодинаміки [38]. У пацієнтів з хронічним судинним ураженням малокого кола кровообігу або іншими формами вторинної ЛГ (включаючи хронічні обструктивні захворювання легенів, емфізему або інші форми ураження легеневої паренхими) ПШ на початку має тенденцію до гіпертрофії з нормальними об’ємами, але згодом розвивається та прогресує його дилатація [170].
Також на розмір та функцію ПШ можуть негативно впливати захворювання, первинно уражуючи лівий шлуночок. Паціенти з постінфарктною дисфункцією ЛШ та серцевою недостатністю мають підвищений ризик дилатації та дисфункції ПШ [171-173]. Дисфункція ПШ є одним з найпотужніших незалежних предикторів несприятливого прогнозу після гострого інфаркту міокарда навіть за відсутності явного інфаркту ПШ [39, 40]. Подібні знахіднки були виявлені також у пацієнтів з хронічною серцевою недостатністю та у стабільних пацієнтів, що прожили один рік після інфаркту [175].
Дані Дослідження з оцінки застійної серцевої недостатності та ефективності катетеризації легеневої артерії (ESCAPE) дозволяють припустити, що зростання тиску в ЛА може прямо впливати на розміри та функцію ПШ у пацієнтів з серцевою недостатністю [176]. Крім того, синдром ночного апное у пацієнтів с серцевою недостатністю також може потенціювати дилатацію та дисфункцію ПШ [177]. Ці дані говорять про те, що клінічна оцінка ПШ може значно додати інформації до стандартної ехокардіографічної оцінки пацієнтів з первинним ураженням лівих відділів серця.
Також на розмір та функцію ПШ може серйозно впливати ураження ТК із гемодинамічно значущою ТР. До таких відносяться карциноїд серця [178, 179], при якому відбувається рефракція та функціональна некомпетентність стулок ТК; ревматичне ураження ТК [180]; міксоматозна дегенерація ТК; або будь-яка ситуація, при якій виникає значуща недостатність ТК. При цьому виникає перенавантаження об’ємом, що веде дилатації ПШ, що далі ще більше поглиблює ТР в рамках патологічного кола.
Найбільш частою вродженою вадою, що впливає на роміри і функцію ПШ у дорослих є дефект міжпередсердної перегородки. Шунтування зліва направо з перевантаженням об’ємом може вести до збільшення тиску в ЛА та дилатації ПШ. Також зростає популяція пацієнтів, що пережили хірургічну корекцію тетроди Фалло з важкою легеневою регургітацією з важкою дилатацією та порушенням функції ПШ. Інші вроджені вади серця, такі як аномалія Ебштейна та більш складні вроджені вади також можуть впливати на розмір та функцію ПШ. Ситуації, при яких морфологія ПШ виглядає особливо незвичайною завжди слід підозрювати складну вроджену ваду серця.
Заключення
Ехокардіографічна оцінка ПШ раніше була переважно якісною, в першу чергу через складність оцінки об’ємів ПШ внаслідок його неправильної форми [181, 182]. Тому досі існує мінімальна база кількісних даних щодо розмірів та функції ПШ у здорових суб’єктів та при патології. Поступовий зсув до більш кількісних підходів оцінки розмірів та функції ПШ допоможе стандартизувати оцінку ПШ в усіх ехокардіографічних кабінетах та дозволить клініцистам краще інтегрально оцінювати стан правих відділів серця. Покращення якості візуалізації при 3D-ЕхоКГ призведе до його частішого використання та потенційно також суттєво домопоже в оцінці розмірів та функції ПШ [183].
Дані рекомендації надають клініцистам основні базові погляди на оцінку правих відділів серця з точки зору існуючих літературних джерел, наводячи різні параметри з оцінки систолічної та діастолічної функції з нормативними значеннями на основі літературних даних. Це має допомогти в виявленні патології правих відділів. Автори мають надію, що цей документ призведе до подальшої роботи у визначенні меж норми в більших популяціях, а застосування визначення рекомендованих параметрів підвищіть цінність ехокардіографії у діагностиці дисфункції ПШ в клінічній практиці та призведе до покращення якості діагностики та динамічного спостереження пацієнтів.
Література
-
В.М. Коваленко, Ю.А. Іванів, М.М. Долженко, та спіавт. Кількісна ехокардіографічна оцінка порожнин серця Проект рекомендацій робочої групи з функціональної діагностики Асоціації кардіологів України та Всеукраїнської громадської організації «Асоціація фахівців з ехокардіографії» // Новости медицины и фармации. – №359. – 2011. – 34 с.
-
Lang RM, BierigM, Devereux RB, Flachskampf FA, Foster E, Pellikka PA, et al. Рекомендації for chamber quantification: a report from the American Society of Echocardiography’s Guidelines and Standards Committee and the ChamberQuantificationWritingGroup, developed in conjunction with the European Association of Echocardiography, a branch of the European Society of Cardiology. J Am Soc Echocardiogr 2005;18:1440-63.
-
Rudski L.G., et al. Guidelines for the Echocardiographic Assessment of the Right Heart in Adults: A Report from the American Society of Echocardiography Endorsed by the European Association of Echocardiography, a registered branch of the European Society of Cardiology, and the Canadian Society of Echocardiography. J Am Soc Echocardiogr 2010;23:685-713.
-
Forman MB, Goodin J, Phelan B, Kopelman H, Virmani R. Electrocardiographic changes associated with isolated right ventricular infarction. J Am Coll Cardiol 1984;4:640-3.
-
Rudski L.G., MD, Lai W.W., Afilalo J., et al. Guidelines for the Echocardiographic Assessment of the Right Heart in Adults: A Report from the American Society of Echocardiography Endorsed by the European Association of Echocardiography, a registered branch of the European Society of Cardiology, and the Canadian Society of Echocardiography // J.Am.Soc.Echocardiogr. – 2010. – Vol. 23. – P. 685-713.
-
Kugel MA. Anatomical studies on the coronary arteries and their branches 1 arteria anastomotica auricularis magna. Am Heart J 1927; 3:260.
-
Weyman A. Practices and principles of echocardiography. 2nd ed. Philadelphia: Lippincott, Williams and Wilkins; 1994.
-
Otto C. The practice of clinical echocardiography. 3rd ed. Philadelphia: Saunders Elsevier; 2007.
-
Gaynor SL, Maniar HS, Prasad SM, Steendijk P, Moon MR. Reservoir and conduit function of right atrium: impact on right ventricular filling and cardiac output. Am J Physiol Heart Circ Physiol 2005;288:H2140-5.
-
Muller H, Burri H, Lerch R. Evaluation of right atrial size in patients with atrial arrhythmias: comparison of 2D versus real time 3D echocardiography. Echocardiography 2008;25:617-23.
-
Muller H, Noble S, Keller PF, Sigaud P, Gentil P, Lerch R, et al. Biatrial anatomical reverse remodelling after radiofrequency catheter ablation for atrial fibrillation: evidence from real-time three-dimensional echocardiography. Europace 2008;10:1073-8.
-
Moreno FL, Hagan AD, Holmen JR, Pryor TA, Strickland RD, Castle CH. Evaluation of size and dynamics of the inferior vena cava as an index of right-sided cardiac function. Am J Cardiol 1984;53:579-85.
-
Brennan JM, Blair JE, Goonewardena S, Ronan A, Shah D, Vasaiwala S, et al. Reappraisal of the use of inferior vena cava for estimating right atrial pressure. J Am Soc Echocardiogr 2007;20:857-61.
-
Jue J, Chung W, Schiller NB. Does inferior vena cava size predict right atrial pressures in patients receiving mechanical ventilation? J Am Soc Echocardiogr 1992;5:613-9.
-
FeigenbaumH, ArmstrongWF, Ryan T. Feigenbaum’s echocardiography. 6th ed. Philadelphia: Lippincott Williams & Wilkins; 2005.
-
Weyman A. Cross-sectional echocardiography. Philadelphia: Lea & Febiger; 1981.
-
Ommen SR, Nishimura RA, Hurrell DG, Klarich KW. Assessment of right atrial pressure with 2-dimensional and Doppler echocardiography: a simultaneous catheterization and echocardiographic study. Mayo Clin Proc 2000;75:24-9.
-
Nagueh SF, Kopelen HA, Zoghbi WA. Relation of mean right atrial pressure to echocardiographic and Doppler parameters of right atrial and right ventricular function. Circulation 1996;93:1160-9.
-
Matsukubo H, Matsuura T, Endo N, Asayama J, Watanabe T. Echocardiographic measurement of right ventricular wall thickness. A new application of subxiphoid echocardiography. Circulation 1977;56:278-84.
-
Tsuda T, Sawayama T, Kawai N, Katoh T, Nezuo S, Kikawa K. Echocardiographic measurement of right ventricular wall thickness in adults by anterior approach. Br Heart J 1980;44:55-61.
-
Prakash R, Matsukubo H. Usefulness of echocardiographic right ventricular measurements in estimating right ventricular hypertrophy and right ventricular systolic pressure. Am J Cardiol 1983;51:1036-40.
-
Gottdiener JS, Gay JA,Maron BJ, Fletcher RD. Increased right ventricular wall thickness in left ventricular pressure overload: echocardiographic determination of hypertrophic response of the ‘‘nonstressed’’ ventricle. J Am Coll Cardiol 1985;6:550-5.
-
Haddad F, Hunt SA, Rosenthal DN, Murphy DJ. Right ventricular function in cardiovascular disease, part I: anatomy, physiology, aging, and functional assessment of the right ventricle. Circulation 2008;117:1436-48.
-
Haddad F, Doyle R, Murphy DJ, Hunt SA. Right ventricular function in cardiovascular disease, part II: pathophysiology, clinical importance, and management of right ventricular failure. Circulation 2008;117:1717-31.
-
Burgess MI, Mogulkoc N, Bright-Thomas RJ, Bishop P, Egan JJ, Ray SG. Comparison of echocardiographic markers of right ventricular function in determining prognosis in chronic pulmonary disease. J Am Soc Echocardiogr 2002;15:633-9.
-
Quiroz R, Kucher N, Schoepf UJ, Kipfmueller F, Solomon SD, Costello P, et al. Right ventricular enlargement on chest computed tomography: prognostic role in acute pulmonary embolism. Circulation 2004;109:2401-4.
-
Fremont B, Pacouret G, Jacobi D, Puglisi R, Charbonnier B, de Labriolle A. Prognostic value of echocardiographic right/left ventricular end-diastolic diameter ratio in patients with acute pulmonary embolism: results from a monocenter registry of 1,416 patients. Chest 2008;133:358-62.
-
Lai WW, Gauvreau K, Rivera ES, Saleeb S, Powell AJ, Geva T. Accuracy of guideline Рекомендації for two-dimensional quantification of the right ventricle by echocardiography. Int J Cardiovasc Imaging 2008;24: 691-8.
-
Karunanithi MK, Feneley MP. Limitations of unidimensional indexes of right ventricular contractile function in conscious dogs. J Thorac Cardiovasc Surg 2000;120:302-12.
-
Foale RA, Nihoyannopoulos P, Ribeiro P, McKenna WJ, Oakley CM, Krikler DM, et al. Right ventricular abnormalities in ventricular tachycardia of right ventricular origin: relation to electrophysiological abnormalities. Br Heart J 1986;56:45-54.
-
Sugishita Y,Watanabe M, Fisher SA. The development of the embryonic outflow tract provides novel insights into cardiac differentiation and remodeling. Trends Cardiovasc Med 2004;14:235-41.
-
Dell’Italia LJ. The right ventricle: anatomy, physiology, and clinical importance. Curr Probl Cardiol 1991;16:653-720.
-
Geva T, Powell AJ, Crawford EC, Chung T, Colan SD. Evaluation of regional differences in right ventricular systolic function by acoustic quantification echocardiography and cine magnetic resonance imaging. Circulation 1998;98:339-45.
-
Bashore TM. Adult congenital heart disease: right ventricular outflow tract lesions. Circulation 2007;115:1933-47.
-
Arya A, Piorkowski C, Sommer P, Gerds-Li JH, Kottkamp H, Hindricks G. Idiopathic outflow tract tachycardias: current perspectives. Herz 2007;32:218-25.
-
Yoerger DM,Marcus F, Sherrill D, Calkins H, Towbin JA, ZarebaW, et al. Echocardiographic findings in patients meeting task force criteria for arrhythmogenic right ventricular dysplasia: new insights from the multidisciplinary study of right ventricular dysplasia. J Am Coll Cardiol 2005;45:860-5.
-
Anwar AM, SolimanO, van den Bosch AE,McGhie JS,GeleijnseML, ten Cate FJ, et al. Assessment of pulmonary valve and right ventricular outflow tract with real-time three-dimensional echocardiography. Int J Cardiovasc Imaging 2007;23:167-75.
-
Anavekar NS, Gerson D, Skali H, Kwong RY, Yucel EK, Solomon SD. Two-dimensional assessment of right ventricular function: an echocardiographic-MRI correlative study. Echocardiography 2007;24:452-6.
-
Nass N,McConnellMV, Goldhaber SZ, Chyu S, Solomon SD. Recovery of regional right ventricular function after thrombolysis for pulmonary embolism. Am J Cardiol 1999;83:804-6.
-
Zornoff LA, SkaliH, PfefferMA, St John SM, Rouleau JL, LamasGA, et al. Right ventricular dysfunction and risk of heart failure and mortality after myocardial infarction. J Am Coll Cardiol 2002;39:1450-5.
-
Anavekar NS, Skali H, Bourgoun M, Ghali JK, Kober L, Maggioni AP, et al. Usefulness of right ventricular fractional area change to predict death, heart failure, and stroke following myocardial infarction (from the VALIANT ECHO study). Am J Cardiol 2008;101:607-12.
-
Jiang L, Levine RA, Weyman AE. Echocardiographic assessment of right ventricular volume and function. Echocardiography 1997;14:189-206.
-
Helbing WA, Bosch HG, Maliepaard C, Rebergen SA, van der Geest RJ, Hansen B, et al. Comparison of echocardiographic methods with magnetic resonance imaging for assessment of right ventricular function in children. Am J Cardiol 1995;76:589-94.
-
Starling MR, Crawford MH, Sorensen SG, O’Rourke RA. A new two- dimensional echocardiographic technique for evaluating right ventricular size and performance in patients with obstructive lung disease. Circulation 1982;66:612-20.
-
Silverman NH, Hudson S. Evaluation of right ventricular volume and ejection fraction in children by two-dimensional echocardiography. Pediatr Cardiol 1983;4:197-203.
-
Gopal AS, Chukwu EO, Iwuchukwu CJ, Katz AS, Toole RS, SchapiroW, et al. Normal values of right ventricular size and function by real-time 3-dimensional echocardiography: comparison with cardiac magnetic resonance imaging. J Am Soc Echocardiogr 2007;20:445-55.
-
Watanabe T, Katsume H,Matsukubo H, Furukawa K, Ijichi H. Estimation of right ventricular volume with two dimensional echocardiography. Am J Cardiol 1982;49:1946-53.
-
Linker DT, MoritzWE, Pearlman AS. A new three-dimensional echocardiographicmethod of right ventricular volumemeasurement: in vitro validation. J Am Coll Cardiol 1986;8:101-6.
-
Fei HW,Wang XF, XieMX, Zhuang L, Chen LX, Yang Y, et al. Validation of real-time three-dimensional echocardiography for quantifying left and right ventricular volumes: an experimental study. Chin Med J (Engl) 2004;117:695-9.
-
Schindera ST,Mehwald PS, SahnDJ, KececiogluD. Accuracy of real-time three-dimensional echocardiography for quantifying right ventricular volume: static and pulsatile flow studies in an anatomic in vitro model. J Ultrasound Med 2002;21:1069-75.
-
Hoch M, Vasilyev NV, Soriano B, Gauvreau K,Marx GR. Variables influencing the accuracy of right ventricular volume assessment by real-time 3-dimensional echocardiography: an in vitro validation study. J Am Soc Echocardiogr 2007;20:456-61.
-
Grison A, Maschietto N, Reffo E, Stellin G, Padalino M, Vida V, et al. Three-dimensional echocardiographic evaluation of right ventricular volume and function in pediatric patients: validation of the technique. J Am Soc Echocardiogr 2007;20:921-9.
-
Heusch A, Lawrenz W, Olivier M, Schmidt KG. Transesophageal 3-dimensional versus cross-sectional echocardiographic assessment of the volume of the right ventricle in children with atrial septal defects. Cardiol Young 2006;16:135-40.
-
Nesser HJ, Tkalec W, Patel AR, Masani ND, Niel J, Markt B, et al. Quantitation of right ventricular volumes and ejection fraction by three-dimensional echocardiography in patients: comparison with magnetic resonance imaging and radionuclide ventriculography. Echocardiography 2006;23:666-80.
-
Horton KD, Meece RW, Hill JC. Assessment of the right ventricle by echocardiography: a primer for cardiac sonographers. J AmSoc Echocardiogr 2009;22:776-92.
-
Endo Y,Maddukuri PV,Vieira ML, Pandian NG, Patel AR.Quantification of right ventricular volumes and function by real time three-dimensional echocardiographic longitudinal axial planemethod: validation in the clinical setting. Echocardiography 2006;23:853-9.
-
Lu X, Nadvoretskiy V, Bu L, Stolpen A, Ayres N, Pignatelli RH, et al. Accuracy and reproducibility of real-time three-dimensional echocardiography for assessment of right ventricular volumes and ejection fraction in children. J Am Soc Echocardiogr 2008;21:84-9.
-
Niemann PS, Pinho L, Balbach T, Galuschky C, Blankenhagen M, SilberbachM, et al. Anatomically oriented right ventricular volume measurements with dynamic three-dimensional echocardiography validated by 3-Tesla magnetic resonance imaging. J Am Coll Cardiol 2007;50:1668-76.
-
Papavassiliou DP, Parks WJ, Hopkins KL, Fyfe DA. Three-dimensional echocardiographic measurement of right ventricular volume in children with congenital heart disease validated by magnetic resonance imaging. J Am Soc Echocardiogr 1998;11:770-7.
-
Vogel M, Gutberlet M, Dittrich S, Hosten N, Lange PE. Comparison of transthoracic three dimensional echocardiography with magnetic resonance imaging in the assessment of right ventricular volume and mass. Heart 1997;78:127-30.
-
Fujimoto S, Mizuno R, Nakagawa Y, Dohi K, Nakano H. Estimation of the right ventricular volume and ejection fraction by transthoracic three-dimensional echocardiography. A validation study using magnetic resonance imaging. Int J Card Imaging 1998;14:385-90.
-
Kjaergaard J, Sogaard P, Hassager C. Quantitative echocardiographic analysis of the right ventricle in healthy individuals. J Am Soc Echocardiogr 2006;19:1365-72.
-
Jenkins C, Chan J, Bricknell K, Strudwick M, Marwick TH. Reproducibility of right ventricular volumes and ejection fraction using real-time three-dimensional echocardiography: comparison with cardiac MRI. Chest 2007;131:1844-51.
-
Leibundgut G, Rohner A, Grize L, Bernheim A, Kessel-Schaefer A, Bremerich J, et al. Dynamic assessment of right ventricular volumes and function by real-time three-dimensional echocardiography: a comparison study with magnetic resonance imaging in 100 adult patients. J Am Soc Echocardiogr 2010;23:116-26.
-
van der Zwaan HB, Helbing WA, McGhie JS, Geleijnse ML, Luijnenburg SE, Roos-Hesselink JW, et al. Clinical value of real-time three-dimensional echocardiography for right ventricular quantification in congenital heart disease: validation with cardiac magnetic resonance imaging. J Am Soc Echocardiogr 2010;23:134-40.
-
Grewal J,MajdalanyD, Syed I, Pellikka P,Warnes CA. Three-dimensional echocardiographic assessment of right ventricular volume and function in adult patientswith congenital heart disease: comparisonwithmagnetic resonance imaging. J Am Soc Echocardiogr 2010;23:127-33.
-
Tamborini G, Marsan NA, Gripari P, Maffessanti F, Brusoni D, Muratori M, et al. Reference values for right ventricular volumes and ejection fraction with real-time three-dimensional echocardiography: evaluation in a large series of normal subjects. J Am Soc Echocardiogr 2010;23:109-15.
-
Lin SS, Reynertson SI, Louie EK, Levitsky S. Right ventricular volume overload results in depression of left ventricular ejection fraction. Implications for the surgical management of tricuspid valve disease. Circulation 1994;90:II209-13.
-
Louie EK, Bieniarz T,Moore AM, Levitsky S. Reduced atrial contribution to left ventricular filling in patients with severe tricuspid regurgitation after tricuspid valvulectomy: a Doppler echocardiographic study. J Am Coll Cardiol 1990;16:1617-24.
-
Reynertson SI, Kundur R, Mullen GM, Costanzo MR, McKiernan TL, Louie EK. Asymmetry of right ventricular enlargement in response to tricuspid regurgitation. Circulation 1999;100:465-7.
-
Ryan T, PetrovicO,Dillon JC, FeigenbaumH,ConleyMJ, ArmstrongWF. An echocardiographic index for separation of right ventricular volume and pressure overload. J Am Coll Cardiol 1985;5:918-27.
-
Louie EK, Rich S, Levitsky S, Brundage BH. Doppler echocardiographic demonstration of the differential effects of right ventricular pressure and volume overload on left ventricular geometry and filling. J Am Coll Car diol 1992;19:84-90.
-
Mori S, Nakatani S, Kanzaki H, Yamagata K, Take Y, Matsuura Y, et al. Patterns of the interventricular septal motion can predict conditions of patients with pulmonary hypertension. J Am Soc Echocardiogr 2008; 21:386-93.
-
Galie N, Hinderliter AL, Torbicki A, Fourme T, Simonneau G, Pulido T, et al. Effects of the oral endothelin-receptor antagonist bosentan on echocardiographic and doppler measures in patients with pulmonary arterial hypertension. J Am Coll Cardiol 2003;41:1380-6.
-
Raymond RJ, Hinderliter AL, Willis PW, Ralph D, Caldwell EJ, Williams W, et al. Echocardiographic predictors of adverse outcomes in primary pulmonary hypertension. J Am Coll Cardiol 2002;39:1214-9.
-
Badesch DB, Champion HC, Sanchez MA, Hoeper MM, Loyd JE, Manes A, et al.Diagnosis and assessment of pulmonary arterial hypertension. J Am Coll Cardiol 2009;54:S55-66.
-
LamCS, Borlaug BA, Kane GC, Enders FT, Rodeheffer RJ, RedfieldMM. Age-associated increases in pulmonary artery systolic pressure in the general population. Circulation 2009;119:2663-70.
-
McQuillan BM, Picard MH, Leavitt M, Weyman AE. Clinical correlates and reference intervals for pulmonary artery systolic pressure among echocardiographically normal subjects. Circulation 2001;104: 2797-802.
-
McLaughlinVV,Archer SL, BadeschDB, Barst RJ, FarberHW, Lindner JR, et al. ACCF/AHA 2009 expert consensus document on pulmonary hypertension: a report of the American College of Cardiology Foundation Task Force on Expert Consensus Documents and the American Heart Association developed in collaboration with the American College of Chest Physicians; American Thoracic Society, Inc.; and the Pulmonary Hypertension Association. J Am Coll Cardiol 2009;53:1573-619.
-
Yock PG, Popp RL. Noninvasive estimation of right ventricular systolic pressure by Doppler ultrasound in patients with tricuspid regurgitation. Circulation 1984;70:657-62.
-
Currie PJ, Seward JB, Chan KL, Fyfe DA, Hagler DJ,Mair DD, et al. Continuous wave Doppler determination of right ventricular pressure: a simultaneous Doppler-catheterization study in 127 patients. J Am Coll Cardiol 1985;6:750-6.
-
Fisher MR, Forfia PR, Chamera E, Housten-Harris T, Champion HC, Girgis RE, et al. Accuracy of Doppler echocardiography in the hemodynamic assessment of pulmonary hypertension. Am J Respir Crit Care Med 2009;179:615-21.
-
Hinderliter AL, Willis PW, Barst RJ, Rich S, Rubin LJ, Badesch DB, et al., Primary Pulmonary Hypertension Study Group. Effects of long-term in fusion of prostacyclin (epoprostenol) on echocardiographic measures of right ventricular structure and function in primary pulmonary hypertension. Circulation 1997;95:1479-86.
-
MahanG,Dabestani A,Gardin J, Allfie A, Burn C,HenryW. Estimation of pulmonary artery pressure by pulsed Doppler echocardiography. Circulation 1983;68:367.
-
Dabestani A, Mahan G, Gardin JM, Takenaka K, Burn C, Allfie A, et al. Evaluation of pulmonary artery pressure and resistance by pulsed Doppler echocardiography. Am J Cardiol 1987;59:662-8.
-
Abbas AE, Fortuin FD, Schiller NB, Appleton CP,Moreno CA, Lester SJ. Echocardiographic determination of mean pulmonary artery pressure. Am J Cardiol 2003;92:1373-6.
-
Aduen JF, Castello R, Lozano MM, Hepler GN, Keller CA, Alvarez F, et al. An alternative echocardiographicmethod to estimatemean pulmonary artery pressure: diagnostic and clinical implications. J Am Soc Echocardiogr 2009;22:814-9.
-
Ristow B, Schiller NB. Stepping away from ritual right heart catheterization into the era of noninvasively measured pulmonary artery pressure. J Am Soc Echocardiogr 2009;22:820-2.
-
Milan A, Magnino C, Veglio F. Echocardiographic indexes for the non-invasive evaluation of pulmonary hemodynamics. J Am Soc Echocardiogr 2010;23:225-39.
-
Abbas AE, Fortuin FD, Schiller NB, Appleton CP, Moreno CA, Lester SJ. A simplemethod for noninvasive estimation of pulmonary vascular resistance. J Am Coll Cardiol 2003;41:1021-7.
-
Farzaneh-Far R, McKeown BH, Dang D, Roberts J, Schiller NB, Foster E. Accuracy of Doppler-estimated pulmonary vascular resistance in patients before liver transplantation. Am J Cardiol 2008;101:259-62.
-
Farzaneh-Far R, Na B,Whooley MA, Schiller NB. Usefulness of noninvasive estimate of pulmonary vascular resistance to predict mortality, heart failure, and adverse cardiovascular events in patients with stable coronary artery disease (from the Heart and Soul Study). Am J Cardiol 2008;101:762-6.
-
Rajagopalan N, Simon MA, Suffoletto MS, Shah H, Edelman K, Mathier MA, et al. Noninvasive estimation of pulmonary vascular resistance in pulmonary hypertension. Echocardiography 2009;26: 489-94.
-
Grunig E, Weissmann S, Ehlken N, Fijalkowska A, Fischer C, Fourme T, et al. Stress Doppler echocardiography in relatives of patients with idiopathic and familial pulmonary arterial hypertension: results of amulticenter European analysis of pulmonary artery pressure response to exercise and hypoxia. Circulation 2009;119:1747-57.
-
Bossone E, Rubenfire M, Bach DS, RicciardiM, ArmstrongWF. Range of tricuspid regurgitation velocity at rest and during exercise in normal adult men: implications for the diagnosis of pulmonary hypertension. J Am Coll Cardiol 1999;33:1662-6.
-
Scapellato F, Temporelli PL, Eleuteri E, Corra U, Imparato A, Giannuzzi P. Accurate noninvasive estimation of pulmonary vascular resistance by Doppler echocardiography in patients with chronic failure heart failure. J Am Coll Cardiol 2001;37:1813-9.
-
Dehnert C, Grunig E,Mereles D, von Lennep N, Bartsch P. Identification of individuals susceptible to high-altitude pulmonary oedema at low altitude. Eur Respir J 2005;25:545-51.
-
Grunig E, Janssen B, Mereles D, Barth U, Borst MM, Vogt IR, et al. Abnormal pulmonary artery pressure response in asymptomatic carriers of primary pulmonary hypertension gene. Circulation 2000;102: 1145-50.
-
Bidart CM, Abbas AE, Parish JM, Chaliki HP,Moreno CA, Lester SJ. The noninvasive evaluation of exercise-induced changes in pulmonary artery pressure and pulmonary vascular resistance. J Am Soc Echocardiogr 2007;20:270-5.
-
Gleason WL, Braunwald E. Studies on the first derivative of the ventricular pressure pulse in man. J Clin Invest 1962;41:80-91.
-
Anconina J, Danchin N, Selton-Suty C, Isaaz K, Juilliere Y, Buffet P, et al. Measurement of right ventricular dP/dt. A simultaneous/comparative hemodynamic and Doppler echocardiographic study [article in French]. Arch Mal Coeur Vaiss 1992;85:1317-21.
-
Anconina J, Danchin N, Selton-Suty C, Isaaz K, Juilliere Y, Buffet P, et al. Noninvasive estimation of right ventricular dP/dt in patients with tricuspid valve regurgitation. Am J Cardiol 1993;71:1495-7.
-
Tei C, Dujardin KS, Hodge DO, Bailey KR, McGoon MD, Tajik AJ, et al. Doppler echocardiographic index for assessment of global right ventricular function. J Am Soc Echocardiogr 1996;9:838-47.
-
Yoshifuku S, Otsuji Y, Takasaki K, Yuge K, Kisanuki A, Toyonaga K, et al. Pseudonormalized Doppler total ejection isovolume (Tei) index in patients with right ventricular acute myocardial infarction. Am J Cardiol 2003;91:527-31.
-
Rojo EC, Rodrigo JL, Perez de Isla L, Almeria C, Gonzalo N, Aubele A, et al. Disagreement between tissue Doppler imaging and conventional pulsed wave Doppler in the measurement of myocardial performance index. Eur J Echocardiogr 2006;7:356-64.
-
Gaibazzi N, Petrucci N, Ziacchi V. Left ventriclemyocardial performance index derived either by conventional method або mitral annulus tissue Doppler: a comparison study in healthy subjects and subjects with heart failure. J Am Soc Echocardiogr 2005;18:1270-6.
-
Sebbag I, Rudski LG, Therrien J, Hirsch A, Langleben D. Effect of chronic infusion of epoprostenol on echocardiographic right ventricular myocardial performance index and its relation to clinical outcome in patients with primary pulmonary hypertension. Am J Cardiol 2001; 88:1060-3.
-
Abd El Rahman MY, Abdul-Khaliq H, Vogel M, Alexi-Meskischvili V, Gutberlet M, Hetzer R, et al. Value of the new Doppler-derived myocardial performance index for the evaluation of right and left ventricular function following repair of tetralogy of Fallot. Pediatr Cardiol 2002; 23:502-7.
-
Chockalingam A, Gnanavelu G, Alagesan R, Subramaniam T. Myocar-dial performance index in evaluation of acute right ventricular myocardial infarction. Echocardiography 2004;21:487-94.
-
Eidem BW, O’Leary PW, Tei C, Seward JB. Usefulness of the myocardial performance index for assessing right ventricular function in congenital heart disease. Am J Cardiol 2000;86:654-8.
-
Moller JE, Sondergaard E, Poulsen SH, Appleton CP, Egstrup K. Serial Doppler echocardiographic assessment of left and right ventricular performance after a first myocardial infarction. J Am Soc Echocardiogr 2001;14:249-55.
-
Morner S, Lindqvist P,Waldenstrom A, Kazzam E. Right ventricular dysfunction in hypertrophic cardiomyopathy as evidenced by the myocardial performance index. Int J Cardiol 2008;124:57-63.
-
Schwerzmann M, Samman AM, Salehian O, Holm J, Provost Y, Webb GD, et al. Comparison of echocardiographic and cardiac magnetic resonance imaging for assessing right ventricular function in adults with repaired tetralogy of Fallot. Am J Cardiol 2007;99:1593-7.
-
Kaul S, Tei C, Hopkins JM, Shah PM. Assessment of right ventricular function using two-dimensional echocardiography. Am Heart J 1984;107: 526-31.
-
Lopez-Candales A, Dohi K, Rajagopalan N, Edelman K, Gulyasy B, Bazaz R. Defining normal variables of right ventricular size and function in pulmonary hypertension: an echocardiographic study. Postgrad Med J 2008;84:40-5.
-
Miller D, Farah MG, Liner A, Fox K, Schluchter M, Hoit BD. The relation between quantitative right ventricular ejection fraction and indices of tricuspid annular motion and myocardial performance. J Am Soc Echocardiogr 2004;17:443-7.
-
Tamborini G, PepiM, Galli CA,Maltagliati A, Celeste F,MuratoriM, et al. Feasibility and accuracy of a routine echocardiographic assessment of right ventricular function. Int J Cardiol 2007;115:86-9.
-
Lindqvist P, Waldenstrom A, Henein M, Morner S, Kazzam E. Regional and global right ventricular function in healthy individuals aged 20-90 years: a pulsed Doppler tissue imaging study: Umea General Population Heart Study. Echocardiography 2005;22:305-14.
-
Kukulski T, Hubbert L, Arnold M, Wranne B, Hatle L, Sutherland GR. Normal regional right ventricular functionandits changewithage: a Doppler myocardial imaging study. J Am Soc Echocardiogr 2000;13:194-204.
-
Nikitin NP, Witte KK, Thackray SD, de Silva R, Clark AL, Cleland JG. Longitudinal ventricular function: normal values of atrioventricular annular and myocardial velocities measured with quantitative two-dimensional color Doppler tissue imaging. J Am Soc Echocardiogr 2003;16:906-21.
-
Duan YY, Harada K, Toyono M, Ishii H, Tamura M, Takada G. Effects of acute preload reduction on myocardial velocity during isovolumic contraction andmyocardial acceleration in pediatric patients. Pediatr Cardiol 2006;27:32-6.
-
Kjaergaard J, Snyder EM, Hassager C, Oh JK, Johnson BD. Impact of preload and afterload on global and regional right ventricular function and pressure: a quantitative echocardiography study. J Am Soc Echocardiogr 2006;19:515-21.
-
Pauliks LB, Chan KC, Chang D, Kirby SK, Logan L, DeGroff CG, et al. Regional myocardial velocities and isovolumic contraction acceleration before and after device closure of atrial septal defects: a color tissue Doppler study. Am Heart J 2005;150:294-301.
-
VogelM, SchmidtMR, Kristiansen SB, CheungM,White PA, Sorensen K, et al. Validation ofmyocardial acceleration during isovolumic contraction as a novel noninvasive index of right ventricular contractility: comparison with ventricular pressure-volume relations in an animal model. Circulation 2002;105:1693-9.
-
Tousignant CP, Bowry R, Levesque S, Denault AY. Regional differences in color tissue Doppler-derivedmeasures of longitudinal right ventricular function using transesophageal and transthoracic echocardiography. J Cardiothorac Vasc Anesth 2008;22:400-5.
-
Tugcu A, Guzel D, Yildirimturk O, Aytekin S. Evaluation of right ventricular systolic and diastolic function in patients with newly diagnosed obstructive sleep apnea syndrome without hypertension. Cardiology 2009;113:184-92.
-
Sade LE, Ozin B, Ulus T, Acikel S, Pirat B, Bilgi M, et al. Right ventricular contractile reserve in mitral stenosis: implications on hemodynamic burden and clinical outcome. Int J Cardiol 2009;135:193-201.
-
Tayyareci Y, Nisanci Y, Umman B, Oncul A, Yurdakul S, Altun I, et al. Early detection of right ventricular systolic dysfunction by using myocardial acceleration during isovolumic contraction in patientswithmitral stenosis. Eur J Echocardiogr 2008;9:516-21.
-
ToyonoM, Harada K, TamuraM, Yamamoto F, Takada G.Myocardial acceleration during isovolumic contraction as a new index of right ventricular contractile function and its relation to pulmonary regurgitation in patients after repair of tetralogy of Fallot. J Am Soc Echocardiogr 2004;17:332-7.
-
VogelM,Derrick G,White PA, Cullen S, Aichner H, Deanfield J, et al. Systemic ventricular function in patients with transposition of the great arteries after atrial repair: a tissue Doppler and conductance catheter study. J Am Coll Cardiol 2004;43:100-6.
-
Vogel M, Vogt M. Noninvasive assessment of right ventricular contractile performance. In: Redington AN, Van Arsdell GS, Anderson RH, editors. Congenital diseases in the right heart.London: Springer; 2009. pp. 207-12.
-
Jamal F, Bergerot C, Argaud L, Loufouat J, Ovize M. Longitudinal strain quantitates regional right ventricular contractile function. Am J Physiol Heart Circ Physiol 2003;285:H2842-7.
-
Berg S. Myocardial Strain Rate by Doppler Ultrasound Methods. Angle dependency and error estimation. Master’s thesis, Department of Engineering Cybernetics, NTNU, Trondheim, Norway 2004.
-
Sutherland GR, Di Salvo G, Claus P, D’hooge J, Bijnens B. Strain and strain rate imaging: a new clinical approach to quantifying regional myocardial function. J Am Soc Echocardiogr 2004;17:788-802.
-
Kjaergaard J, Sogaard P, Hassager C. Right ventricular strain in pulmonary embolism by Doppler tissue echocardiography. J Am Soc Echocardiogr 2004;17:1210-2.
-
Kittipovanonth M, Bellavia D, Chandrasekaran K, Villarraga HR, Abraham TP, Pellikka PA. Doppler myocardial imaging for early detection of right ventricular dysfunction in patientswith pulmonary hypertension. J Am Soc Echocardiogr 2008;21:1035-41.
-
Chow PC, Liang XC, Cheung EW, Lam WW, Cheung YF. New two-dimensional global longitudinal strain and strain rate imaging for assessment of systemic right ventricular function. Heart 2008;94:855-9.
-
Koyama J, Ray-Sequin PA, Falk RH. Longitudinal myocardial function assessed by tissue velocity, strain, and strain rate tissue Doppler echocardiography in patients with AL (primary) cardiac amyloidosis. Circulation 2003;107:2446-52.
-
Lindqvist P, Olofsson BO, Backman C, Suhr O, Waldenstrom A. Pulsed tissue Doppler and strain imaging discloses early signs of infiltrative cardiac disease: a study on patients with familial amyloidotic polyneuropathy. Eur J Echocardiogr 2006;7:22-30.
-
Sun JP, StewartWJ, Yang XS, Donnell RO, Leon AR, Felner JM, et al. Differentiation of hypertrophic cardiomyopathy and cardiac amyloidosis from other causes of ventricular wall thickening by two-dimensional strain imaging echocardiography. Am J Cardiol 2009;103:411-5.
-
Fujii J, Yazaki Y, Sawada H, Aizawa T,Watanabe H, Kato K. Noninvasive assessment of left and right ventricular filling in myocardial infarction with a two-dimensional Doppler echocardiographic method. J Am Coll Cardiol 1985;5:1155-60.
-
YanaseO,Motomiya T, Tejima T,Nomura S. Doppler echocardiographic assessment of right ventricular filling characteristics in hemodynamically significant right ventricular infarction. Am J Noninvasiv Cardiol 1992;6: 230-6.
-
Yilmaz M, Erol MK, Acikel M, Sevimli S, Alp N. Pulsed Doppler tissue imaging can help to identify patients with right ventricular infarction. Heart Vessels 2003;18:112-6.
-
Berman GO, Reichek N, Brownson D, Douglas PS. Effects of sample volume location, imaging view, heart rate and age on tricuspid velocimetry in normal subjects. Am J Cardiol 1990;65:1026-30.
-
Bove AA, SantamoreWP. Ventricular interdependence. Prog Cardiovasc Dis 1981;23:365-88.
-
CourtoisM, Barzilai B, Gutierrez F, Ludbrook PA. Characterization of regional diastolic pressure gradients in the right ventricle. Circulation 1990; 82:1413-23.
-
Dell’Italia LJ, Walsh RA. Right ventricular diastolic pressure-volume relations and regional dimensions during acute alterations in loading conditions. Circulation 1988;77:1276-82.
-
Weber KT, Janicki JS, Shroff S, Fishman AP. Contractile mechanics and interaction of the right and left ventricles. Am J Cardiol 1981;47: 686-95.
-
Pye MP, Pringle SD, Cobbe SM. Reference values and reproducibility of Doppler echocardiography in the assessment of the tricuspid valve and right ventricular diastolic function in normal subjects. Am J Cardiol 1991;67:269-73.
-
Klein AL, Leung DY, Murray RD, Urban LH, Bailey KR, Tajik AJ. Effects of age and physiologic variables on right ventricular filling dynamics in normal subjects. Am J Cardiol 1999;84:440-8.
-
Redington AN, Penny D, Rigby ML, Hayes A. Antegrade diastolic pul-monary arterial flow as amarker of right ventricular restriction after complete repair of pulmonary atresia with intact septum and critical pulmonary valvar stenosis. Cardiol Young 1992;2:382-6.
-
Innelli P, Esposito R,OlibetM, Nistri S, GalderisiM. The impact of ageing on right ventricular longitudinal function in healthy subjects: a pulsed tissue Doppler study. Eur J Echocardiogr 2009;10:491-8.
-
ZoghbiWA, Habib GB, QuinonesMA. Doppler assessment of right ventricular filling in a normal population. Comparison with left ventricular filling dynamics. Circulation 1990;82:1316-24.
-
Yu CM, Lin H, Ho PC, Yang H. Assessment of left and right ventricular systolic and diastolic synchronicity in normal subjects by tissue Doppler echocardiography and the effects of age and heart rate. Echocardiography 2003;20:19-27.
-
Berman JL, Green LH, Grossman W. Right ventricular diastolic pressure in coronary artery disease. Am J Cardiol 1979;44:1263-8.
-
Wells DE, Befeler B. Dysfunction of the right ventricle in coronary artery disease. Chest 1974;66:230-5.
-
Guazzi M, Maltagliati A, Tamborini G, Celeste F, Pepi M, Muratori M, et al. How the left and right sides of the heart, as well as pulmonary venous drainage, adapt to an increasing degree of head-up tilting in hypertrophic cardiomyopathy: differences from the normal heart. J Am Coll Cardiol 2000;36:185-93.
-
O’Sullivan CA, Duncan A, Daly C, Li W, Oldershaw P, Henein MY. Dobutamine stress-induced ischemic right ventricular dysfunction and its relation to cardiac output in patients with three-vessel coronary artery disease with angina-like symptoms. Am J Cardiol 2005; 96:622-7.
-
Pela G, Regolisti G, Coghi P, Cabassi A, Basile A, Cavatorta A, et al. Effects of the reduction of preload on left and right ventricular myocardial velocities analyzed by Doppler tissue echocardiography in healthy subjects. Eur J Echocardiogr 2004;5:262-71.
-
Heywood JT, GrimmJ, HessOM, JakobM, Krayenbuhl HP. Right ventricular diastolic function during exercise: effect of ischemia. J Am Coll Cardiol 1990;16:611-22.
-
Sade LE, Gulmez O, Eroglu S, Sezgin A, Muderrisoglu H. Noninvasive estimation of right ventricular filling pressure by ratio of early tricuspid inflow to annular diastolic velocity in patients with and without recent cardiac surgery. J Am Soc Echocardiogr 2007;20:982-8.
-
Sundereswaran L, Nagueh SF, Vardan S, Middleton KJ, Zoghbi WA, Quinones MA, et al. Estimation of left and right ventricular filling pressures after heart transplantation by tissue Doppler imaging. Am J Cardiol 1998;82:352-7.
-
Sallach JA, Tang WHW, Borowski AG, Tong W, Porter T, Martin MG, et al. Right atrial volume index in chronic systolic heart failure and prognosis. JACC Cardiovasc Imaging 2009;2:527-34.
-
Dernellis J. Right atrial function in hypertensive patients: effects of antihypertensive therapy. J Hum Hypertens 2001;15:463-70.
-
Gan CTJ, Holverda S, Marcus JT, Paulus WJ, Marques KM, Bronzwaer JGF, et al. Right ventricular diastolic dysfunction and the acute effects of sildenafil in pulmonary hypertension patients. Chest 2007;132:11-7.
-
Sadler DB, Brown J, Nurse H, Roberts J. Impact of hemodialysis on left and right ventricular Doppler diastolic filling indices. Am J Med Sci 1992;304:83-90.
-
Turhan S, Tulunay C, Ozduman Cin M, Gursoy A, Kilickap M, Dincer I, et al. Effects of thyroxine therapy on right ventricular systolic and diastolic function in patients with subclinical hypothyroidism: a study by pulsed wave tissue Doppler imaging. J Clin Endocrinol Metab 2006; 91:3490-3.
-
Cresci SG, Goldstein JA. Hemodynamic manifestations of ischemic right heart dysfunction. Cathet Cardiovasc Diagn 1992;27:28-33.
-
McConnell MV, Solomon SD, Rayan ME, Come PC, Goldhaber SZ, Lee RT. Regional right ventricular dysfunction detected by echocardiography in acute pulmonary embolism. Am J Cardiol 1996;78:469-73.
-
Scridon T, Scridon C, Skali H, Alvarez A, Goldhaber SZ, Solomon SD. Prognostic significance of troponin elevation and right ventricular enlargement in acute pulmonary embolism. Am J Cardiol 2005;96:303-5.
-
Ferlinz J. Right ventricular function in adult cardiovascular disease. Prog Cardiovasc Dis 1982;25:225-67.
-
Berger PB, Ruocco NA Jr., Ryan TJ, Jacobs AK, Zaret BL, Wackers FJ, et al., The TIMI Research Group. Frequency and significance of right ventricular dysfunction during inferior wall left ventricularmyocardial infarction treated with thrombolytic therapy (results from the Thrombolysis In Myocardial Infarction [TIMI] II trial). Am J Cardiol 1993;71:1148-52.
-
Gorcsan J III, Murali S, Counihan PJ, Mandarino WA, Kormos RL. Right ventricular performance and contractile reserve in patients with severe heart failure. Assessment by pressure-area relations and association with outcome. Circulation 1996;94:3190-7.
-
Polak JF, Holman BL, Wynne J, Colucci WS. Right ventricular ejection fraction: an indicator of increased mortality in patients with congestive heart failure associated with coronary artery disease. J Am Coll Cardiol 1983;2:217-24.
-
Di Salvo TG, Mathier M, Semigran MJ, Dec GW. Preserved right ventricular ejection fraction predicts exercise capacity and survival in advanced heart failure. J Am Coll Cardiol 1995;25:1143-53.
-
Skali H, Zornoff LA, PfefferMA, ArnoldMO, Lamas GA,Moye LA, et al. Prognostic use of echocardiography 1 year after a myocardial infarction. Am Heart J 2005;150:743-9.
-
Khush KK, TasissaG, Butler J,McGlothlinD,DeMarco T. ESCAPE Investigators. Effect of pulmonary hypertension on clinical outcomes in advanced heart failure: analysis of the Evaluation Study of Congestive Heart Failure and Pulmonary Artery Catheterization Effectiveness (ESCAPE) database. Am Heart J 2009;157:1026-34.
-
Romero-Corral A, Somers VK, Pellikka PA, Olson EJ, Bailey KR, Korinek J, et al. Decreased right and left ventricular myocardial performance in obstructive sleep apnea. Chest 2007;132:1863-70.
-
Bhattacharyya S, Toumpanakis C, Burke M, Taylor AM, Caplin ME, Davar J. Features of carcinoid heart disease identified by 2- and 3-dimensional echocardiography and cardiac MRI. Circ Cardiovasc Imaging 2010;3:103-11.
-
Callahan JA, Wroblewski EM, Reeder GS, Edwards WD, Seward JB, Tajik AJ. Echocardiographic features of carcinoid heart disease. Am J Cardiol 1982;50:762-8.
-
Mittal SR, Goozar RS. Echocardiographic evaluation of right ventricular systolic functions in puremitral stenosis. Int JCardiovasc Imaging 2001;17:13-8.
-
Schenk P, Globits S, Koller J, Brunner C, Artemiou O, Klepetko W, et al. Accuracy of echocardiographic right ventricular parameters in patients with different end-stage lung diseases prior to lung transplantation. J Heart Lung Transplant 2000;19:145-54.
-
Jurcut R, Giusca S, La Gerche A, Vasile S, Ginghina C, Voigt JU. The echocardiographic assessment of the right ventricle: what to do in 2010? Eur J Echocardiogr 2010;11:81-96.