УДК 612.12-008.46-005.4-036.1-08:612.171:577.175.5
Динаміка рівня альдостерону у хворих на хронічну серцеву недостатність зі збереженою фракцією викиду під впливом лікування
Курята О.В.
ДЗ «Дніпропетровська медична академія», м. Дніпропетровськ
Кафедра госпітальної терапії №1 та профпатології
Ключові слова: хронічна серцева недостатність, збережена фракція викиду, альдостерон, петльові діуретики.
Незважаючи на досягнення сучасної медицини, розповсюдженість хронічної серцевої недостатності (ХСН) не тільки не знижується, але й продовжує зростати [2, 4]. Дослідження останніх років свідчать про збільшення кількості хворих з симптомами серцевої недостатності при фракції викиду (ФВ) лівого шлуночка ≥45% [6, 22]. На жаль, на сучасному етапі узгодженого погляду на лікування цієї категорії хворих не розроблено. Дослідження CHARM-PRESERVED, I-PRESERVED, PEP-CHF завершені, але не продемонстрували значного впливу на кінцеві точки [11, 20, 21, 24].
Важливу роль в розвитку та прогресуванні ХСН має ожиріння [2], але результати досліджень не є однозначними. За літературними даними існує так званий «парадокс ожиріння», при якому смертність у хворих з нормальною масою тіла вища, ніж у хворих з надлишковою вагою та ожирінням [19].
З накопиченням даних щодо патогенезу ХСН змінюються парадигми ведення таких хворих. В основу лікування включено інгібітори АПФ, бета-блокатори, блокатори мінералокортикоїдних рецепторів та при незначних ознаках застою – діуретична терапія. Згідно рекомендацій Європейської асоціації кардіологів (2012) діуретики можуть бути використані при необхідності для полегшення ознак та симптомів затримки рідини незалежно від показника ФВ, але не показані для зниження ризику госпіталізацій та смерті (клас І, рівень В) [18]. Згідно Американської асоціації серця (2006-2009) діуретики рекомендують призначати при наявності симптомів затримки рідини (ортопное, симетричні набряки, посилення задухи, пульсація яремних вен, гепатомегалія та симетричні вологі хрипи у легенях) тривало та безперервно [9].
За даними літератури діуретична терапія супроводжується збільшенням активності ангіотензину ІІ (А ІІ) та альдостерону [1, 8, 17]. Неодноразово продемонстровано, що високий плазмений рівень альдостерону ініціює розвиток фіброзу та сприяє накопиченню колагену [3, 4]. Для попередження гіпертрофії лівого шлуночка та стимуляції її регресії обов’язковою є старт-терапія інгібіторами АПФ або блокаторами рецепторів А ІІ. Однак вони тільки транзиторно пригнічують продукцію альдостерону, плазмений вміст якого у хворих з ХСН збільшено на 40% навіть на тлі постійної терапії інгібіторами АПФ. Цей феномен отримав назву «вислизування альдостерону» та значно обмежує терапевтичний ефект інгібіторів ренін-ангіотензинової системи (РАС) [3].
До останнього часу серед петльових діуретиків здебільшого використовували фуросемід. У теперішній час накопичуються дані щодо його негативного впливу на рівень гормональної активності в нирках, на рівень швидкості клубочкової фільтрації (ШКФ) на тлі його значного коливання біодоступності в залежності від рівня білка в плазмі та сечі [8].
Представляє інтерес здатність торасеміду позитивно впливати на РАС [1, 8]. З іншого боку, в експериментальних дослідженнях встановлено, що торасемід блокує вазоспазм і знижує рівень альдостерону в результаті впливу на рівень карбокситермінальної протеїнкінази та зменшення процесу депонування колагену [4]. При цьому позитивний ефект торасеміду щодо альдостерону є особливо важливим, оскільки згідно сучасним уявленням альдостерону відводиться ключова роль в прогресуванні як діастолічної, так й систолічної дисфункції серця [3]. На тлі прийому торасеміду відбувається зниження депонування колагену в міокарді та індексу фіброзу міокарда на 30% (Lopez B. et al., 2007) [17].
Мета роботи – визначити динаміку рівня альдостерону за умов використання петльових діуретиків у хворих на хронічну серцеву недостатність зі збереженою фракцією викиду, обумовлену ішемічною хворобою серця (ІХС), з урахуванням маси тіла.
МАТЕРІАЛИ ТА МЕТОДИ ДОСЛІДЖЕННЯ
У дослідження залучено 42 хворих ( чоловіків – 29, жінок – 13) у віці від 51 до 75 років (середній вік M±m – 68,4±1,17 років) на ХСН ІІ-ІІІ функціонального класу (ФК) згідно класифікації Нью-Йоркської Асоціації серця (NYHA), обумовленою ішемічною хворобою (ІХС), зі збереженою систолічною функцією лівого шлуночка (ФВ більше 45%) з ознаками затримки рідини.
Діагностику ХСН проводили згідно з Наказом МОЗ України № 436 від 03.07.06 р., рекомендаціями Української асоціації кардіологів та Європейського товариства кардіологів [5, 7, 18]. ХСН визначали при наявності об’єктивних та суб’єктивних ознак, притаманних цьому клінічному синдрому, проводили збір анамнестичних даних, фізикальне обстеження та лабораторно-інструментальні методи дослідження.
Критерії включення: наявність ХСН ІІ-ІІІ функціонального класу, обумовлена ІХС; ФВ ≥45%; індекс маси тіла (ІМТ) ≥18,5<40 кг/м2; інформована згода хворого.
Критерії виключення: гостра серцева недостатність, інфаркт міокарду та порушення мозкового кровообігу в анамнезі до 6 місяців, гострі порушення ритму, які обумовлюють порушення гемодинаміки, фракція викиду менше 45%, ХСН І, ІV функціонального класу, ожиріння ІІІ-ІV ступеню, гіпотиреоз, швидкість клубочкової фільтрації (ШКФ) ≤60 мл/хв./1,73м2, захворювання крові.
Стенокардію діагностовано у 31 (73,8%) хворого, у всіх 42 (100,0%) хворих - АГ, в тому числі у 26 (61,9%) – ІІ стадії, у 16 (38,1%) – ІІІ стадії; 11 пацієнтів (26,2%) мали в анамнезі (більше півроку) інфаркт міокарду, 5 (11,9%) – порушення мозкового кровообігу. При обчисленні ІМТ у хворих з ХСН виявлено 18 хворих (42,9%) з ожирінням І-ІІ ступеню (ІМТ 30,0-39,9 кг/м2) , 14 (33,3%) з підвищеним (ІМТ 25,0-29,9 кг/м2) та 10 (23,8%) з нормальним ІМТ (18,5-24,9 кг/м2). Всі пацієнти отримували базисну терапію, відповідно до стандартів лікування хворих на ХСН (Наказ МОЗ України від 03.07.2006 № 436): 41 хворий (97,6%) – інгібітори АПФ, 28 (66,7%) – b-адреноблокатори, 31 (73,8%) – статини, 16 (38,1%) – нітрати, 4 (9,5%) – антагоністи кальцію, антагоністи альдостерону – 9 (21,4%).
Всі обстежені хворі на ХСН, що потребували призначення діуретиків, випадковим чином було розподілено на дві групи. Першу групу склали 26 хворих на ХСН, які в якості діуретика отримували торасемід (препарат Торсид, кампанія «Фармак», Україна), другу - 16 пацієнтів, яким було призначено фуросемід. Окрім діуретиків усі хворі отримували стандартну терапію ХСН, співставну в обох групах. Оцінка клінічної ефективності лікування та динаміки альдостерону проводилась через 10-14 днів. Середні дози для обох препаратів були співставні і склали: 15,0+1,8 мг для торасеміду та 53,8+5,4 мг для фуросеміду (співвідношення середніх доз торасеміду та фуросеміду приблизно 1:3).
Для клінічної оцінки функції нирок визначали рівень креатиніну в сироватці крові та обчислювали швидкість клубочкової фільтрації (ШКФ) за формулою Cocroft-Gault або MDRD (при наявності ожиріння). Визначення ШКФ за формулою Cocroft-Gault проводилось згідно рекомендацій Американської Національної Федерації Нирок [16]. Визначення мікроальбумінурії (МАУ) проводилося імунотурбодіметричним методом з використанням реактиву I.S.E. S.r.l. (Італія) ). Вміст альбуміну оцінювався в першій порції ранкової сечі. Нормальні значення знаходились у діапазоні 0-30 мг/л.
Хворим на початку дослідження та через 14 днів визначали кількісний рівень альдостерону методом імуноферментного аналізу в сироватці крові за допомогою наборів реактивів фірми DRG (Германія). Для цього вранці натщесерце хворим проводився забір 5 мл крові в положенні лежачи у стані спокою не менш ніж 2 години, потім зразок крові центрифугували та заморожували при t -20°С.
Для статистичного аналізу даних використовували ліцензійну програму STATISTICA 6.1. Первинна обробка отриманих даних проводилася методами описової статистики з представленням кількісних даних у вигляді середньої арифметичної (М), її стандартної похибки (±m), 95% довірчого інтервалу (95% СІ). Враховуючи невелику кількість спостережень, а також відхилення від нормального закону розподілу даних в окремих групах та на різних етапах спостереження, для порівняння використовували непараметричні методи: для середніх показників – Т-критерій Вілкоксона (у динаміці), U-критерій Манна-Уїтні (між групами), для відносних показників – критерій Хі-квадрат Пірсона (c2). Для оцінки взаємозв’язку між ознаками виконувався кореляційний аналіз з розрахунком коефіцієнтів рангової кореляції Спірмена (r). Критичне значення рівня значимості (р) приймалося ≤ 0,05.
РЕЗУЛЬТАТИ ДОСЛІДЖЕННЯ
За основними характеристиками досліджені хворі на ХСН достовірно не відрізнялись між собою ( таблиця 1).
Таблиця 1
Клінічні показники у хворих на ХСН у групах дослідження
|
Показник
|
І група,
n=26
|
ІІ група,
n=16
|
p
|
|
Середній вік, роки
|
68,1±1,5
|
68,8±1,8
|
0,864*
|
|
ІМТ, кг/м²
|
29,5±1,0
|
30,6±1,2
|
0,365*
|
|
Стать: чоловіки
Жінки
|
17 (65,4%)
9 (34,6%)
|
12 (75,0%)
4 (25,0%)
|
0,513
|
|
Стенокардія: немає
ФК ІІ
ФК ІІІ
|
5 (19,2%)
12 (46,2%)
9 (34,6%)
|
6 (37,5%)
4 (25,0%)
6 (37,5%)
|
0,294
|
|
Інфаркт міокарду
в анамнезі
|
7 (26,9%)
|
4 (25,0%)
|
0,891
|
|
Стадія АГ: ІІ
ІІІ
|
16 (61,5%)
10 (38,5%)
|
10 (62,5%)
6 (37,5%)
|
0,950
|
|
Ступінь АГ: 1
2
3
|
1 (3,8%)
12 (46,2%)
13 (50,0%)
|
2 (12,4%)
7 (43,8%)
7 (43,8%)
|
0,568
|
|
Цукровий діабет
|
9 (34,6%)
|
5 (31,3%)
|
0,822
|
Примітка. * – рівень значимості (р) різниці між групами за критерієм Манна-Уїтні, в інших випадках – за критерієм c2
У вихідному стані ХСН ІІ ФК (NYHA) виявлено у 30,8% пацієнтів І групи та у 37,5% ІІ групи; ІІІ ФК (NYHA), відповідно, у 69,2% та 62,5% (р=0,653 між групами). За час дослідження на тлі терапії в обох групах встановлена достовірна позитивна динаміка ФК. Так, в І групі ФК в середньому зменшився з 2,69±0,09 до 2,31±0,12 (р=0,005), в ІІ групі – з 2,63±0,13 до 2,25±0,14 (р=0,028) (рис. 1), при цьому різниця між порівнюваними групами не є достовірною (р=0,723). Позитивна динаміка ФК асоціювалась з покращенням самопочуття у хворих. Так, в першій групі скарги на загальну слабкість зменшились на 46,2%; задишку на 61,5%; набряки нижніх кінцівок на 92,3%; болі в ділянці серця на 19,2%; в другій групі – на 37,5; 62,5; 87,5; 12,5% відповідно.
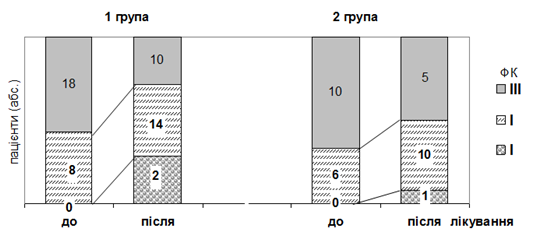
Рис. 1. Динаміка функціонального класу ХСН в групах дослідження
При виконанні тесту з 6-хвилинною ходою в обох групах було виявлено достовірне підвищення толерантності до фізичного навантаження при певній перевазі за умов використання торасеміду (препарат Торсид, кампанія «Фармак», Україна) (рис. 2). В групі з торасемідом відсоток збільшення середньої дистанції при виконанні проби з 6-хвилинною ходьбою склав 17,2±2,6%, в групі з фуросемідом – 9,6±1,4% (р=0,03 між групами).
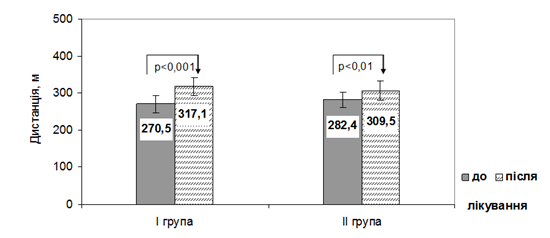
Рис. 2. Динаміка показників (М, 95% CI) толерантності до фізичного навантаження (6-ти хвилинний тест) в групах дослідження
На тлі терапії як фуросемідом, так й торасемідом спостерігалась позитивна динаміка зменшення показників систолічного та діастолічного артеріального тиску (р<0,05), при цьому між групами достовірної різниці не виявлено (р>0,05).
Мікроальбумінурію виявлено у 6 з 42 хворих (14,3%). За час лікування рівень МАУ знижувався в обох групах, але достовірно тільки в групі з торасемідом (р=0,036) (табл. 2). Вірогідної динаміки креатиніну та ШКФ за період спостереження не виявлено.
Таблиця 2
Динаміка рівня МАУ, креатиніну і ШКФ у хворих з ХСН на тлі прийому діуретиків
Таблиця 2
Динаміка рівня МАУ, креатиніну і ШКФ у хворих з ХСН на тлі прийому діуретиків
|
Показники
|
І група (n= 26)
|
Р
|
ІІ група (n=16)
|
р
|
|
МАУ, мг/л
|
До
|
22,9±2,4
|
0,036
|
17,6±2,6
|
0,161
|
|
Після
|
21,3±2,3
|
16,6±2,4
|
|
Креатинін, мкмоль/л
|
До
|
82,8±4,1
|
0,100
|
80,2±3,4
|
0,263
|
|
Після
|
84,9±4,3
|
83,8±4,1
|
|
ШКФ, мл/хв/1,73м2
|
До
|
79,4±3,4
|
0,106
|
85,7±3,6
|
0,235
|
|
Після
|
77,7±3,7
|
82,3±3,5
|
Примітка. р – рівень значимості різниці показників до і після лікування за критерієм Вілкоксона
Встановлено, що петльові діуретики по-різному впливають на рівень альдостерону (табл. 3). Так, в групі фуросеміду встановлено підвищення альдостерону на 8,4%, що може бути оцінено як негативний вплив. В той же час в групі торасеміду такого впливу не виявлено, а навпаки, після лікування зареєстровано певне зниження рівня альдостерону (в середньому на 2,3%) (р<0,001 при порівнянні між групами). Аналіз динаміки концентрації альдостерону на індивідуальному рівні показав її зниження у 16 з 25 хворих І групи (64,0%) і у жодного хворого з ІІ групи (р<0,001).
Таблиця 3
Середні рівні альдостерону (пг/мл) у пацієнтів з ХСН зі збереженою фракцією викиду при лікуванні петльовими діуретиками
|
Період спостереження
|
Торасемід (n=25)
|
Фуросемід (n=16)
|
р1
|
|
До початку терапії, пг/мл
|
628,6±43,5
|
650,2±58,1
|
0,873
|
|
Через 14 днів, пг/мл
|
613,9±45,5
|
704,6±67,9
|
0,323
|
|
D (%), р
|
-2,3% (р=0,041)
|
+8,4% (р=0,005)
|
<0,001
|
Примітка. D – % змін середнього показника, р – рівень значимості різниці показників до і після лікування за критерієм Вілкоксона; р1 – між групами у відповідний період спостереження за критерієм Манна-Уїтні
За результатами кореляційного аналізу встановлено тісний взаємозв’язок між рівнем альдостерону у хворих з ХСН та ІМТ, як на початку дослідження (коефіцієнт кореляції r=0,91; p<0,001), так і під впливом терапії (r=0,88; p<0,001 в І групі і r=0,96; p<0,001 в ІІ групі). З урахуванням цього було проаналізовано динаміку показників альдостерону у підгрупах хворих з нормальною або підвищеною масою тіла та з ожирінням І-ІІ ступеня при різних діуретиках (табл. 4). Встановлено, що початковий рівень альдостерону у хворих з ХСН та ожирінням І-ІІ ступеня майже вдвічі перевищував такий показник у хворих з нормальною або надлишковою масою тіла – 842,4±32,6 пг/мл проти 476,3±23,2 пг/мл (p<0,001).
Таблиця 4
Середні рівні альдостерону (пг/мл) у хворих з ХСН в залежності від ІМТ
при лікуванні петльовими діуретиками
|
Період спостереження
|
Торасемід (n=25)
|
Фуросемід (n=16)
|
|
ІМТ 18,5-29,9
(n=15)
|
ІМТ 30,0-39,9
(n=10)
|
ІМТ 18,5-29,9
(n=8)
|
ІМТ 30,0-39,9
(n=8)
|
|
До початку терапії, пг/мл
|
484,8±30,9
|
844,4±42,1
|
460,3±34,8
|
840,1±54,5
|
|
Через 14 днів, пг/мл
|
463,6±32,5
|
839,4±43,9
|
487,0±31,5
|
922,2±72,3
|
|
D (%), р
|
-4,4% (р=0,007)
|
-0,6% (р=0,878)
|
+5,8%
(р=0,012)
|
+9,8% (р=0,012)
|
Примітка. D – % змін середнього показника, р – рівень значимості різниці показників до і після лікування за критерієм Вілкоксона
За період спостереження в обох групах торасеміду та фуросеміду відзначалось зниження маси тіла на 1,44+0,12 кг (1,68±0,12% від початкової маси тіла) та 1,63+0,17 кг (1,77±0,17%) відповідно (р>0,40 при всіх порівняннях між групами за критерієм Манна-Уїтні). При цьому відсоток зниження маси тіла від початового рівня достовірно не залежав від ІМТ та обраного діуретика.
Рівень альдостерону за обраний термін лікування торасемідом знизився в середньому на 4,4% (р=0,007) у хворих з нормальною або підвищеною масою тіла і практично не змінився у пацієнтів з ожирінням (р=0,878) (таблиця 4). Аналіз динаміки показника на індивідуальному рівні показав його зниження у 12 з 15 хворих з нормальним або підвищеним ІМТ (80,0%) і лише у 4 з 10 хворих (40,0%) з ожирінням (р=0,041 за критерієм c2). На тлі терапії фуросемідом концентрація альдостерону достовірно підвищувалась в обох підгрупах (р=0,012), але більш інтенсивно у хворих з ожирінням.
ОБГОВОРЕННЯ РЕЗУЛЬТАТІВ
Результати багатоцентрового дослідження TORIC, у якому порівнювався фуросемід з торасемідом у хворих з клінічно вираженою серцевою недостатністю, продемонстрували переваги торасеміду не тільки щодо покращення клініко-функціонального стану, але також щодо його впливу на смертність хворих та профілактику кардіоваскулярних ускладнень [10, 14].
Низка досліджень свідчать, що на відміну від фуросеміду, торасемід зменшує продукцію альдостерону, а також попереджує його зв’язування з відповідними рецепторами, в тому числі локально на рівні кардіоміоцитів [4, 17]. Метою нашої роботи було співставити вплив торасеміду на клінічний стан, а також вивчити його можливі додаткові властивості впливати на рівень альдостерону, можливо з урахуванням маси тіла. Вплив торасеміду на рівень альдостерону може бути важливим напрямком тривалого лікування хворих з ХСН. Адже у плацебо-контрольованому дослідженні TOPCAT показано, що альдостерон та обумовлена їм активація мінералокортикоїдних рецепторів викликають виникнення та прогресування міокардіального та судинного фіброзу [23]. Згідно висновків рандомізованих клінічних досліджень RALES, EPHESUS та EMPHASIS антагоністи мінералокортикоїдних рецепторів (спиронолактон, еплеренон) знижують загальну смертність та частоту госпіталізацій у пацієнтів з ХСН [4]. Проте ці дослідження стосуються лише хворих з ХСН та систолічною дисфункцією лівого шлуночка, в той час як при збереженій фракції викиду дані відсутні, хоча питома вага в структурі ХСН таких хворих є досить високою. До того ж не враховувалось можливе значення маси тіла хворих.
Хворі на ХСН досить часто потребують діуретичної терапії з метою попередження ретенції рідини, тому диференційний вибір петльового діуретика є важливим для профілактики ускладнень та представляє перспективний напрямок.
Певним обмеженням нашого дослідження є те, що рівень креатиніну досліджувався лише в плазмі та обраний гострофазовий термін лікування (10-14 днів). За літературними даними при вживанні петльових діуретиків спочатку спостерігається приріст креатиніну переважно в сечі, а з 5-7 доби в плазмі [13]. Тому пролонгація дослідження в більш віддаленому періоді може бути перспективною.
ВИСНОВКИ
1. У хворих на ХСН зі збереженою фракцією викиду рівень альдостерону залежить від маси тіла.
2. Використання фуросеміду у даної категорії хворих виявило підвищення рівня альдостерону, проте на тлі прийому торасеміду рівень альдостерону знижувався. Максимальний негативний вплив зареєстровано у хворих з ожирінням.
3. При клінічній співставленості петльових діуретиків та впливу на рівень креатиніну торасемід мав перевагу щодо рівня мікроальбумінурії.
Список літератури:
1. Гендлін Г.Е.. Современная диуретическая терапия пацие
2. нтов с хронической сердечной недостаточностью / Г. Е. Гендлін, Є. Є. Рязанцева // Клиническая фармакология. – 2012. – №1.
3. Горбась І. М. Епідеміологічні аспекти хронічної серцевої недостатності у дорослого населення України / І. М. Горбась, Л. Г. Воронков // Український кардіологічний журнал. – 2008. – №7.
4. Коваленко В. Н. Сердечно-сосудистые заболевания и ренин-ангиотензиновая система / В. Н. Коваленко, Т. В. Талаева, В. В. Братусь – К.: Морион, 2013. – С. 232.
5. Применение диуретиков при лечении больных с ХСН / Материалы международной конференции с участием профессора Л. Г. Воронкова и профессора Г. П. Арутюнова // Серцева недостатність. – 2013. - №3. – С.79-85.
6. Про затвердження протоколів надання медичної допомоги за спеціальністю «Кардіологія» : Наказ МОЗ України від 03.07.2006 №436. – Режим доступу: www.moz.gov.ua.
7. Распространенность хронической сердечной недостаточности в Европейской части Российской Федерации – данные ЭПОХА–ХСН / И. В. Фомин, Ю. Н. Беленков, В. Ю. Мареев [и др.] // Сердечная недостаточность. – 2006. – Т. 7, № 3 – С. 112–115.
8. Рекомендації Асоціації кардіологів України з лікування хронічної серцевої недостатності у дорослих (перегляд 2011) / Л. Г. Воронков, К. М. Амосова, А. Е. Багрій [та ін.] // Серцева недостатність. – 2011. – № 1. – С. 101-116.
9. Целуйко В. И. Диуретики при сердечной недостаточности: знакомые незнакомцы / В. И. Целуйко // Здоров'я України. – 2011. – Додаток №1. – С. 64-65.
10. 2009 Focused Update: ACCF/AHA Guidelines for the Diagnosis and Management of Heart Failure in Adults // Circulation. – 2009. – Vol. 119. – P. 1977–2016.
11. Ahmed Ali. Heart failure, chronic diuretic use, and increase in mortality and hospitalization: an observational study using propensity score methods / Ali Ahmad, Robert C. Bourge // European Heart Journal – 2006. – Vol.27 (12). – P.1431-1439.
12. Association between use of renin angiotensin system antagonists and mortality in patients with heart failure and preserved ejection fraction / L. H. Lund, L. Benson, U. Dahlstrom, M. Edner // JAMA. – 2012. – Vol. 308 – P. 2108-2117.
13. Borlaug B. A. Heart failure with preserved ejection fraction: pathophysiology, diagnosis, and treatment / B. A. Borlaug, W. J. Paulus // Eur. Heart J. – 2011. – Vol. 32. – P. 670-679.
14. Clinical outcome of renal tubular damage in chronic heart failure. Kevin Damman, Serge Masson, Hans L. Hillege, Aldo P. Maggioni, Adriaan A. Voors [et al.] // Eur. Heart J. – 2011. – Vol. 32 (21). – P. 2705-2712.
15. Cosin Juan. Torasemide in chronic heart failure: results of the TORIC study / Juan Cosín, Javier Díez // European Journal of Heart Failure – 2002. – Vol. 4 (4). – Р. 507-513.
16. Definition and classification of chronic kidney disease: a position statement
from Kidney Disease: Improving Global Outcomes (KDIGO) / A. S. Levey,
K. U. Eckardt, Y. Tsukamoto [et al.] // Kidney Int. – 2005. – Vol. 67. –
P. 2089–2100.
17. Dirk J. van Veldhuisen. Pharmacological treatment of heart failure with preserved ejection fraction: a glimpse of light at the end of the tunnel? / Dirk J. van Veldhuisen, and John J. V. McMurray // European Journal of Heart Failure – 2013. – Vol. 15 (1). – P. 5-8.
18. Effects of loop diuretics on myocardial fibrosis and collagen type I turnover in chronic heart failure / B. Lopez, R. Querejrta, A. Gonzalez [et al.] // J. Am. Coll. Cardiol. – 2004. – Vol. 43 (11) – P. 2028-2035.
19. ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure 2012 // Eur. Heart J. – 2012. – Vol. 33. – P. 1787–1847.
20. Haehling S. Anker Revisiting the obesity paradox in heart failure: new insights? / S. Haehling, W. Doehner, S. D. // Eur. J. Heart Fail. – 2011. – Vol. 13 (2). – P. 130- 132.
21. Heart failure with preserved ejection fraction: clinical characteristics of 4133 patients enrolled in the I-PRESERVE trial / J. J. McMurray, P. E. Carson, M. Komajda, R. McKelvie [ et al.] // European Journal of Heart Fail. – 2008. – Vol. 10. – P. 149–156.
22. Irbesartan in patients with heart failure and preserved ejection fraction. / B. M. Massie, P. E. Carson, J. J. McMurray [et al.] / N. Engl. J. Med. – 2008. – №4. – Р. 359.
23. Prognosis of heart failure with preserved ejection fraction: a 5 year prospective population-based study / C. Tribouilloy, D. Rusinaru [et al.] // Eur. Heart J. – 2008. – Vol. 28, №3. – P. 339-347.
24. Sanderson J. E. Heart failure with a normal ejection fraction / J. E. Sanderson // Heart. – 2007. – Vol. 93. – P. 155–158.