МІНІСТЕРСТВО ОХОРОНИ ЗДОРОВ’Я УКРАЇНИ
НАЦІОНАЛЬНА МЕДИЧНА АКАДЕМІЯ ПІСЛЯДИПЛОМНОЇ ОСВІТИ ім. П.Л. ШУПИКА
Долженко М.М., Перепельченко Н.А., Базилевич А.Я. Ішемічна хвороба серця на тлі цукрового діабету 2 типу: своєрідність перебігу та обгрунтування терапії
Київ – 2010
ЗМІСТ
ПЕРЕЛІК УМОВНИХ СКОРОЧЕНЬ…………………………………………...4
ВСТУП…………………………………………………………………………….6
Глава 1. Механізми ураження серця при цукровому діабеті 2 типу………………………………………………………………………………...9
Глава 2. Клінічні особливості перебігу ІХС у хворих з супутнім цукровим діабетом 2 типу……………………… ………………………………22
Глава 3. Стан гемодинаміки у хворих на ІХС і супутній цукровий діабет 2 типу.
1 Комплексне ехокардіографічне дослідження серця……………...30
2. Стан систолічної та діастолічної функції лівого шлуночка у хворих на ІХС з супутній цукровий діабет 2 типу…………………34
3. Стан інтима-медіального комплексу загальної сонної артерії у хворих на ІХС з супутнім цукровим діабетом 2 типу…………….39
Глава 4. Вплив цукрового діабету на розвиток ішемії міокарда, порушень серцевого ритму та варіабельності серцевого ритму у хворих на ІХС.
1. Методика проведення Холтерівського моніторування ЕКГ з визначенням варіабельносі серцевого ритму………………………..42
2. Вплив цукрового діабету на розвиток больової та безбольвої ішемії міокарда лівого шлуночка……………………………………46
3. Стан вегетативної нервової системи за даними варіабельності ритму серця у хворих на ІХС з супутнім цукровим діабетом 2 типу ………………………………………………………………….48
4. Розвиток суправентрикулярних і шлуночкових порушень ритму у хворих на ІХС з супутнім цукровим діабетом……………………...51
Глава 5. Вплив цукрового діабету на розвиток судинного атеротромбозу: порушення ліпідного обміну та запальних механізмів у хворих на ІХС……………………………………………………………………..55
Глава 6. Сумарний кальцієвий індекс судин у хворих на ІХС з супутнім цукровим діабетом 2 типу
1. Комплексне дослідження серця за допомогою мультиспіральної комп’ютерної томографії…………………………………………...61
2. Кореляційний зв’язок сумарного кальцієвого індексу з маркерами атеросклерозу…………………………………………………………...63
3. Кореляційний зв’язок кальцієвого індексу коронарних судин з показниками екскреторної функції нирок………………………… 69
Глава 7. Вплив гіполіпідемічної терапії на клінічний перебіг ІХС у хворих на цукровий діабет 2 типу………………………………………………73
СПИСОК ЛІТЕРАТУРИ……………………………………………………….81
Перелік умовних скорочень
Ао - аорта
АПФ - ангіотензин-перетворювальний фермент
ББІМ - безбольова ішемія міокарда
БІМ - больова ішемія міокарда
ВНС - вегетативна нервова система
ВРС - варіабельність ритму серця
ГХ - гіпертонічна хвороба
ДАН - діабетична автономна нейропатія
ДД - діастолічна дисфункція
ЕКГ - електрокардіографія
ЕхоКГ - ехокардіографія
ЗСА - загальна сонна артерія
ЗХС - загальний холестерин
ІМ - інфаркт міокарда
ІММ - індекс маси міокарда
ІА - індекс атерогенності
ІХС - ішемічна хвороба серця
КДІ - кінцево-діастолічний індекс
КДО - кінцево-діастолічний об’єм
КДР - кінцево-діастолічний розмір
КК - кліренс креатиніну
КСІ - кінцево-систолічний індекс
КСО - кінцево-систолічний об’єм
СКІ - сумарний кальцієвий індекс
ЛП - ліве передсердя
ЛШ - лівий шлуночок
ЛПВЩ - ліпопротеїди високої щільності
ЛПНЩ - ліпопротеїди низької щільності
ЛПДНЩ - ліпопротеїди дуже низької щільності
МШП - міжшлуночкова перегородка
МКТ - мультиспіральна комп’ютерна томографія
МК - мітральний клапан
ІНЦД - інсуліннезалежний цукровий діабет
ПІКС - постінфарктний кардіосклероз
СВТ - суправентрикулярна тахікардія
СЕ - суправентрикулярна екстрасистолія
НК - недостатність кровообігу
ТГ - тригліцериди
ФВ ЛШ - фракція викиду лівого шлуночка
ХМ ЕКГ - Холтерівське моніторування ЕКГ
ЧСС - частота серцевих скорочень
ЦД - цукровий діабет
ШЕ - шлуночкова екстрасистолія
ШТ - шлуночкова тахікардія
ШКФ - швидкість клубочкової фільтрації
HbA1c% - глікозильований гемоглобін
DТ - час сповільнення ранньо-діастолічного потоку
IVRT - час ізоволюмічної релаксації лівого шлуночка
S - систолічна швидкість руху метрального клапана
PSV - пікова систолічна швидкість кровоплину
EDV - кінцево-діастолічна швидкость кровоплину
ВСТУП
Цукровий діабет (ЦД ) являє собою одну з провідних медико-соціальних проблем сучасного суспільства, що обумовлено високою захворюваністю та його поширеністю, частим виникненням хронічних мікро- та макросудинних ускладнень. ІХС у хворих ЦД 2 типу зустрічається в 2-4 рази частіше, ніж серед людей того ж віку без діабету [15, 74]. Слід зауважити, що 3 з 4 хворих цукровим діабетом помирають від причин, пов'язаних з атеросклерозом, і в більшості випадків (75%), від ішемічної хвороби серця (ІХС) [28, 24, 100]. Реальна кількість хворих в нашій країні на ЦД складає близько 2-2,5 млн. і це є медико-соціальною проблемою в плані серцево-судинної захворюваності [8, 16].
За даними Фремінгемського дослідження, навіть, після коректування даних за віком, курінням, рівнем артеріального тиску та вмістом загального холестерину у крові, наявність ЦД підвищувала ризик розвитку ІХС у чоловіків на 66 % та у жінок на 203 % [74]. У Whitehall Study відмічено зростання ризику не тільки при явному діабеті, але і при субклінічних формах порушення толерантності до глюкози [42]. Дослідження MRFIT (Multiple Risk Factor Intervention Trial), що включало велике число чоловіків (n=5163) середнього віку, дало детальнішу інформацію про взаємодію між діабетом і іншими ризик-факторами у визначенні коронарного ризику. Було виявлено, що ЦД є незалежним від вмісту загального холестерину (ЗХС), куріння і артеріального тиску (АТ) чинником ризику. Відмічено також, що у чоловіків, хворих на ЦД, наявність інших чинників ризику значно підвищує 12-річну серцево-судинну смертність [42 ].
Результати епідеміологічних досліджень свідчать про те, що ризик коронарних ускладнень у хворих на ЦД без ІХС дорівнює ризику у хворих, які вже мають клінічні прояви ІХС. Так, за даними S. Haffher et al. [90] при 7-річному спостереженні інфаркт міокарда (ІМ) або коронарна смерть зустрічалися у 20 % пацієнтів з ЦД і лише у 3,5 % пацієнтів без діабету. У групі хворих, які страждають на ЦД і перенесли ІМ, повторний ІМ та смерть спостерігалися в 45% випадків, на відміну від хворих без ЦД 2 типу, у яких подібні стани зустрічалися в 18,8% випадків. Аналогічні дані отримані S. G.Wannamethee et al. [196]: частота серцево-судинних подій у хворих на ЦД чоловіків, які перенесли ІМ, складала 50,2%, тоді як у чоловіків без діабету, що перенесли ІМ, - 29%. При цьому ризик коронарної смерті у хворих діабетом і ІХС перевищував в 3 рази ризик у хворих ІХС або діабетом окремо. За даними метааналізу 37 проспективних досліджень, ризик коронарної смерті, що асоціюється з діабетом, у жінок на 50 % вище, ніж у чоловіків [167].
У Третьому звіті ради експертів Національної освітньої програми по холестерину в США [40] пацієнти з ЦД 2 типу за ступеням ризику ускладнень і, відповідно, стратегії гіполіпідемічної терапії прирівнюють до хворих, які вже мали ІХС. Це положення внесене і в Європейські рекомендації по профілактиці серцево-судинних захворювань [68, 69].
Проблема зниження смертності від серцево-судинних захворювань, які є основним чинником смертності хворих з ЦД 2 типу, залишається предметом особливої уваги сучасної медицини, служби охорони здоров'я, всього суспільства. При ураженні серцево-судинної системи вмирають 65-70% хворих з ЦД 2 типу [17].
Гипертриглицеридемія зі зниженням рівня ліпопротеїдів високої щільності — типова зміна ліпідного профілю при цукровому діабеті 2 типу. Уявляється логічним використання фібратів одночасно з рекомендаціями по зниженню маси тіла. При застосуванні статинів дослідники відзначають безсумнівне зниження серцево-судинної захворюваності. Рекомендовано енергійне лікування пацієнтів з цукровим діабетом для досягнення рівня загального холестерину нижче 5,0 ммоль/л (ліпопротеїдів низької щільності, нижче 3,0 ммоль/л). Додаткове призначення фібратів дозволяє корегувати тригліцеридемію. У випадку відсутності явних ознак атеросклерозу ризик розвитку ІХС у найближчі 10 років складає 30%.[41, 42].
Таким чином, за допомогою багатоцентрових міжнародних досліджень з вивчення ІХС у сполученні з ЦД 2 типу було виявлено ряд проблем, які пов'язані з перебігом та методами лікування ІХС, однак і на теперішній час недостатньо визначено перебіг та прогноз у цієї групи хворих, не розроблені об'єктивні клініко-діагностичні критерії розвитку ускладнень ІМ, залишаються невирішеними проблеми вибору патогенетично обґрунтованих методів лікування ІХС у сполученні з ЦД 2 типу. Розробка цього напрямку дозволить розробити заходи вторинної профілактики та прогнозувати перебіг ІХС у сполучені з ЦД, своєчасно призначити хворим додаткові медикаментозні методи лікування. Таким чином, наявність багатьох невирішених питань, що потребують вивчення, і визначили мету і завдання проведення даного дослідження.
Глава 1. 1. Механізми ураження серця при цукровому діабеті 2 типу
Цукровий діабет – це група метаболічних захворювань, що характеризується гіперглікемією у результаті дефекту секреції інсуліну, функціональної активності інсуліну або їх комбінації [16].
Найбільш характерною ознакою інсулінорезистентності є гіперглікемія при абсолютній або відносній гіперінсулінемії. Проте в деяких випадках підвищення рівня інсуліну нормалізує вміст глюкози в крові внаслідок персистуючої гіперінсулінемії [186, 188].
Можливо, що інсулінорезистентність є патофізіологічною основою інших метаболічних порушень, що є чинниками ризику, і разом з гіперінсулінемією може бути ключовою ланкою в етіології та патогенезі таких захворювань, як ІХС, АГ і ІНЦД.
Інсулін має на серце пряму і непряму дію. Пряма дія полягає у збільшенні надходження глюкози та лактату у міокард і стимуляції їх окислення. Інсулін збільшує та стимулює активність глюкозотранспортного білка 4 (ГТБ 4) і перенесення ним глюкози у міокард, активує гексокеназу і глікогенсинтетазу, збільшує утворення глікогену у міокарді [14].
Його непрямий ефект полягає в регулюючому впливі рівня жирних кислот і кетонових тіл у плазмі крові, гальмуванні ліполізу і кетогенезу в печінці (після їжі). Інсулін знижує концентрацію жирних кислот і кетонових тіл у плазмі крові, пригнічує їх надходження до серця. В умовах дефіциту інсуліну і інсулінорезистентності вказані механізми порушуються. Змінюється метаболізм глюкози і жирних кислот, зменшується кількість і активність ГТБ 4 і перенесення ними глюкози в клітини. В плазмі крові підвищується концентрація жирних кислот і знижується надходження глюкози і лактату до серця [14].
Епідеміологічні дослідження свідчать про існування зв'язку між рівнем глікозильованого гемоглобіну, ризиком розвитку серцево-судинних захворювань із смертельним ісходом захворювання. При збільшенні рівня глікозильованого гемоглобіну на 1 % ризик розвитку серцево-судинних захворювань зростає на 10 % [16, 22, 42].
Розвитку інсулінорезистентності сприяє ряд чинників. Перш за все це генетично обумовлене зниження числа інсулінових рецепторів, що приводить до дефіциту глюкозотранспортних білків. У розвитку інсулінорезистентності можуть мати значення мутації генів (гена субстрата інсулінового рецептора, гена глікогенсинтетази, гормон-чутливої ліпази, β-адренорецепторів та ін.), а також молекулярні дефекти білків, що передають сигнали інсуліна (збільшення експресії Rad-белка і UPC-1 - інгібітора тирозинкінази інсулінового рецептора у м'язовій тканині, зниження мембранної концентрації і активності внутрішньоклітинних транспортерів глюкози - GLUT-4 у м'язовій тканині) [16] .
Велика роль у розвитку інсулінорезистентності належить зовнішнім чинникам, серед яких перше місце займає андрогенне або абдомінальне ожиріння. Не менш важливим є і зниження об'ємного кровотоку у капілярах скелетних м'язів, пов'язане з вазоконстрикцією. В результаті зниження об'ємного кровотоку в скелетних м'язах збільшується шлях дифузії глюкози до клітин.
Вісцеральна жирова тканина на відміну від жирової тканини іншої локалізації багатше іннервована, має ширшу мережу капілярів і безпосередньо сполучається з портальною системою. Вісцелярні адипоцити мають високу щільність β-адренорецепторов (особливо β3-типа), кортикостероїдних і андрогених рецепторів і відносно низьку щільність β2-адренорецепторів і рецепторів до інсуліну. Ці особливості визначають високу чутливість вісцераної жирової тканини до ліполітичної дії катехоламінів і низьку - до антиліполітичної дії інсуліну. Крім того, встановлено, що жирова тканина володіє ауто-, пара- і ендокринною функцією і секретує велику кількість біологічно активних речовин, здатних викликати розвиток супутніх ожирінню ускладнень, у тому числі і інсулінорезистентність. Між ступенем розвитку абдомінально-вісцерралної жирової тканини і вираженістю інсулінорезистентності існує пряма залежність [2, 34, 16].
Отже, патогенез метаболічного синдрому (МС) можна уявити приблизно таким чином: викликана тими чи іншими причинами інсулінорезистетність супроводжується компенсаторним збільшенням синтезу і секреції інсуліну β-клітинами острівцевого апарату підшлункової залози. Як слідство розвивається хронічна гіперінсулінемія. Поєднання інсулінорезистентності та гіперінсулінемії є пусковим моментом для цілого ряду метаболічних порушень.
Хронічна гіперінсулінемія веде до прискорення реабсорбції натрію у ниркових канальцях. Відповідно збільшується реабсорбція води, підвищується хвилинний об'єм крові (ХОК). Оскільки інсулін відноситься до гормонів, регулюючих трансмембраний іоний транспорт, то при гіперінсулінемії збільшується внутрішньоклітинна концентрація Na+ і К+, що супроводжується підвищенням чутливості гладкої мускулатури судин до пресорного впливу норадреналіну і ангіотензину II та зростанню загального периферійного опору судин (ЗПОС). Зростанню ПО сприяє і порушення синтезу оксиду азоту, пов'язане з підвищенням концентрації у крові вільних жирних кислот, що особливо часто має місце при абдомінальному ожирінні.
При абдомінальному ожирінні у вісцелярних адипоцитах зважаючи на недостатню антиліполітичну активність інсуліну посилюється ліполіз, і переважно у воротну вену поступає надмірна кількість вільних жирних кислот (ВЖК). У печінці ВЖК перешкоджають зв’язуванню інсуліна гепатоцитами, викликаючи розвиток інсулінорезистентності на рівні печінки. Це супроводжується зниженням екстракції інсуліну печінкою і розвитком системної гіперінсулінемії [16].
У свою чергу гіперінсулінемія порушує ауторегуляцію інсулінових рецепторів, що підсилює периферичну інсулінорезистентноіть. Крім того, ВЖК пригнічують гальмівну дію інсуліну на глюконеогенез, сприяючи збільшенню продукції глюкози печінкою, перешкоджають утилізації глюкози міоцитами, що також сприяє розвитку гіперглікемії і компенсаторній гіперінсулінемії.
Оскільки інсулін регулює синтез печінкою ліпопротеідів дуже низької щільності (ЛПДНЩ), підвищення його концентрації у крові супроводжується зростанням синтезу тригліцеридів (ТГ). Одночасно з цим знижується активність ліпопротеінліпази - ферменту, який також знаходиться під контролем інсуліну і при інсулінорезистентності виявляється нечутливим до його впливу. Зниження ліполітичної активності плазми веде до уповільнення елімінації ЛПДНЩ. В результаті у крові підвищується концентрація ЛПДНЩ, ТГ. Варто відзначити, що при інсулінорезистентності частинки ЛПДНЩ відрізняються меншим розміром, володіють щільнішим ядром холестерину, активніше підхоплюються з кровотоку відповідними рецепторами, і в результаті вони самі виявляються «високоатерогеними». У свою чергу пониження активності ліпопротеінліпази супроводжується пониженням змісту ліпопротеінів високої щільності (ЛПВЩ), оскільки вони утворюються в організмі у процесі гідролізу ЛПДНЩ. Більш того, гіперінсулінемія підсилює катаболізм ЛПВЩ [15, 28, 34].
Таким чином, інсулінорезистентність і гіперінсулінемія супроводжуються розвитком дисліпідемії, що характеризується підвищенням концентрації ТГ та зниженням концентрації ЛПВЩ, в плазмі крові. Необхідність збереження гомеостазу та оптимальних для кровопостачання органів і тканин параметрів реологій крові вимагає видалення з кровотоку надмірної кількості ліпідів. Цей процес припускає залучення всіх можливих захисних систем організму і може здійснюватися різними шляхами [33, 34].
Відомо, що купферовскі клітини печінки, макрофаги та інші клітини можуть поглинати надмірну кількість ЛПНЩ та ЛПДНЩ при їх переокисном окисленні. Поглинання модифікованих ЛПНЩ за допомогою "скевенджер-рецепторів" дозволяє клітині акумулювати більшу кількість ЛПНЩ, ніж при з'єднанні нативних ЛПНЩ з високоафінними рецепторами. Але при цьому модифіковані ЛПНЩ і ЛПДНЩ володіють антигеними властивостями і ініціюють розвиток аутоімуних реакцій, яким у даний час відводиться істотна роль в атерогенезі. До того ж, які б механізми не були задіяні в процесі елімінації ЛПНЩ і ЛПДНЩ, однією з основних можливостей видалення надлишку з кровотоку є відкладення їх у судинній стінці. Виникненню таких відкладень сприяє вищезазначене утворення липопереокисей, що володіють підвищеною атерогенністю. До того ж проникненню ліпідів у стінку артерій, тобто розвитку атероматозу, сприяє і сама гіперінсулінемія. Оскільки стінки судин є інсуліночутливими, то під впливом надлишку інсуліну збільшується активність рецепторів ЛПНЩ на поверхні ендотелію судин і зростає проникненість ендотелію для ліпідів. Підвищення концентрації у крові інсуліну приводить до посиленої проліферації гладком'язових клітин і фібробластів, активації синтезу колагену - однієї із основних складових атеросклеротичного пошкодження. Будучи фактором росту, інсулін стимулює утворення і інших речовин з подібною дією, наприклад інсуліноподібних факторів росту 1 і 2. Все це приводить до звуження просвіту артерій і зростання ПО. Це положення підтверджують і численні експериментальні дослідження на тваринах, і той факт, що активна инсулінізація хворих цукровим діабетом, може, за даними ряду авторів, підвищити ризик атеросклеротичного ураження великих судин [141, 178] .
Відомо, що гіперінсулінемія сприяє розвитку порушень у плазмовій ланці гемокоагуляції. При гіперінсулінемії зростає продукція фібриногену, розвивається гіперфібриногенемія і підвищується активність інгібітору тканинного активатора плазміногена I типу, що веде до зниження фібринолізу [13, 103].
Гіперінсулінемія зростає в залежності від розвитку інсулінорезистентності. Це продовжується до тих пір, поки β-клітини острівцевого апарату підшлункової залози зберігають здатність до збільшення секреції інсуліну. Проте з певного моменту гіперсекреція інсуліну виявляється недостатньою для підтримки нормальної чутливості тканин до глюкози, компенсаторні можливості підшлункової залози виснажуються, розвивається цукровий діабет 2-го типу.
Отже, гіперінсулінемія спочатку є компенсаторною реакцією на інсулінорезистентність і направлена на підтримку нормального транспорту глюкози до клітини.
Крім того, при ЦД виникненню гемореологічних змін сприяють численні чинники: розвиток гіпоксемії і ацидозу, порушення водно-електролітного, білкового і жирового обміну. Було виявлено підвищення агрегаційної здатності еритроцитів і тромбоцитів, поява у крові багатовимірних агрегантів формених елементів крові з уповільненням її текучості аж до стазів, порушення в структурі тромбоцитів. Виявлено збільшення в´язкістних характеристик крові з підвищенням її гемостатичної активності і тенденцією до падіння загальної фібринолітичної активності крові із зміною плазмових чинників згортуваності і, перш за все, наростанням рівня фібриногену і продуктів його розпаду. Виявлені зміни у більшості хворих цукровим діабетом, а, особливо, у хворих на тлі гіпертонічної хвороби і атеросклерозу, дослідники трактують, як хронічний перебіг синдрому диссемінованого внутрішньосудинного згортання крові [33, 68].
На основі шести проспективних епідеміологічних досліджень доведено, що підвищення рівня фібриногену супроводжується збільшенням ризику розвитку кардіоваскулярної патології в 2,3 рази [68] .
Розвиток гострих серцево-судинних ускладнень асоціюється з наступними гемореологічними порушеннями: підвищенням рівня фібриногену і чинника VII Віллебранта, низькою фібринолітичною активністю, що частіше зустрічається у хворих на цукровий діабет.
У дослідженні DECODE доведено, що постпрандіальна гіперглікемія (ПГ) є незалежним чинником впливу на смертність від кардіоваскулярних ускладнень, причому значнішим, ніж рівень HbA1 [44] .
Крім того, дослідженням DIS підтверджено, що рівень ПГ, а не рівень глюкози крові натщесерце визначає частоту виникнення серцево-судинних ускладнень. Встановлено також, що гіперглікемічні "піки", що виникають після їжі, є наслідком випадіння ранньої фази секреції інсуліну у хворих з ЦД 2 типу та тісно корелюють з частотою ризику смертності від сердцево-судинних захворювань. Гіперглікемія через 2 години після їжі більш ніж в 2 рази збільшує ризик розвитку фатальних серцево-судинних ускладнень у пацієнтів старшої вікової групи [111] .
Макроваськулярні ускладнення починають розвиватися на етапі порушення толерантності до глюкози (ПТГ). Встановлено, що у хворих з порушеною толерантністю до глюкози глибоке пригнічення ендотеліальної функції виявляється через 1 годину після навантаження 75г глюкози і поліпшення її через 2 години, у порівнянні із здоровими особами, у яких вона повністю відновлюється. У хворих на ЦД 2 типу поліпшення ендотеліальної функції через 2 години після навантаження глюкозою взагалі не відбувається.
Багаторічними проспективними дослідженнями з проблеми ЦД була багато разів підтверджена провідна роль гіперглікемії у формуванні пізніх ускладнень захворювання [91, 189] .
Проте встановлено, що компенсація ЦД не дозволяє повністю запобігти розвитку і прогресуванню пізніх ускладнень. До того ж існують величезні труднощі в підтримці нормоглікемії впродовж тривалого часу [8] .
Відомо, якщо розглядати гіперінсулінемію і персистуючу гіперглікемію як предиктори атеросклерозу, то патогенез і морфогенез діабетичного ураження серця обумовлені не тільки впливом гіперінсулінемії на ендотелій судин, енергетичні і метаболічні процеси в міокарді, але і безпосередньо пов'язані з токсикометаболічним пошкодженням кардіоміоцитів [32, 111]. Причиною прижиттєвого руйнування структур кардіоміоцитів, порушення структури сарколеми і її дериватів, зміни іонної рівноваги і зниження активності актоміозинового комплексу кардіоміоцитів, швидше за все, є пряма глюкозотоксичність і виражена тканинна гіпоксія [29, 32].
До основних механізмів реалізації ефекту гіперглікемії відносяться: активація поліолового шляху метаболізму глюкози (сорбіт/ альдозоредуктаза); глікозилірування різних білків; вплив окислювального стресу; підвищення ролі диацилгліцеринів та активізація ізоформ протеінкінази [2, 5].
У фізіологічних умовах в організмі є постійний баланс між рівнем вільних радикалів (оксидантів) і активністю системи антиоксидантного захисту. У нормальних умовах вільні радикали швидко нейтралізуються природними жиро- та водорозчинними антиоксидантами (АТ). Проте у хворих на ЦД рівень природних АТ істотно знижений, що приводить до патологічного підвищення кількості реактивних радикалів, тобто до окислювального або, так званого "оксидативного" стресу [30, 71].
Надмірна кількість продуктів перекисного окислення ліпідів (ПІВ) зумовлює цитотоксичну дію, що приченяє пошкодження мембран еритроцитів, лізосом. При цьому змінюється структура мембран клітит аж до їх розриву, інгібується активність цитохромоксидази. [170]
Описані порушення сприяють посиленню процесів пероксидації ліпідів і зміни якісних характеристик липопротехїдів з їх накопиченням в пінявих клітинах, що є основою атеросклерозного ураження великих судин. Модифіковані липопротеіди також беруть участь у пошкодженні ендотеліальних клітин, сприяючи розвитку мікроангіопатії. [5, 32, 71].
Останніми роками на базі визначення маркерів запалення (С-реактівного білка, прозапальних цитокінів - інтерлейкін-1, інтерлейкін-6, інтерлейкін-12, фактора некрозу пухлини, сировоткового амілоїду А, гаптоглобіну, фібриногену) з'явилися клінічні і експериментальні дані, які підтверджують, що одним з патогенетичних механізмів атеросклерозу є генералізоване або хронічне запалення [133, 141]. Перш за все, вивчається питання про вплив запального компоненту на розвиток атеросклерозу у хворих цукровим діабетом ΙΙ типу на ранніх стадіях його розвитку. При обстеженні 1139 хворих ЦД 2 типу у віці 40-70 років, як і у осіб з порушеною толерантністю до вуглеводів, було виявлено значне підвищення числа лейкоцитів, концентрації С-реактівного білка (СРП) і фібриногена в сироватці крові у порівнянні з контрольною групою не залежно від статі і віку хворих. [184].
Викликаючи агрегацію частинок ЛПДНЩ і ЛПНЩ в атеромі, СРП полегшує їх захоплення макрофагами. Таким чином, можна припустити, що СРП грає провідну роль в розвитку негативних ефектів при судинному запаленні, викликаючи не тільки ініціацію і прогрес, але і дестабілізацію атероми [2, 21, 49].
СРП характеризується швидкою і вираженою відповіддю на запальні стимули, він з'являється і зникає раніше, ніж змінюється ШОЕ при запальному процесі, таким чином СРП можна використовувати для контролю ефективності лікування [169].
У численних дослідженнях була доведена здатність високочутливого СРП визначати як первинний, так і віддалений прогноз при ІХС [49, 58, 64]. Вважається, що СРП може бути навіть більш значущим предиктором розвитку серцево-судинних ускладнень, ніж такі чинники, як рівень холестерину ЛПНЩ, співвідношення рівнів ЗХС і ТГ [165].
СРП і фібриноген є загальноприйнятими маркерами, що характеризують активність генералізованного запалення, встановлений тісний взаємозв'язок змісту CРП і фібриногену в плазмі крові і ризику розвитку серцево-судинних захворювань [63, 110, 169]. За даними метааналізу, високі рівні Фібриногену асоціювалися з підвищенням ризику розвитку серцево-судинних подій в 1,8 раза, що може бути обумовлене стимуляцією фібриногеном агрегації тромбоцитів і проліферації гладком'язових клітин [63]. Рівень амілоїда є предиктором смерті у хворих з нестабільною стенокардією і осіб, що перенесли трансплантацію серця [21, 29].
Відомо, що в патогенезі атеросклерозу важливу роль грають імунні порушення. Особлива роль в індукції судинних пошкоджень відводиться прозапальним цитокінам - інторлейкінам (ІЛ-9-ІЛ-2, ІЛ-6, ІЛ-8), фактору некроза пухлини ФНП-альфа, що секретується антигенпрезентуючими клітинами і лімфоцитами, інфільтруючими атеросклеротично змінені судини. Прозапальні цитокіни підсилюють експресію адгезивних молекул, рекрутують у вогнище атеросклерозного запалення клітини загальнозапального призначення і підвищують їх функціональну активність, стимулюють прокоагулянтну активність ендотелію. Цитокіни здатні порушувати метаболізм ліпопротеідів, підсилювати процеси модифікації ліпідів у судинній стінці, а деякі з них можуть бути маркерами гострого коронарного синдрому[161].
Міокард при ЦД 2 типу ушкоджується незалежно від розвитку атеросклерозу коронарних судин і АГ. Клінічно ушкодження міокарду проявляється прогресуючою серцевою недостатністю при вираженому ступені пошкодження міокарду, а також різними порушеннями ритму [32].
Відповідно до сучасних уявлень кардіальні порушення при ЦД виникають унаслідок метаболічних змін у міокарді і атеросклерозу коронарних артерій, розвитку діабетичної нейропатії і мікроангіопатії [4, 32]. Перераховані процеси приводять до розвитку міокардіодистрофії або ІХС що нерідко супроводжуються нейропатією серця.
Патогенез міокардиальних порушень включає 3 основні механізми: пошкодження кардіоміоцитів, мікроциркуляторні і нейровегетативні порушення. Перший механізм пов'язаний з порушенням метаболізму кардіоміоцитів, що доведене морфологічними дослідженнями, які дозволили виявити ультраструктурні ознаки пошкодження всіх видів обміну речовин в кардіоміоцитах і, в першу чергу, зниження ефективності енергетичних, пластичних процесів і зміну іонного метаболізму. Ці порушення створюють основу зниження скоротливої функції міокарду [29, 42].
Другий - грунтується на пошкодженні дрібних артерій міокарду, як одного з проявів генералізованої мікроангіопатії, що характерна для ЦД і включає зміни дрібних судин нирок, очей, нервової системи та ін. органів [20].
На основі гістоультраструктурних досліджень ендоміокарда при використанні матеріалу, отриманого при эндоміокардиальній біопсії, патоморфологи виділили, як у хворих ЦД 2 типу з вираженими ознаками коронарного атеросклерозу, так і без нього, комплекс характерних змін: гіпертрофія кардіоміоцитів, дифузний склероз інтерстиціальних тканин, накопичення альфа- і бета-глікогена, ліпідна інфільтрація кардіоміоцитів, мікромітохондріоз з вираженим поліморфізмом, розширення канальців саркоплазматичної мережі, розширення і поглиблення Т-системи, гіперплазія пластинчастого комплексу (Гольджі) з появою гранул, локальний міоцитоліз. Виявлений спазм артеріол із витонченням їх стінок, осмиофілія ендотеліоцитів, адгезія формених елементів крові, сладж-феномен, потовщення базальної мембрани судин, наявність незрілих еластичних волокон, аморфного преципітату і різноспрямованих колагенових волокон. Капілярне русло також характеризувалося різкою осміофілією ендотелію, зниженням активності мікропіноцитозу, розширенням і розшаруванням базальної мембрани капілярів, явищами сладжа еритроцитів, адгезією еритроцитів і тромбоцитів або утворенням тромбів в просвіті капілярів і венул. Вказані морфологічні зміни виникали ще до розвитку атеросклерозних бляшок і створювали основу для їх виникнення [181].
Розвиток гіалінозу і потовщення базальної мембрани мікросудин міокарду при ЦД 2 типу знижує здатність артеріол до вазодилятації, що призводить до вираженого зменшення перфузії і обмеження ауторегуляторного потенціалу[164].
Третій механізм включає ураження вегетативної нервової системи і, як результат, формування нейровегетодистрофії. При морфологічному дослідженні виявлений розвиток апоптичної дегенерації, втрата синаптичних пузирків, поява великих вакуолей в цитоплазмі симпатичних гангліїв.
Підтвердженням ураження вегетативної нервової системи у хворих ЦД є морфологічні дослідження, що виявляють розширення гангліонарних клітин (гігантські симпатичні нейрони), укорочення міжвузлових проміжків в білих гілках паравертебрального симпатичного ланцюжка, вакуолізацію нейронів і колбоподібне розширення нервових клітин в автономних симпатичних гангліях [66, 91]. У автономних нервових пучках і гангліях була виявлена їх інфільтрація лімфоцитами і макрофагами, що свідчило про наявність запальних імунологічних процесів, а також зниження середньої щільності мієлінізованых волокон у нерві каротидного синуса.
Основними ознаками діабетичної кардіонейропатії є тахікардія у спокої, "фіксований пульс", ортостатична гіпотонія і безбольова форма ішемії або ІМ.
Збільшення активності симпатичного відділу ВНС при зниженні парасимпатичної активності в нічні години супроводжується порушенням фібринолітичних властивостей крові і розвитком гіперкоагуляції, що створює умови для виникнення серцево-судинних катастроф в нічний і уранішній часи доби [14, 181]. При прогресуванні кардіонейропатії тахікардія зникає у зв'язку з подальшим виснаженням симпатичного відділу вегетативної нервової системи.
Відомо, що основна роль у ремоделюванні периферійних судин надається атеросклерозу, прогресуванню якого у хворих з ЦД сприяє порушення кальцієвого гомеостазу. Порушення кальцієвого гомеостазу пов'язане із зміною співвідношення активності паращитовидних залоз і С-клітин щитовидної залози, що секретують паратгормон та тіреокальціотонін. Деякі дослідники вважають, що рівень паратгормона може бути маркером початку потенційного пошкодження гладкої мускулатури судин [53]. Доведено збільшення базальних рівнів паратгормону і тіреокальціотоніну у хворих цукровим діабетом [192]. На основі гіперсекреції вказаних гормонів і виявлені кореляційних зв'язків з судинними показниками на різних стадіях судинних порушень можна припустити наявність напруги кальцієвого обміну. Відомо, що паратгормон сприяє виходу кальцію з депо і його відкладенню в дрібних судинах. Концентрація кальцію в цитоплазмі один з чинників, що визначають скоротливі властивості гладком'язових клітин судин. Зниження внутріклітинного кальцію порушує утворення актоміозинового комплексу в м'язових клітинах. У серці блокується проведення імпульсів, порушується процес автоматизму. Надлишок Са2+ усередині клітини приводить до збільшення зростання опору судин, дефіциту АТФ. Порушується здібність еритроцитів до деформації при проходженні через капіляри, що впливає на в'язкість крові. [193, 194].
У хворих з ЦД виявляють порушення обміну кальцію у тромбоцитах, яке може зумовити їх підвищену здібність до агрегації [194].
Глава 2
Клінічні особливості перебігу і лікування хворих на ІХС з супутнім ЦД 2 типу
Найбільш ранньою ознакою ураження міокарда при ЦД є поява дисфункції діастоли з подовженням релаксації діастоли з подальшим приєднанням дилатації порожнини лівого шлуночку і розвитком прогресуючої серцевої недостатності (застійна кардіоміопатія), порушень ритму. Про наявність ригідності діастоли міокарду свідчить, за даними ехокардіографії, більш виражене підвищення кінцевого тиску діастоли в порівнянні з кінцевим об'ємом діастоли лівого шлуночку. Порушення скоротливої функції міокарду виявляється клініцистами у хворих цукровим діабетом навіть на тлі компенсації метаболізму і відсутності мікро - і макроангіопатій, гіпертензії [107].
Патогенез збільшення жорсткості міокарду, на думку більшості кардіологів, пов'язаний з порушенням транспорту кальцію, електромеханічним дисбалансом, що супроводжується асинхронністю розслаблення і механічними чинниками [46]. Важливе значення надається внутрішньокардіальному чиннику - дезорганізації м'язових волокон гіпертрофованого міокарда.
Для діабетичного серця характерний фіброз міокарду, який може бути пов'язаний з порушенням внутрішньоклітинного метаболізму NO і кальцію, а також з проліферативними процесами, обумовленими дією інсуліну та інсуліноподібного фактору роста. Такі чинники ризику як АГ і дисліпідемія прискорюють розвиток або сприяють прогресуванню діабетичної кардіоміопатії [17]. Приєднання ІХС ускладнює її течію. Вираженість цього синдрому залежить від ступеня гіпертрофії лівого шлуночку, при невеликій тривалості захворювання він поєднується з гіперкінетичним синдромом [32].
Оскільки зростання кардіоваскулярного ризику в значній мірі пов'язане з підвищенням АТ, заходи по його зниженню у хворих ЦД повинні бути особливо агресивними (клас I, рівень доведення А) [89].
У дослідженнях UKPDS і НОТ доведено, що інтенсивна антигіпертензивна терапія у хворих ЦД асоціюється з нижчою частотою кардіоваскулярних ускладнень [94, 189]. Ризик розвитку різних ССЗ, включаючи інсульт і захворювання нирок, був значно нижчий у пацієнтів, рівень АТ яких контролювали ретельніше. Загальноприйнято, що цільовий АТ у хворих ЦД повинен бути нижче (<130/80 мм рт. ст. (клас I, рівень довідності В), ніж у осіб без ЦД (<140/90 мм рт. ст.) [68, 69]. У хворих з діабетичною нефропатією терапія, за умови її хорошої переносності, повинна бути направлена на досягнення ще нижчих значень АТ [69]. На початкових етапах інтенсивного антигіпертензивного лікування може спостерігатися підвищення рівня сировоточного креатиніну, проте віддаленим результатом такої терапії є поліпшення функції нирок [20, 68, 69].
Основою лікування всіх хворих з АГ є дотримання рекомендацій по зміні способу життя. Проте для адекватного контролю АТ у більшості пацієнтів цього заходу зазвичай недостатньо і потрібне застосування фармакологічного лікування, часто комбінації декількох антигіпертензивних препаратів (клас I, рівень довідності А) [68, 69].
Як препарати стартової терапії доведеною ефективністю володіють діуретики, β-адреноблокатори (ББ), блокатори кальцієвих каналів (БКК) і інгібітори АПФ. У декількох дослідженнях (UKPDS, FACET, ABCD, CAPPP, STOP-2) доведено, що в лікуванні АГ у хворих ЦД з високим кардіоваскулярним ризиком особливо важлива блокада ренін-ангіотензин-альдостеронової системи. З метою запобігання або уповільнення розвитку мікроальбумінурії у осіб з ЦД і АГ інгібітори АПФ як стартова терапія ефективніші, ніж БКК .
Головною метою лікування гапертензіі у хворих ЦД є зниження АТ, менш важливо - за допомогою яких препаратів або їх комбінації це буде досягнуто. Проте в схему терапії повинен бути включений інгібітор ренін-ангиотензин-альдостеронової системи (клас 1, рівень доведення А) [69]. Важливо також моніторирувати функцію нирок при застосуванні інгібітору АПФ або БРА, враховуючи ризик її погіршення за наявності стенозу ренальных артерій (клас I, рівень довідності А). [68, 69].
Впродовж останніх десятиліть активно обговорюється питання про те, чи надають різні гіпотензивні засоби значний вплив на віддалені результати лікування у зв'язку з їх метаболічними ефектами. Встановлено, що застосування тіазидів і ББ пов'язане з підвищенням ризику розвитку ЦД 2 типу, на відміну від використання БКК і інгібіторів ренін-ангіотензин-альдостеронової системи. Проте невідомо, чи мають ББ і/або тіазиди у пацієнтів із встановленим ЦД 2 типу яку-небудь клінічно значиму несприятливу дію на обмін речовин, включаючи підвищений ризик виникнення серцево-судинних подій. У дослідженні ALLHAT клінічні результати істотно не відрізнялися в підгрупах хворих, що отримували діуретики, інгібітори АПФ або БКК[185]. Таким чином, очевидно, слід уникати застосування засобів з негативними метаболічними ефектами, особливо комбінації тіазидів і ББ, як препаратів першого вибору у хворих з АГ і метаболічним синдромом. Проте у пацієнтів із встановленим ЦД така мета, як зниження АТ, визначається важливішою, ніж незначні порушення метаболізму [89].
ІХС у хворих на ЦД може розглядатись як макроангіопатія коронарних судин, макроангіопатія, яка у своїй більшості є наслідком прискореного атеросклерозу - атероматозного процесу, що розвивається раніше і прогресує швидше у хворих цукровим діабетом у порівнянні із загальною популяцією. Крім атеросклерозу в крупних артеріях виявляється кальциноз середньої оболонки артерій (склероз Менкеберга) і дифузний артеріофиброз [14].
На підставі здійснення проекту TRAS (2003), що передбачав спостереження 1192 чоловік з різною толерантністю до вуглеводів, у хворих ЦД було встановлено більш швидке прогресування атеросклерозу сонних артерій, ніж у осіб без ЦД. Це положення підтверджувалося вимірюваннями товщини внутрішньої і середньої оболонки сонної артерії. Приріст їх товщини у внутрішній сонній артерії у рік складав 30-36 мкм порівняно з особами без цукрового діабету (17,7 мкм); у ділянці загальної сонної артерії приріст відповідно складав - на 33,8 і 7,5 мкм. Отримані дані дослідники пов'язують з наявністю атерогенного профілю чинників ризику у хворих цукровим діабетом [187].
Коронарний атеросклероз у хворих ЦД характеризується множинністю стенозів у проксимальній і дистальній частині однієї і тієї ж судини, переважанням дрібних, гемодинамічно незначущих стенозів. Багатосудине ураження коронарних артерій підтверджене численними дослідженнями [32], а також ретроспективним аналізом 1133 коронарограм хворих ЦД (порівняно з 9300 хворими без ЦД), яким була проведена перкутана ангіопластика[104]. При цьому, ангіографично визначений колатеральний кровоток спостерігається тільки у 10,3 % хворих ЦД в порівнянні з 41,5 % у осіб без діабету, що може бути обумовлене, наявністю специфічної мікроангіопатії, пошкодженням ендотелію і нездатністю виділення останнім судинорозширювальних чинників, а також відсутністю достатнього градієнта перфузійного тиску на тлі превалювання дрібних звужень коронарних артерій. [32]
Відсутність адекватного колатерального кровотоку разом з прогресуючим атеросклерозом коронарних судин, визначеного за допомогою ангіографії, може бути причиною поганого прогнозу захворювання і гіршого виживання з частим розвитком серцевої недостатності після ІМ.
Останніми роками велика увага приділяється оцінці стратифікації ризику фатальних аритмій і раптової серцевої смерті, виникнення яких збільшується при зниженні скоротливої функції міокарду і виникненні аритмій високих градацій [11]. З цією метою проводять вивчення стану електричної стабільності міокарду за допомогою інвазивного електрофізіологічного дослідження або неінвазивних методів - усередненої електрокардіографії високого посилення для виявлення пізніх потенціалів шлуночків; оцінки стану автономної нервової системи шляхом реєстрації параметрів варіабельності ритму серця; визначення дисперсії інтервалу QT.
У пацієнтів з ЦД типу 2 виділяють ліпідну тріаду або атерогений фенотип: збільшення рівня ТГ ЛПДНЩ, які є основними носіями ТГ; зниження рівня ХС ЛПВЩ; збільшення малої щільності частинок ЛПНЩ фенотипа В при відносно невисоких значеннях ХС ЛПНЩ [91, 180]. Збільшення кількості всіх фракцій ТГ в крові після перенесеного ІМ характерний для пацієнтів з високим ризиком розвитку реинфаркта [49 ].
Був розроблений блок рекомендацій ESC\EASD 2007г. що до підтримання оптимального рівня ліпідів крові [68]:
• Високий рівень ХС ЛПНЩ і низький рівень ХС ЛПВЩ вважаються чинниками ризику ССЗ у хворих ЦД (клас1, рівеньА).
• Статини є препаратами першого вибору терапії, направленої на зниження рівня ХС ЛПНЩ у пацієнтів з ЦД (клас1, рівеньА).
• У хворих ЦД, страждаючих ССЗ, статини необхідно призначати незалежно від початкового рівня ХС ЛПНЩ, цільові значення якого повинні складати < 1,8-2,0 ммоль/л (<70-77 мг/дл) (клас1, рівеньВ).
• Питання про застосування статинів слід розглядати при призначенні лікування дорослим пацієнтам з ЦД ΙΙ типа та ССЗ у випадку, якщо концентрація загального ХС >3,5 ммоль/л (>135 мг/дл); метою лікування є зниження рівня ХС ЛПНЩ на 30-40% (клас ΙΙ Ь, рівеньВ).
• Рішення про доцільність призначення статинів пацієнтам у віці 18-39 років, страждаючим ЦД 2 типу, повинно прийматися з урахуванням інших чинників ризику, таких як нефропатія, поганий глікемічний контроль, ретінопатія, гіпертензія, гіперхолестеринемія, симптоми метаболічного синдрому або даних сімейного анамнезу про раннє ушкодження судин(клас ПВ, рівень С)
• У хворих діабетом з гіпертригліцеридемією >2 ммоль/л (177 мг/дл), яка утримується після нормалізації рівня ХС ЛПНЩ унаслідок застосування статинів, рекомендується інтенсифікувати статинотерапію. Таким чином можна досягти другорядної мети лікування - зниження рівня холестерину не-ЛПВЩ. В деяких випадках доцільна комбінована терапія з використанням як додаткових препаратів - нікотинової кислоти або фібратів (клас ПВ, рівеньВ).
ІХС у хворих ЦД має ряд клінічних особливостей, до яких, перш за все, відносять - ранній розвиток і важкий перебіг. Клінічно ІХС може проявлятися нападами стенокардії, які в початковій стадії розвитку виникають при фізичній або емоційній напрузі (стенокардія напруги). При прогресуючому атеросклерозі коронарних артерій виникає стенокардія спокою. При електрокардіографічному дослідженні виявляються ознаки ішемії міокарду (субендокардіальна - позитивні "коронарні" зубці Т, субепікардіальна –«від’ємні коронарні" зубці Т). Пошкодження міокарду підтверджуються зсувом сегмента S-T (горизонтальне, косонизхідне) у вигляді зниження (субепікардіальне) або його підйому (субендокардіальне) по відношенню до ізолінії. Вказані зміни на ЕКГ у спокої можуть не реєструватися і виявляються тільки після нападу стенокардії або фізичного навантаження.
Ризик розвитку ІМ є дуже високим незалежно від статі у хворих з ЦД. Характерною особливістю ІМ є розвиток атипових форм: синкопальної, безбольової, гастролгічної. Гострий ІМ у хворих ЦД можна запідозрити npи появі гострих порушень серцевого ритму і провідності, npи розвитку гострої лівошлуночкової недостатності або колапсу. Нерідко при гострому ІМ розвивається кетоацидоз або раптова декомпенсація ЦД. Розвиток повторних ІМ може бути причиною аневризми лівого шлуночку, стійких порушень ритму, хронічної недостатності серця.
Зберігає своє значення, для діагностики ІМ, і визначення активності ферментів - креатинфосфокінази (КФК), та її МВ фракції (MB КФК), лактатдегідрогенази (ЛДГ) і її ізофермента 1 (Лдг1), аспартат-амінотрансферази (АСАТ). Причиною їх підвищення при ІМ є руйнування міокардіальних клітин і вихід клітинних ферментів, що вивільняються, у кров.
Погіршує прогноз і збільшує частоту пошкодження коронарних артерій вегетативна дисфункція. При наявності кардіальної автономної нейропатії у хворих цукровим діабетом ІМ закінчується летально в 19-53 % випадків. Перераховані особливості перебігу інфаркту міокарда при ЦД пояснюють вищу летальність при даній патології в порівнянні з хворими гострим ІМ без ЦД. Загальний показник смертності при спостереженні за хворими впродовж 10 років після перенесеного ІМ складає 29 %.
Серед хворих ЦД безбольова форма ішемії міокарда зустрічається у 30-60%, що в 3 рази перевищує частоту такої у осіб без цукрового діабету [15, 66].
Клініцисти відзначають, що "німі" форми ІХС часто ведуть до гострої коронарної недостатності і раптової коронарної смерті у 30-42% хворих ЦД. Дебют ІМ буває безбольовим і протікає в астматичному, церебральному, аритмічному варіанті, а нерідко безсимптомно.
Глава 3. Стан гемодинаміки у хворих на ІХС з супутнім цукровим діабетом 2 типу
3.1 Комплексне ехокардіографічне дослідження серця.
Ехокардіографічне дослідження серця проводили за допомогою апарата Medison SonoAce 9900 (Південна Корея). Використовували загальноприйняту методику Комітету по стандартизації і номенклатурі двомірної ехокардіографії Американської Асоціації Серця, запропоновану в 1981 р.
Спочатку отримували парастернальне зображення по довгій осі ЛШ (лінія між верхівкою серця та правим грудинно-ключичним суглобом), з якого отримували розміри ЛП, діаметр ЛШ в діастолу (одночасно з моментом початку комплексу QRS), товщину міжшлуночкової перетинки (МШП) та задньої стінки ЛШ в діастолу, діаметр аорти на рівні аортальних стулок, діастолічний розмір, оцінювали стан сегментарної скоротливості середнього та базального сегментів МШП та задньої стінки ЛШ. З цього ж доступу оцінювали вихідний відділ правого шлуночка по довгій осі з метою реєстрації систолічного потоку в легеневій артерії методом імпульснохвильової доплерехокардіографії (можливість непрямої оцінки ступеню легеневої гіпертензії).
З парастернального підходу отримували зображення по короткій осі ЛШ на рівні мітрального клапана, папілярних м'язів та верхівки ЛШ з метою оцінки скоротливості базального, середнього та апікального сегментів МШП, нижньої, задньої, бокової та передньої стінок ЛШ.
З верхівкового чотирикамерного зображення ЛШ оцінювали сегментарну скоротливість базального та середнього відділів бокової стінки ЛШ і МШП, а також скоротливість верхівки. З цього ж підходу реєстрували трансмітральний потік методом пульсової доплерехокардіографії, оцінювали функцію атріо-вентрикулярних клапанів; при наявності зворотного потоку проводили його картування.
З верхівкового підходу отримували також двокамерне зображення ЛШ, з якого оцінювали скоротливість базального та середнього сегментів нижньої, передньої стінок і верхівки ЛШ.
З верхівкового п’ятикамерного зображення методом пульсової доплерографії реєстрували систолічний потік в аорті.
Дослідження систолічної і діастолічної функції серця.
В останній час з’явилося багато робот відносно прогностичного значення ремоделювання міокарда [118, 120, 151] та діастолічної дисфункції [66, 70-73] ЛШ у хворих після ГІМ [157-160]. Поширюється застосування радіонуклідних методів дослідження діастолічної функції ЛШ [150]. Доплерівська ехокардіографія - безпосереднє та неінвазивне вимірювання швидкостей потоків крові - зарекомендувала себе як надійний метод оцінки діастолічної функції ЛШ [59, 70].
Кінцево-систолічний (КСО) та кінцево-діастолічний (КДО) об’єми та ФВ ЛШ вимірювались у апікальному дво- та чотирьох-камерному доступах біплановим методом дисків за Симпсоном [59]. Використовувалось середнє арифметичне трьох вимірів. Кінцево-систолічний (КСІ) та кінцево-діастолічний індекси (КДІ) розраховувались як відношення, відповідно, КСО та КДО до розрахункової площі поверхні тіла. Пульсовий доплер швидкостей трансмітрального кровопотоку був отриманий з апікальної чотирьохкамерної позиції за допомогою установки пробного об’єму між кінчиками стулок мітрального клапану. Всі дані доплерівського дослідження були розраховані виходячи з середніх даних п’яти послідовних серцевих циклів. При цьому оцінювались наступні параметри: час ізоволюмічної релаксації ЛШ (IVRT) (датчик встановлювали на межі вихідного та вхідного відділі ЛШ), амплітуди швидкостей раннього та пізнього наповнення ЛШ та їх співвідношення (Е, А; Е/A), час сповільнення ранньо-діастолічного наповнення ЛШ (DT), а також часові інтеграли швидкостей раннього та пізнього наповнення ЛШ та їх співвідношення до загального інтегралу діастолічного кровопотоку (Еl, Al, Еl/Tl, Al/Tl). При встановленні пробного об’єму у війсті легеневих вен, що візуалізуються, вимірювали швидкості антеградних систолічного та діастолічного кровопотоку, та співставляли тривалість діастолічного ретроградного кровопотоку з тривалістю хвилі А трансмітрального кровопотоку для диференційної діагностики псевдонормального наповнення ЛШ.
Тканинна допплерографія мітрального кільця
Швидкісні показники руху міокарда ЛШ записувались на рівні кільця мітрального клапану (МК) з використанням імпульсно-хвильової тканинної допплерівської візуалізації (ТДВ) датчиком з фазово-кристалічною решіткою та частотою випромінювання 2.0-4.0 MHz.
Швидкості руху кільця МК визначалися в 4-х позиціях з апікальних 4- та 2-камерного доступів (септальній, латеральній, передній та задній сегменти) з послідовним розрахунком середнього арифметичного значення, що використовувалось для оцінки діастолічної функції ЛШ [Schiller N.B., Recommendations for quantization of the left ventricle by two-dimensional echocardiography / Schiller N.B., Shah P.M., Crawford M., et al.// J. Am. Soc. Echocardiosr. – 1989. – 2. – Р. 358-367.]. При цьому фіксувалися три основні швидкості: пікова систолична швидкість руху МК по направленню до верхівки (S, см/с) та дві пікові негативні діастоличні швидкісті руху МК по направленню до основи сердця в ранню (e’, см/с) та піздню (a’, см/с) фази діастоли та їх співвідношення (e’/a’) (рис. 2.1). Крім того, оцінювали интегральний индекс стану діастолічної функції та тиску наповнення ЛШ – співвідношення швидкості ранньо-діастолічного трансметрального потоку Е до швидкості ранньо-діастолічного руху МК е’ – E/e’ (нормальне значення <8,0 у.о.) [1]. Використовували середні арифметичні значення трьох послідовних циклів. Кольорове картування в М-режимі використовували для розрахунку швидкості розповсюдження діастолічного потоку в порожнині ЛШ (Vp, см/с) (рис. 2.2) та комбінованого показника співвідношення швидкості ранньо-діастолічного потоку Е до Vp (Е/Vp, нормальне значення <1,5 у.о., 1,5-2,5 у.о. – граничне значення, >2,5 – наявна ознака підвищення тиску наповнення ЛШ), що є чутливим предиктором стану діастолічної функції та тиску наповнення ЛШ [Мірошник М. Методика оцінки тиску наповнення лівого шлуночка за допомогою ехокардіографії // Чернігів, ТОВ Санте Інтеграль. – 2006. – 13 С.].
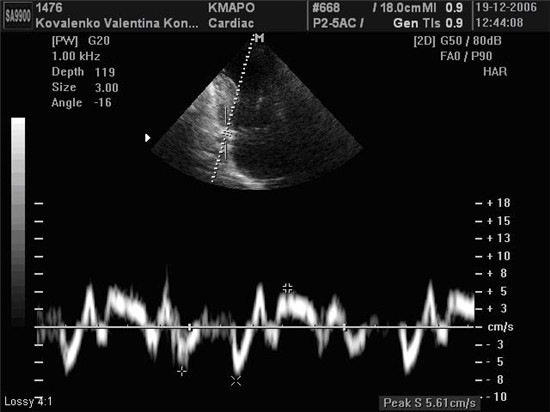
Рис. 2.1 Запис швидкостей руху кільця МК з заднього сегмента у хворого на ІХС з ГХ.
Примітки:
e’ – ранньодіастолічний рух кільця МК.
a’ – пізньодіастолічний рух кільця МК.
S – систолічний рух кільця МК (власне спостереження).
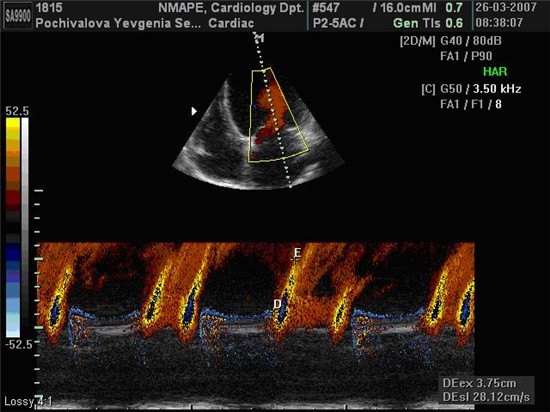
Рис. 2.2 Приклад визначення швидкості розповсюдження діастолічного потоку в порожнині ЛШ за даними кольорового картування в М-режимі.
Дуплексне сканування екстракраніальних судин
Дуплексне сканування екстракраніальних судин проводилося на ультразвуковому апараті SonoAce 9900 (“Medison”, Південна Корея) лінійним датчиком з частотою випромінювання ультразвуку 5.0-9.0 MHz за стандартною методикою. При цьому проводилося вимірювання інтимо-медіального комплексу (ІМК) загальних сонних артерій на відстані 1см від їх біфуркацій справа і зліва та наступні допплерівські показники підчас допплерографії кровоплину загальних сонних артерій: пікової систолічної швидкості (PSV, см/с), кінцево-діастолічної швидкості (EDV, см/с) кровопотоку, співвідношення PSV та EDV (S/D, у.о.) та індексу резистентності загальних сонних артерій (RI, у.о.) справа і зліва.
3.2 Стан систолічної та діастолічної функції лівого шлуночка у хворих на ІХС з супутнім цукровим діабетом 2 типу
У хворих з ІХС та ЦД 2 типу (100 пацієнтів) у порівнянні з хворими без ЦД ( 30 пацієнтів) були достовірно більшими поперечний розмір лівого передсердя (ЛП) (3,97±0,4 у порівнянні з 3,73±0,45, р=0,01), ступінь гіпертрофії ЛШ за даними товщини стінок та індексу маси міокарда ЛШ (121,87±23,11 у порівнянні з 98,21±44,7, р<0,01) та порожнина ЛШ за даними індексів кінцево-діастолічного (КДІ) (49,99±13,29 у порівнянні з 41,05±15,01, р<0,01) та кінцево-систолічного (КСІ) (21,35±11,2 у порівнянні з 15,67±8,51, р<0,01) об’ємів ЛШ. При цьому не було достовірної різниці у групах дослідження та контролю у глобальній скоротливості ЛШ за даними ФВ ЛШ (60,33±8,32% у порівнянні з 60,73±5,63%, р=0,8), що свідчить про більш виражене ремоделювання ЛШ у хворих з комбінацією ІХС та ЦД 2 типу незалежно від стану глобальної скоротливості ЛШ (табл. 4.1).
Таблиця 3.1. Стан лівих відділів серця та показників систолічної функції ЛШ у хворих на ІХС
|
Показники
|
ІХС + ЦД 2 типу
M±SD, (n1=100)
|
ІХС без ЦД
M±SD,(n2=30)
|
p
|
|
Корінь Ао,
|
3,22±0,39
|
3,26±0,33
|
р=0,61
|
|
ЛПс, см
|
3,97±0,40
|
3,73±0,45
|
р=0,01
|
|
МШПд, см
|
1,29±0,23
|
1,20±0,16
|
р<0,05
|
|
ЗСЛШд, см
|
1,30±0,14
|
1,13±0,21
|
р<0,001
|
|
ІММ ЛШ, г/м2
|
121,87±23,11
|
98,21±44,7
|
р<0,001
|
|
КДІ, мл/м2
|
49,99±13,29
|
41,05±15,01
|
р=0,002
|
|
КСІ, мл/м2
|
21,35±11,20
|
15,67±8,51
|
р=0,01
|
|
ФВ, %
|
60,33±8,33
|
60,73±5,63
|
р=0,80
|
Примітка. р – достовірність
Показники діастолічної функції та переднавантаження ЛШ також достовірно розрізнялися між групами. При цьому достовірно були підвищені як швидкісні, так і часові показники трансмітрального кровотоку. Показники повздожньої скоротливості ЛШ за даними тканинного допплеру мітрального кільця також достовірно розрізнялися, при чому у хворих з комбінацією ІХС та ЦД 2 типу нижчими були як діастолічна (7,85±2,18 у порівнянні з 9,81±3,49, р<0,001), так і систолічна (8,067±2,36 у порівнянні з 10,72±2,64, р<0,0001) швидкість мітрального кільця, що вказує на порушення систолічної повздовжньої функції ЛШ та більш глибокі дистрофічні зміни субендокардіального шару міокарда ЛШ незалежно від ФВ ЛШ. Закономірно, що у зв’язку з вищенаведеними даними, комбіновані показники переднавантаження ЛШ E/E’ та E/Vp також були достовірно більшими у групі дослідження порівняно з групою контролю (таб. 4.2).
Таблиця 3.2. Стан показників діастолічної функції та переднавантаження ЛШ у хворих на ІХС
|
Показники
|
ІХС та ЦД 2 типу
M±SD, (n1=100)
|
ІХС без ЦД
M±SD,(n2=30)
|
p
|
|
Е/A, у.о.
|
0,75±0,26
|
0,89±0,25
|
р=0,010
|
|
DT, мс
|
202,40±42,85
|
178,33±32,80
|
р=0,0053
|
|
IVRT, мс
|
106,77±24,73
|
96,33±22,51
|
р=0,041
|
|
Е’, см/с
|
7,85±2,18
|
9,81±3,49
|
р=0,0003
|
|
S’, см/с
|
8,07±2,36
|
10,72±2,64
|
р<0,0001
|
|
IVRTТД,мс
|
83,80±20,39
|
71,66±23,20
|
р=0,0065
|
|
E/Vp, у.о.
|
1,96±0,66
|
1,38±0,43
|
р<0,0001
|
|
E/E’, у.о.
|
9,16±2,82
|
8,06±2,04
|
р=0,049
|
Примітка. р – достовірність
При дослідженні взаємозв'язку та кореляції між показниками внутрішньосерцевої гемодинаміки та показником атеросклеротичного ураження міокарда – суммарного кальцієвого індексу судин СКІ за даними МСКТ позитивного кореляційного зв’язку визначено не було. Незалежно від наявності ЦД 2 типу в групах дослідження та контролю не було знайдено взаємозв’язку між СКІ та ФВ (r=0,22 та r=0,17, відповідно). Так само, у групах дослідження та контролю індекси діастолічного наповнення (Е/A: r=0,31 та r=0,27, відповідно) та переднавантаження ЛШ (E/E’: r=-0,27 та r=-0,24, відповідно) не корелювали з СКІ.
В дослідженні не було виявлено кореляції між глобальною систолічною функцією ЛШ (ФВ, %) та маркерами атеросклеротичного процесу (ІМК ЗСА, ІА, СРП, ЗХС) як у групі дослідження, так і в групі контролю (табл.4.3).
Таблиця 3.3. Кореляція ФВ ЛШ (%) з маркерами атеросклеротичного процесу у хворих на ІХС
|
Показники
|
ІХС та ЦД 2 типу
M±SD, (n1=100)
|
ІХС без ЦД
M±SD,(n2=30)
|
Р
|
|
ІМК ЗСА, у.о.
|
r=0,14
|
r=0,23,
|
p=0,65
|
|
ІА, у.о.
|
r=0,03
|
r=0,03,
|
p=1,0
|
|
СРП, у.о.
|
r=0,12
|
r=0,25,
|
p=0,51
|
|
ЗХС, ммоль/л
|
r=0,14
|
r=0,28,
|
p=0,48
|
Примітка. р – достовірність
Між показниками діастолічного наповнення (E/A) та переднавантаження ЛШ (E/E’) та маркерами атеросклеротичного процесу (ІМК ЗСА, ІА, СРП, ЗХС) в групах дослідження та контролю не було виявлено значущої кореляції (табл. 4.4).
Таблиця 3.4. Кореляція E/A (у.о.) та E/E’ (у.о.) з маркерами атеросклеротичного процесу у хворих на ІХС
|
Показники
|
ІХС та ЦД 2 типу
M±SD, (n1=100)
|
ІХС без ЦД
M±SD, (n2=30)
|
|
|
E/A
|
E/E’
|
E/A
|
E/E’
|
|
ІМК ЗСА, у.о.
|
r=0,24
|
r=0,33
|
r=0,20, p=0,84
|
r=0,15, p=0,36
|
|
Продовж. Табл.3.4
|
|
Показники
|
ІХС та ЦД 2 типу
M±SD, (n1=100)
|
ІХС без ЦД
M±SD, (n2=30)
|
|
|
E/A
|
E/E’
|
E/A
|
E/E’
|
|
ІА, у.о.
|
r=-0,04
|
r=-0,25
|
r=-0,14, p=0,63
|
r=-0,29, p=0,83
|
|
СРП, у.о.
|
r=-0,40
|
r=0,05
|
r=-0,31, p=0,62
|
r=-0,23, p=0,37
|
|
ЗХС, ммоль/л
|
r=-0,31
|
r=-0,19
|
r=-0,38, p=0,70
|
r=-0,14, p=0,80
|
Примітка. р – достовірність
Таким чином, нами не було знайдено кореляційного взаємозв’язку між показниками внутрішньосерцевої гемодинаміки та ступенем атеросклеротичного ураження міокарда ЛШ та маркерами активності атеросклеротичного процесу незалежно від наявності у хворих з ІХС ЦД 2 типу. Цьому може існувати декілька пояснень.
По-перше, ступінь погіршення показників систолічної функції та навантаження ЛШ прямо залежить від ступеня ураження власно серцевого м’язу, та не може прямо свідчити про характер метаболічних змін та стан судин внаслідок атеросклерозу.
По-друге, порушення діастолічної функції ЛШ є наслідком будь-якого патологічного процесу, що призводить до зниження еластичності та підвищення жорсткості міокарду, та є найбільш раннім показником міокардіальної дисфункції ЛШ, передуючи порушенню систолічної функції ЛШ. Подібні результати спостерігаються у хворих з ізольваною артеріальною гіпертензією або ІХС за данними літератури [196,199].
Враховуючи наявність артеріальної гіпертензії у 100% досліджених хворих як у групі дослідження, так і в групі контролю, наявність діастолічної дисфункції в них є припустимою навіть за відсутності коронарних подій в анамнезі. Хоча ЦД 2 типу істотно сприяє прогресуванню атеросклеротичного процесу, і є одним з головних чинников серцево-судинних катастроф, та міокардіальна функція є безпосередньо пов’язаною з наявністю міокардіофіброзу внаслідок ішемії та гіпертензії [112-114, 199], а вплив ЦД 2 типу на міокардіальну дисфункцію не прямим, а опосередкованим.
З іншого боку, в групі дослідження були достовірно більш виражені ознаки ремоделювання, зниження повздовжньої скоротливості ЛШ при незміненій глобальній скоротливості та гірші показники діастолічної дисфункції та переднавантаження ЛШ, такі як розмір лівого передсердя та комбіновані показники E/E’ та E/Vp, що свідчить про більш глибоке загальне порушення міокардіальної функції при комбінації ІХС та ЦД 2 типу.
Таким чином, можна зробити висновок, що хоча глобальна скоротливість та показники переднавантаження ЛШ не є прямо пов’язаними з маркерами системного атеросклеротичного процесу, наявність ЦД 2 типу у хворих ІХС прискорює прогресування ремоделювання ЛШ та поглиблює міокардіальну дисфункцію ЛШ, що також є одним з пояснень більш високого ризику кардіальних подій при наявності у хворих на ІХС супутнього ЦД 2 типу за даними літератури [179,182,196].
3.3 Стан інтима-медіального комплексу загальної каротидної артерії у хворих з ІХС на тлі цукрового діабету 2 типу
Один з найбільш інформативних та визнаних показників ранньої діагностики атеросклерозу сьогодні – це товщина комплексу інтима-медіа (ІМК) загальних сонних артерій (ЗСА), тобто товщина двох згаданих оболонок артерії, що відображає загальну течію атеросклеротичного процесу та чітко корелює з захворюваністю та смертністю: при збільшенні товщини ІМК на кожні 0,1 мм (нормальні значення 0,6 – 0,9 мм) ризик ГІМ збільшується на 11%, тому товщина ІМК все частіше використовується для контролю ефективності антиатеросклеротичної терапії та використання засобів, що сповільнюють судинне ремоделювання [74, 79].
Ці дані є надзвичайно важливими, тому що доведено, що параметр товщини інтим/медіа є незалежним предиктором розвитку ГІМ та мозкового інсульту. Необхідно підкреслити, що ці дані були незалежними від впливу медикаментозної терапії на рівень артеріального тиску, що є додатковим доказом плейотропної антиатеросклеротичної дії ряду сучасних засобів, що використовуються сьогодні в лікуванні серцево-судинних захворювань [74, 83].
При дослідженні параметрів кровопотоку екстракраніальних судин було виявлено, що в групі дослідження у хворих з ІХС, комбінованою з ЦД 2 типу були достовірно підвищені середня систолічна та діастолічна швидкості кровопотоку у загальних каротидних артеріях та індекс резистентності загальних каротидних артерій (середня величина) на фоні достовірно більшої товщини інтимо-медіального комплексу (ІМК) (табл. 4.5).
Таблиця 3.5. Стан показників дуплексного сканування загальних каротидних артерій у хворих на ІХС
|
Показник
|
ІХС та ЦД 2 типу
M±SD, (n1=100)
|
ІХС без ЦД
M±SD, (n2= 30)
|
|
ІМК, см
|
0,14±0,04
|
0,1±0,03, р<0,001
|
|
PSV, см/c
|
32,41±9,7
|
26,06±6,00, р<0,001
|
|
EDV, см/c
|
7,86±2,83
|
6,70±1,35, р=0,032
|
|
S/D, у.о.
|
4,34±1,12
|
3,91±0,64, р=0,047
|
|
RI, у.о.
|
0,75±0,06
|
0,68±0,08, р<0,001
|
• Примітка. р – достовірність
Таким чином, у хворих на ІХС у комбінації з ЦД 2 типу було виявлено достовірне збільшення ІМК ЗСА, що є незалежним предиктором гострих кардіо- та цереброваскулярних подій [154,167], та індексу резистентності екстракраніальних судин, показника підвищення жорсткості судинної стінки, що співпадає з літературними даними [137].
Резюмуючи вище викладене слід зауважити: наявність ЦД 2 типу у хворих ІХС є фактором ризику гострих коронарних подій, що підтверджується зниженням міокардіальної функції ЛШ та змінами внутрішньосерцевої гемодинаміки. Збільшення ІМК ЗСА та RI ЗСА, як маркерів загального атеросклеротичного процесу, у хворих на ІХС у комбінації з ЦД 2 типу свідчить про підвищений ризик гострих судинних подій, виходячи з даних сучасних публікацій [136-137, 167].
Глава 4. Вплив цукрового діабету 2 типу на розвиток ішемії міокарда, порушень серцевого ритму та варіабельності серцевого ритму у хворих на ІХС
Складність діагностики ІХС у хворих на ЦД обумовлена частим асимптомним і атиповим перебігом ІХС [14, 22, 66].
До специфічних чинників формування кардіоваскулярних захворювань при ЦД слід віднести прогресуючу деінервацію серця і судин у результаті діабетичної автономної нейропатії (ДАН).
Кардіоваскулярна форма ДАН – особливо тривожний знак. Її проявами можуть бути: тахікардія спокою (фіксований серцевий ритм, синдром денервації серця); аритмії; ортостатична гіпотензія; безбольова ішемія і інфаркт міокарда; артеріальна гіпертензія; гіперчутливість судин до катехоламінів; зниження толерантності до фізичного навантаження; зміни ЕКГ (дипресія інтервалу ST, подовження інтервалу QT, інверсія позитивного зубця Т, псевдокоронарний підйом сегмента ST); раптова смерть. Навіть доклінічна стадія кардіоваскулярної ДАН погіршує прогноз життя, збільшує ризик раптової смерті [14, 66]. Ураження аферентних вісцеральних нервів, що йдуть від серцевого м'яза, призводить до того, що ішемія/інфаркт міокарда при ЦД - можуть протікати без болю. У хворих на ЦД кожен третій ІМ є безбольовим[14, 191].
Відсутність характерного больового синдрому може бути причиною невчасного розпізнавання ішемії та ІМ, що затримує призначення необхідної терапії. Втрата больової чутливості означає відсутність лімітуючого чинника при навантаженні, що, відповідно, підвищує ризик розвитку ІМ. Саме безбольовий інфаркт міокарду є однією з причин раптової смерті при ЦД [16, 17].
З метою дослідження впливу ЦД 2 типу на особливості розвитку ішемії міокарду нами було обстежено 100 хворих стабільної ІХС, з супутнім ЦД 2 типу. Групу контролю склали 30 пацієнтів подібних за перебігом ІХС, СН та віком без супутнього ЦД.
Усім пацієнтам проводилося 24-годинне Холтерівське моніторування ЕКГ.
4.1 Методика проведення Холтерівського моніторування ЕКГ з визначенням варіабельності серцевого ритму
Добове ХМ ЕКГ було проведено за допомогою трьохканальних реєстраторів «Кардиотехника-4000» ООО «ИНКАРТ», виробництво Санкт-Петербург. Застосовували звичайно прийняте розташування електродів в позиціях відведень V4, Y, V6 [7, 22]. Оцінка результатів здійснювалася на підставі трендів сумарних кривих відхилень сегментів SТ (при наявності депресії більше або рівної 1мм), частоти серцевих скорочень, а також таблиць із погодинним роздрукуванням порушень ритму, що спостерігалися.
Оцінювали наступні показники ХМ ЕКГ:
1. Максимальну, мінімальну та середню ЧСС за добу;
2. Динаміку сегмента ST:
а) тривалість депресії сегмента ST більше або рівної 1 мм в хвилинах (ST sum);
б) частоту виникнення епізодів депресії сегмента ST більше або рівної 1 мм - кількість епізодів - (ST ep.);
в) глибину депресії сегмента ST в мм (STdep.);
г) тривалість максимального сегмента ST з глибиною депресії більше або рівної 1 мм в хвилинах (ST mах);
3. Загальну кількість суправентрикулярних та шлуночкових порушень ритму різних градацій за добу.
У процесі аналізу даних ХМ ЕКГ визначали часові та спектральні показники варіабельності серцевого ритму.
Дослідження проводилося згідно стандартів використання показників ВСР у клінічній практиці та кардіологічних дослідженнях, розроблених у 1996 р. Робочою групою Європейського товариства кардіології і Північно¬американського товариства кардіостимуляції і електрофізіології [7].
Основний часовий показник – стандартне (середньоквадратичне) відхилення інтервалу RR (SDNN) – відображує, насамперед, активність вагусного контролю серцевого ритму. До часових індексів ВСР належать також середнє значення всіх SDNN 5-хвилинних сегментів за весь час реєстрації (SDNN індекс), стандартне (середньо¬квадратичне) відхи¬лен¬ня різниці послідовних інтервалів NN (RMSSD) і відсоток суміжних RR інтервалів, різниця між якими перевищує 50 мсек (pNN50) (табл. 2.3.1).
Таблиця 4.1. Часові показники ВРС
|
Показник
|
Визначення
|
Характеристика
|
|
SDNN, мс
|
Стандартне відхилення NN інтервалів
|
Відображає сумарну ВРС
|
|
SDNN індекс, мс
|
Середнє значення всіх SDNN 5 хвилинних сегментів за весь час реєстрації
|
Відображає сумарну ВРС за весь час реєстрації
|
|
RMSSD, мс
|
Стандартне (середньоквадратичне) відхилення різниці послідовних інтервалів NN
|
Є мірою ВРС із малою тривалістю циклів
|
|
pNN50,%
|
% суміжних NN інтервалів, різниця між якими перевищує 50 мсек.
|
Є мірою ВРС із малою тривалістю циклів
|
Спектральний аналіз ВРС дав змогу розрізнити коливання ритму серця різної періодичності. Коливання ЧСС на високих частотах: HF – high frequency - більше 0,15 Гц, тобто на частоті дихання, пов’язані з процесом дихання і відображають вагусний контроль серцевого ритму (дихальна аритмія) [96,105,234]. Низькочастотна частина спектру: LF – low frequency - (0,05-0,15) має змішане походження і відображає, як вагусний, так і симпатичний тонус, а також функцію барорефлексу [7, 100].
Розрізняються також коливання серцевого ритму на дуже низьких частотах (менше 0,05Гц), ”VLF - very low frequency”, або “ULF – ultra low frequency”, які ймовірно пов’язані з терморегуляцією, проте їх фізіологічний зміст до кінця не з’ясований. Крім амплітуди компонентів, визначали також загальну потужність спектру: TF - total frequency, яка відображає загальну активність вегетативних впливів на серцевий ритм, а також чутливий показник балансу симпатичної і парасимпатичної активності [7, 100].
Позитивний кореляційний зв’язок між деякими спектральними і часовими показниками ВРС підтверджує їх подібне фізіологічне значення і спільний об’єкт відображення – характер вегетативних впливів на серцевий ритм [7](табл. 2.3.2).
Таблиця 4.2. Спектральні показники ВРС
|
Показник
|
Визначення
|
Характеристика
|
|
ТF, мс2
|
Загальна потужність спектру. Вимірюється в частотному діапазоні до 0,4 Гц.
|
Відображає загальну активність вегетативних впливів на серцевий ритм.
|
|
LF, мс2
|
Потужність у діапазоні низьких частот (0,04-0,15Гц).
|
Відображає низькочастотну складову ВСР, що характеризує, як вагусний, так і симпатичний тонус і функцію барорефлексу.
|
|
HF, мс2
|
Потужність у діапазоні високих частот (0,15-0,4 Гц).
|
Відображає високочастотну складову ВСР. Характеризує парасимпатичний тонус.
|
|
LF/HF
|
Співвідношення потужностей спектру на низьких і високих частотах
|
Характеризує вегетативний баланс (симпатичний тонус/ парасимпатичний тонус)
|
4.2 Вплив цукрового діабету 2 типу на розвиток больової та безбольвої ішемії міокарда лівого шлуночка
У хворих з супутнім ЦД 2 типу у 40% випадків зареєстрована депресія сегмента ST не супроводжувалась больовими відчуттями (ББІМ) (n=40хв.). У хворих на ІХС, що не мали супутнього ЦД безбольова ішемія міокарда зустрічалась лише у 20% (n=6хв.).
За наявністю больових відчуттів, або задухи, як еквівалента стенокардії, пацієнти були розділені на 4 групи. Першу групу склали 24 (n=24) хворих ІХС і ГХ-ІІ ст. без ЦД з БІМ. У другу групу було включено 6 пацієнтів (n=6) з ІХС і ГХ-ІІ ст. без ЦД страждаючі ББІМ. Третю групу склали 60 (n=60) пацієнти з ІХС і ГХ-ІІ ст. і супутнім ЦД БІМ, що мають. У четвертую групу входили 40 (n=40) пацієнти з ІХС і ГХ-ІІ ст. і супутнім ЦД що мали ББІМ.
За результатами дослідження виникнення (ST ер.) епізодів БІМ в групі пацієнтів з ІХС на фоні ЦД (5,54±4,70) зустрічалось достовірно частіше у порівнянні з групою пацієнтів з ізольованою ІХС (2,37±1,52), р < 0,05. Глибина зсуву сегменту ST (ST depr.) у групі, що страждала на ЦД 2 типу (1,52±0,24) достовірно перевищувала в контрольній групі пацієнтів (1,07±0,52).
Потрібно відзначити, що ББІМ у пацієнтів з супутнім ЦД 2 типу зустрічалась в два рази частіше (40% від загальної кількості пацієнтів з ЦД), ніж у пацієнтів без ЦД (20% від загальної кількості пацієнтів в групі контролю).
Епізоди ББІМ зустрічалися значно частіше у групі пацієнтів з супутнім ЦД 2 типу (7,92±2,43), ніж в групі без ЦД (3,00±1,41), р < 0,05, при цьому, глибина зсуву сегменту ST у групі пацієнтів з ЦД була більш виражена (1,75±0,16), в порівнянні з групою пацієнтів без ЦД (1,5±0,06), р<0,05. ББІМ в досліджуваній групі так само відрізнялася максимальною тривалістю (ST max.) епізоду ішемії (17,17±6,89) хв., що достовірно перевищило значення в інших підгрупах: при БІМ у пацієнтів з ЦД (9,64±6,18); ББІМ у групі контролю (без ЦД) – (5,83±1,33); тривалість максимального епізоду БІМ у контрольній групі складала (3,20±2,03) хв., р<0,05. Сумарна тривалість епізодів ішемії (ST sum.) так само відрізнялася меншою тривалістю у групі пацієнтів контролю: (8,76±6,30) – в підгрупі з БІМ і (14,83±5,96) – в підгрупі з ББІМ, р<0,05. У досліджуваній групі пацієнтів з ЦД сумарна тривалість ішемічного зсуву сегменту ST (ST sum.) складала при БІМ (24,55±13,94) і при ББІМ (55,97±25,96), р < 0,001 (таб. 4.1).
Зміни сегменту ST не були частотозалежними.
При аналізі CРП була виявлена тенденція до збільшення цього показника у хворих з супутнім ЦД 2 типу. Так в групі пацієнтів з ЦД при ББІМ СРП склав (10,99±3,47), в групі пацієнтів з БІМ- (7,44±3,38) р<0,05. У групі контролю цей показник був достовірно нижче (4,84±1,78) - БІМ, (5,78±2,55) – ББІМ (р=0,29).
Глікозильований гемоглобін склав в групі пацієнтів з супутнім ЦД 2 типу і БІМ-(7,52±0,84) і (8,83±1,44) - при ББІМ, р<0,05.
Результати дослідження наведені у табл. 5.1
Таблиця4.1. Порівняльний аналіз частоти виникнення ішемії міокарда за аними у хворих на ІХС залежно від наявності ЦД 2 типу
|
Показник
|
ІХС, n=30
|
ІХС+ЦД, n=100
|
p
|
|
|
БІМ
n1=24 (80%)
|
ББІМ
n2=6 (20%)
|
БІМ
n3=60 (60%)
|
ББІМ
n4=40 (40%)
|
|
(M±SD)
|
(M±SD)
|
(M±SD)
|
(M±SD)
|
|
ЧСС ср.
|
68,08±5,96
|
70,05±11,34
|
71,28±6,88
|
71,±6,74
|
p1,3<0,05p1,2=0,55
p2,4=0,88 p3,4=0,84
|
Продовж. табл.5.1
|
|
|
Показник
|
ІХС, n=30
|
ІХС+ЦД, n=100
|
р
|
|
БІМ
n1=24 (80%)
|
ББІМ
n2=6 (20%)
|
БІМ
n3=60 (60%)
|
БІМ
n4=40(80%)
|
|
(M±SD)
|
(M±SD)
|
(M±SD)
|
(M±SD)
|
|
STsum., мин.
|
8,76±6,30
|
14,83±5,98
|
24,55±13,94
|
55,97±25,96
|
p1,3<0,001
p1,2<0,05 p2,4<0,001p3,4<0,001
|
|
STep., у.о.
|
2,37±1,52
|
3,00±1,41
|
5,43±4,70
|
7,92±2,43
|
p1,3<0,002 p1,2=0,36 p2,4<0,001p3,4<0,0027
|
|
STdep., мм
|
1,07±0,52
|
1,50±0,06
|
1,52±0,24
|
1,75±0,16
|
p1,3<0,001
p1,2=0,05 p2,4<0,001p3,4<0,001
|
|
STmax., мин.
|
3,20±2,03
|
5,83±1,33
|
9,64±6,18
|
17,17±6,89
|
р1,3<0,001p1,2<0,006 p2,4<0,001p3,4<0,001
|
|
CPП
|
4,84±1,78
|
5,78±2,55
|
7,44±3,38
|
10,99±3,47
|
р1,2=0,29
р1,3<0,01
р2,4<0,01
р3,4<0,01
|
|
HbA1c%
|
-
|
-
|
7,52±0,84
|
8,83±1,44
|
р3,4<0,001
|
Примітка. р – достовірність
Зниження больових відчуттів під час ішемії міокарду є ознаками кардіонейропатії, що призводить до розвитку безбольової ішемії.
4.3 Стан вегетативної нервової системи за даними варіабельності серцевого ритму у хворих з ІХС на тлі цукрового діабету 2 типу
Зниження показників варіабельності серцевого ритму спостерігали як у групах дослідження, так і в контрольних групах, (р<0,05). Зниження статистичних показників варіабельності ритму: SDDNN, SDDNNi, RMSSD, pNN50 в групі пацієнтів з ЦД 2 типу у порівнянні з групою контролю вказує на виникнення ригідності вариабельності ритму серця; причому група пацієнтів з ББІМ на фоні ЦД відрізнялась більш вираженим зниженням цих показників при порівнянні з групою хворих з БІМ при ЦД (р<0,05) (табл.5.2).
Таблиця 4.2. Порівняльний аналіз варіабельності серцевого ритму у хворих на ІХС залежно від наявності ЦД
|
Показник
|
ІХС, n=30
|
ІХС+ЦД, n=100
|
p
|
|
|
БІМ
n1=24(80%)
|
ББІМ
n2=6(20%)
|
БІМ
n3=60 (60%)
|
ББІМ
n4=40 (40%)
|
|
(M±SD)
|
(M±SD)
|
(M±SD)
|
(M±SD)
|
|
SDNN, мс
|
149,42±34,33
|
123,76±15,43
|
112,33±27,75
|
93,46±28,41
|
р1,3<0,05
р1,2>0,05
р2,4<0,05
р3,4<0,05
|
|
SDNNі,
сек.
|
53,71±13,10
|
49,50±8,02
|
44.48±18.50
|
34,57±13,22
|
р1,3<0,05
р1,2<0,05
р2,4<0,05
р3,4<0,05
|
|
RMSSD, мс
|
32,58 ±9,11
|
28,83±6,01
|
26,16±10.25
|
20,55±8,48
|
р1,3<0,05
р1,2>0,05
р2,4<0,05
р3,4<0,05
|
|
PNN50
%
|
11,83±6,32
|
4,67±2,73
|
6.68±4.92
|
2,92±1,71
|
р1,3<0,05
р1,2<0,05
р2,4<0,05
р3,4<0,05
|
|
LF, мс2
|
1163,12±614,27
|
958,0±267,48
|
707,62±275,01
|
434,61±235,59
|
р1,3<0,05
р1,2=0,15
р2,4<0,05
р3,4<0,05
|
|
Продовж. табл. 5.2
|
|
Показник
|
ІХС, n=30
|
ІХС+ЦД, n=100
|
p
|
|
БІМ n1=24(80%)
|
ББІМ n2=6(20%)
|
БІМ n3=60 (60%)
|
ББІМ n4=40 (40%)
|
|
(M±SD)
|
(M±SD)
|
(M±SD)
|
(M±SD)
|
|
HF, мс2
|
481,58±275,98
|
365,0±97,06
|
333,08±133,3
|
206,33±108,22
|
р1,2>0,05
р1,3<0,05
р2,4<0,05
р3,4<0,05
|
|
LF/HF
|
2,56±0,8
|
2,74±0,58
|
2,19±0,57
|
2,07±0,44
|
р1,3<0,05
р1,2>0,05
р2,4<0,05
р3,4>0,05
|
• Примітка. p – достовірність
Показники потужності у діапазоні низьких частот (LF) були достовірно знижені в обох групах хворих, страждаючих ЦД 2 типу, причому, у групі пацієнтів з ББІМ це зниження більш виражене (434,61±235,59) в порівнянні з пацієнтами з БІМ - (707,62±275,01) р<0,05, а також з групою контролю з БІМ- (1163,12±614,27), і з ББІМ- (958,0±267,48), р<0,05.
Зміни потужності спектру в діапазоні високих частот (HF) були ідентичні змінам потужності спектру в діапазоні низьких частот. Зниження HF у групах пацієнтів хворих на ІХС, що не мали супутнього ЦД з БІМ (481,58±275,98) і ББІМ (365,00±97,06) були менш виражене, ніж в групах хворих з ЦД при БІМ - (333,08±133,3) та при ББІМ -(206,33±108,22), р<0,05. При цьому показник співвідношення LF/HF у хворих з супутнім ЦД залишавсяся у межах норми.
Таким чином, зниження спектральних компонентів потужності варіабельності серцевого ритму (LF, HF) при збереженні величини їх співвідношення (LF/HF) – говорить про зниження активності як симпатичної, так і парасимпатичної вегетативної нервової системи.
4.4 Розвиток суправентрікулярних і шлуночкових порушень ритму у хворих з ІХС на тлі цукрового діабету 2 типу
Аналізуючи порушення ритму (СЕ, ШЕ, СВТ), що найчастіше зустрічають, слід зазначити, що пацієнти з ІХС і супутнім ЦД 2 типу, більш схильні до їх виникнення, ніж пацієнти без ЦД (р<0,05). Так, кількість СЕ, що зустрічались у пацієнтів з ІХС на фоні ЦД 2 типу та БІМ складала (138,62±92,4), при ББІМ - (232,12±147,2) р<0,05, в групі контролю при БІМ - (48,54±24,18), при ББІМ (55,33±34,14) р>0,05.
Така ж тенденція зберігалася при аналізі ШЕ. Найбільша частота виникнення ШЕ була зареєстрована в групі пацієнтів з ІХС і супутнім ЦД 2 типу що мали ББІМ (200,85±132,5). Вона перевищувала частоту виникнення ШЕ в групі пацієнтів з ІХС і ЦД 2 типу з БІМ (102,51±66,72), а також, частототу виникнення ШЕ в групі контролю з ББІМ (79,66±49,24) і БІМ (34,21±29,95), р<0,05.
СВТ в групі пацієнтів з супутнім ЦД 2 типу і ББІМ склала (4,72±2,19), в групі з БІМ була декілька нижче (3,43±2,19), р<0,05. У групах контролю частота реєстрації СВТ складала: у хворих з ББІМ (2,17±1,17) і без БІМ (2,33±1,90), р=0,85 (табл. 5.3)
Таблиця 4.3. Порівняльний аналіз порушення серцевого ритму у хворих на ІХС залежно від наявності ЦД 2 типу
|
Показники
|
ІХС(n=30)
|
ІХС+ЦД(n=100)
|
p
|
|
|
БІМ, n1=24; (80%)
|
ББІМ, n2=6; (20%)
|
БІМ, n3=60; (60%)
|
ББІМ, n4=40; (40%)
|
|
(M±SD)
|
(M±SD)
|
(M±SD)
|
(M±SD)
|
|
СЕ
|
48,54±24,18
|
55,33±34,14
|
138,62±92,43
|
232,12±147,22
|
р3,4<0,01
p1,2=0,5
р1,3<0,01
p2,4<0,01
|
|
Продовж. табл.4.3
|
|
Показники
|
ІХС(n=30)
|
ІХС+ЦД(n=100)
|
p
|
|
БІМ, n1=24; (80%)
|
ББІМ, n2=6; (20%)
|
БІМ, n3=60; (60%)
|
ББІМ, n4=40; (40%)
|
|
(M±SD)
|
(M±SD)
|
(M±SD)
|
(M±SD)
|
|
СВТ
|
2,33±1,90
|
2,17±1,17
|
3,43±2,19
|
4,72±2,19
|
р3,4<0,01
p1,2=0,85
p1,3=0,03
p2,4<0,01
|
|
ШЕ
|
34,21±29,95
|
79,66±49,24
|
102,51±66,72
|
200,85±132,52
|
р3,4<0,001
p1,2<0,01
р1,3<0,001 p2,4=0,033
|
• Примітка. p- достовірність
Нами була виявлена висока кореляція між максимальною тривалістю епізоду ішемії (ST max.) і глікозильованим гемоглобіном (HbA1c), (r=0,55) (рис.5.1), та С-реактивним протеїном (r=0,53), (рис.5.2.); а також між СРП та HbA1c (r=0,56), (рис.5.3). Графіки кореляції представлені нижче.
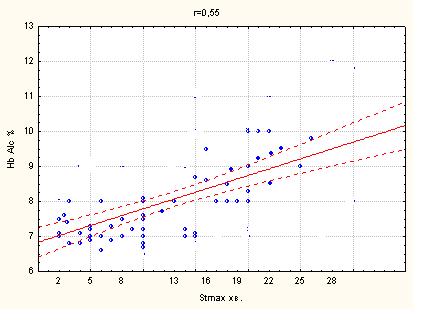
Рис. 4.1 Кореляція між HbA1c і максимальною тривалістю епізоду ішемії ( ST max.); r=0,55, р<0,05
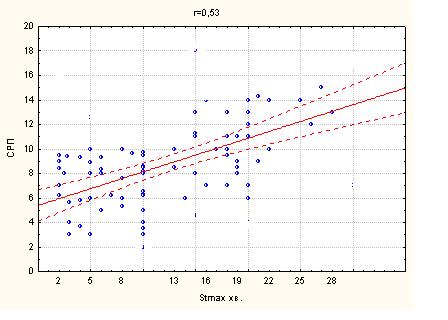
Рис. 4.2 Кореляція між СРП та максимальною тривалістю епізоду ішемії ( ST max.) у хворих на ІХС з ЦД, r=0,53, р<0,05.
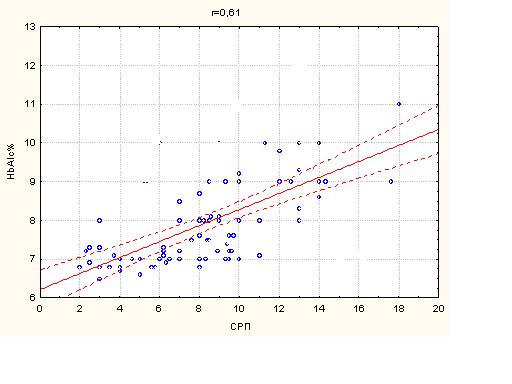
Рис. 4.3 Кореляція між СРП та HbA1c, r=0,61, р<0,05
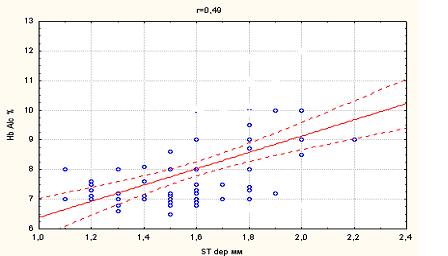
Рис. 4.4 Кореляція між HbA1c та ST dep, r=0,49, р<0,05
Таким чином, можна зробити висновки, що безбольова ішемія міокарда, у хворих на ІХС та супутнім ЦД, зустрічається частіше ніж у хворих ІХС без супутнього ЦД, є більш тривалою за часом, супроводжується більш вираженою глибиною депресії ST сегмента, сумарною тривалістю епізодів ішемії. А розвиток діабетичної нейропатії у пацієнтів з ІХС та супутнім ЦД 2 типу призводить до зниження статистичних показників варіабельності серцевого ритму (SDNN, SDNNi, RMSSD, pNN50), що проявляється його ригідністю; зниженням спектральних компонентів потужності (LF, HF), при збереженні показника їх відношення (LF/HF). Крім того, ІХС у пацієнтів з ЦД 2 типу достовірно частіше супроводжується порушеннями ритму (шлуночковими, суправентрикулярними екстрасистоліями, суправентрикулярною тахікардією), ніж у хворих з ІХС без супутнього ЦД.
Глава 5. Вплив цукрового діабету на розвиток судинного атеротромбозу: ліпідного обміну та запальних механізмів у хворих з ІХС
Останніми роками визначені чинники, достовірно пов'язані з розвитком першого інфаркту міокарду: високий коефіцієнт aроВ/ароА, куріння, цукровий діабет, артеріальна гіпертензія, абдомінальне ожиріння, психосоціальні чинники, недостатнє вживання фруктів і овочів, низьке фізичне навантаження і регулярне вживання алкоголю (більш 3 разів на тиждень). Ризик розвитку першого інфаркту міокарду за наявності всіх 9 перерахованих умов досягає 90,4%. У той же час смертність від серцево-судинних захворювань у хворих ЦД 2 типу складає 65-75% [28], причому клінічна картина розвитку ГІМ часто відрізняється атиповою течією [21]. Так, у 30 % хворих спостерігається розвиток ГІМ на тлі нормального або навіть зниженого вмісту в крові загального холестерину (ЗХС), ЛПНЩ при гемодинамічно незначущому стенозуванні коронарних артерій. Це обумовлено наявністю ЦД 2 типу [178], при якому порушення метаболізму глюкози поєднуються з дисліпідемією: збільшенням вмісту вільних жирних кислот, ТГ, дрібних щільних высокоатерогенных частинок ЛПНЩ, зменшенням вмісту ЛПВЩ [92]. Дані порушення супроводжуються розвитком системного запалення, оксидантного стресу, що приводить до порушення функції судинного ендотелію, а потім до розвитку запалення безпосередньо в стінці судини [71]. Активність запалення при атеросклерозі визначається по рівню СРП, сироваткового амілоїда А, фібриногену, чинника фон Віллебранда, церуллоплазмину, інтерлейкіну-6 і в деякій мірі кількістю лейкоцитів і ШОЕ [75]. Доказаний зв'язок між рівнем СРП і вираженістю атеросклеротичного пошкодження судин, частотою кардіоваскулярних подій [119, 165, 178]. Підвищена концентрація СРП є більш значущим предиктором серцево-судинних катастроф, ніж рівень ЛПНЩ [161].
Пошкодження ендотелію, що передує дестабілізації атероми, супроводжується вивільненням запальних медіаторів, що активують відповідні сигнальні молекули. Багато імунологічних чинників, такі як інтерлейкін-6 і чинник некрозу пухлин, вивільняються при пошкодженні судинної стінки, стимулюючи синтез СРП гепатоцитами [49]. СРП індукує продукцію хемокинів, молекул адгезії і власних СРП-рецепторов, що забезпечують залучення в зону пошкодження макрофагів і подальший розвиток запальної реакції [169]. Результатом судинного запалення є зниження продукції NO з вазодилятуючими властивостями конституціональної NO-синтетазою [111]. Поєднання депонування ліпідних частинок у субендотеліальному матриксі, запальної реакції в судинній стінці і зменшення компенсаторної вазоділатації може призводити до зниження міокардіальної перфузії, і як наслідок, - до ішемії міокарда. Тому рівень СРП можна використовувати, як маркер, при лікуванні хворих з серцево-судинною патологією. Відмічено зниження концентрації СРП у хворих з ГІМ, інсультом або атеросклеротичним ураженням периферичних артерій, при терапії інгібіторами ангіотензинперетворюючого ферменту (АПФ), бета-адреноблокаторами, нітратами, триметазидином, статинами [62, 64, 71, 125].
З метою дослідження визначення впливу ЦД 2 типу на особливості розвитку атеросклеротичного пошкодження міокарду у хворих на ІХС та ЦД 2 типу було досліджено рівень біохімічних показників (CPП, ЗХС, ТГ, ЛПВЩ, ЛПНЩ, ЛПДНП, ІА, глюкози крові натщесерце (ГК) і HbA1c) у 30-ти пацієнтів на ІХС, стенокардією напруги II-ІІІ Ф.К. на тлі ЦД 2 типу і у 42-х пацієнтів, що мали ІХС та постінфарктний кардіосклероз не більше одного року, із стабільною стенокардією II-ІІІ Ф.К., без ЦД. Клінічні ознаки хронічної серцевої недостатності у всіх обстежених відповідали І-П-А ст. по класифікації Стражеска - Василенко (ΙΙ-ΙΙΙ ст. по NYHA).
У процесі дослідження виявилось, що рівні загального ЗХС і холестерину ЛПНЩ у хворих на ЦД 2 типу були порівнянні з такими у осіб, з постінфарктним кардіосклерозом, що не мали ЦД (р>0,05). Рівень ХСЛПНЩ також достовірно не різнився з хворими на ІХС з ПІКС. По своєму фенотипу - це були ліпопротеіди типу β, тобто вони мали менші розміри і більшу щільність, ніж ХСЛПНЩ у здорових осіб. Такі частинки більш тривалий час циркулюють у кровотоку, інтенсивніше окислюються і захоплюються макрофагами у судинній стінці. Необхідно відзначити, що підвищеню проникненості окислених ХСЛПНЩ у судинну стінку сприяє властива цукровому діабету хронічна гіперглікемія, що призводить до накопичення у крові глікованих білків [90]. Ці процеси активують вивільнення цитокинів (інтерлейкіна-1, чинника некрозу пухлин-6), які активують процеси запалення в стінці артерії [84]. Таким чином кількісний і якісний склад ХСЛПНЩ є важливими чинниками ризику серцево-судинних захворювань[178, 189].
У той же час, у пацієнтів з ЦД 2 типу рівень ХСЛПДНЩ був достовірно вищими (р<0,05) ніж у осіб без ЦД.
В основі ліпідних порушень при ЦД 2 типу лежить підвищений синтез ХСЛПДНЩ, які в умовах зниженого рівня ендогенного інсуліну і активності ліпопротеінової ліпази, у меншій мірі, піддаються гідролізу - подальшому розпаду до ХСЛППП і ХСЛПНЩ. Крім того, при декомпенсованому ЦД з периферійних адипоцитів іде посилений приплив вільних жирних кислот, які є «будівельним матеріалом» для ХСЛПДНЩ.
Рівень ТГ у пацієнтів з ЦД 2-типа був достовірно вище (р<0,05) ніж у пацієнтів, що не мали ЦД. Цей результат був очікуємий, оскільки тригліцеридемія при ЦД носить вторинний характер [13, 103, 178].
Індекс атерогенності у хворих на ІХС з супутнім ЦД 2 типу був достовірно вищий ніж у хворих на ІХЗ з ПІКС.
Специфічні зміни ліпідновуглеводного обміну у пацієнтів з ЦД супроводжувались підвищенням індексу атерогенності (р<0,05) у порівнянні із хворими, що перенесли ІМ та не мали ЦД.
Рівень CРП у пацієнтів з ЦД 2 типу був також значно вищим (р<0,05), ніж у пацієнтів, що перенесли ІМ, що може бути обумовлено не тільки зміною ліпідного спектру і як наслідком системного запалення в системі інтімедіального комплексу і атеросклерозом що розвивається, але і в наслідок розвитку діабетичної нефропатії, ангіопатії нижніх кінцівок, гепатобіліарної патології і хронічного панкреатиту. (табл. 6.1)
Таблиця 5.1. Порівняльний аналіз біохімічних показників крові у хворих на ІХС з супутнім ЦД 2 типу та пацієнтів з ІХС та постінфарктним кардіосклерозом без ЦД
|
Показники
|
ІХС+ЦД
M±SD
(n1=30)
|
ДІ
(-95,0%
до
+ 95,0% )
|
ІХС+ПІМ
M±SD
(n2=42)
|
ДІ
(-95,0%
до
+ 95,0%)
|
р
|
|
|
|
|
ЗХС, ммоль/л
|
4,97±0,87
|
4,65-5,30
|
4,93±1,06
|
4,60-5,26
|
0,86
|
|
|
ТГ, ммоль/л
|
2,19±0,89
|
1,86-2,53
|
1,66±0,79
|
1,42-1,91
|
0,0096
|
|
|
ЛПНЩ, ммоль/л
|
2,80±0,89
|
2,47-3,13
|
2,80±1,11
|
2,45-3,14
|
1
|
|
|
ЛПДНЩ, ммоль/л
|
0,99±0,40
|
0,84-1,13
|
0,78±0,37
|
0,66-0,86
|
0,024
|
|
|
ЛПВЩ, ммоль/л
|
1,15±0,24
|
1,06-1,24
|
1,31±0,21
|
1,25-1,38
|
0,0037
|
|
|
ІА, усл. од.
|
3,47±1,51
|
2,91-4,04
|
2,87±0,10
|
2,56-3,18
|
0,012
|
|
|
CPП, мг/мл
|
6,41±2,63
|
5,42-7,39
|
4,73±1,82
|
4,16-5,29
|
0,002
|
|
|
Глюкоза, ммоль/л
|
7,85±3,07
|
6,71-8,99
|
4,9±0,70
|
4,68-5,12
|
0,000
|
|
Примітка. p- достовірність
Таким чином, можна зазначити, що хворі на ІХС з супутнім ЦД 2 типу за ліпідним спектром крові відрізняється більш вираженою дисліпідемією атерогенного характеру від хворих ІХС з постінфарктним кардіосклерозом, зокрема більш вираженою тригліцеридімією (р<0,05), більшим рінем ЛПДНЩ (р<0,05), нижчим рівнєм ЛПВЩ (р<0,05), та вищим ІА (р<0,05). Тому хворі на ІХС з супутнім ЦД 2 типу потрибують такого ж агресивного лікування та контролю з боку ліпопротеїдів крові, як і хворі, що перенесли ІМ.
Крім того, рівень СРП у хворих на ІХС з супутнім ЦД 2 типу був достовірно вищий (р<0,05), ніж у пацієнтів з ІХС, постінфарктним кардіосклерозом, що може бути пов’язане не тільки з наслідком системного запалення в системі інтімедіального комплексу, а також в наслідок розвитку діабетичної нефропатії, ангіопатії нижніх кінцівок, гепатобіліарної патології і хронічного панкреатиту.
Глава 6. Сумарний кальцієвий індекс коронарних судин у хворих на ІХС з супутнім цукровим діабетом 2 типу
Діагностика ІХС базується на оцінці стану вінцевих судин і атеросклеротичних змін в них. Патоморфологічним субстратом розвитку ІХС є атеросклероз вінцевих артерій [22, 43].
Більшість атеросклеротичних бляшок містять включення кальцію. Якщо раніше вважали, що кальцифікація і кальциноз зустрічається тільки на пізніх етапах розвитку атероматозу, а у вогнищах ліпідної інфільтрації відкладень солей кальцію не відбувається, то на сьогоднішній день доведено відкладення депозитів кальцію на ранніх стадіях атеросклеротичного процесу, починаючи з жирової плями (сенільний медіокальциноз) [193-194, 198].
Як вважають, гідроксиапатит кальцію активно відкладається в уражених атеросклерозом артеріях, і механізм цього явища схожий з формуванням і руйнуванням кісткової тканини [193-194]. Кількість коронарного кальцію знаходиться в близькому співвідношенні до тотальної маси бляшок, хоча звапніння представляє всього лише вершину айсберга. Визначуваний об'єм звапніння бляшок складає 20% тотальної маси бляшок. Зустрічаються навіть окремі пацієнти без кальцифікації, але з легко уразливими бляшками, які схильні до розривів. Є суперечливі дані з питання про те, чи відповідає поширене звапніння зрілішим стабільним бляшкам (менший ризик гострих атак) або ризик гострих серцево-судинних атак при цьому зростає [96, 168].
Деякі автори стверджують, що у пацієнтів із стабільною стенокардією виявляється поширеніше звапніння, ніж у пацієнтів з нестабільною стенокардією або з гострими інфарктами. Мова йде про 25% інфарктів міокарду або коронарної смерті за рік у пацієнтів з дуже високим індексом кальцію (>1000). Доведено, що значення індексу кальцію >1000 добре розмежовує пацієнтів, у яких виникнуть серцево-судинні атаки (стенокардія, інфаркт міокарду) на протязі подальших 2-5 років, від пацієнтів, у яких такі події не відбудуться [90, 127]. Якщо при проведенні МСКТ не виявлені кальцієві депозити, це не говорить про відсутність атеросклерозу [38, 43, 194].
Результати дослідження строго стандартизовані і мало залежать від суб'єктивної оцінки дослідника, що робить МСКТ прийнятним методом для використання як скринінг-теста (Achenbach S. et al., 2005). Індексація кальцію може бути виправдана у осіб з високим ступенем ризику [196], у безсимптомних пацієнтів, а також у осіб, які мають протипоказання до проведення проб навантажень або за умови їх неінформативності. Перш за все, до цієї групи пацієнтів відносяться особи немолодого віку (детреновані) і хворі ЦД 2 типу, оскільки мікро- і макроангіопатія у цих пацієнтів призводить до важких атеросклеротичних змін судин нижніх кінцівок – склероз Менкеберга.
Показово, що індексація коронарного кальцію надійна при диференціальній діагностиці ішемічної форми від неішемічної кардіоміопатії.
6.1 Комплексне дослідження серця за допомогою мультиспіральної комп’ютерної томографії.
Традиційно, для отримання зображень коронарних артерій використовувалася рентгенконтрастна коронароангіографія, яка до сьогоднішнього дня залишається "золотим стандартом" діагностики в цій області. Проте вочевидь, що рентгенконтрастна коронароангіографія не може бути виконана усім пацієнтам, що її потребують, у тому ж числі і із-за інвазивності методу. Завдяки появі мультиспиральної комп'ютерної томографії була впроваджена методика КТ-ангіографії (КТА), яка почала використовуватися для оцінки стану коронарних артерій і прохідності венозних і артеріальних коронарних шунтів. За допомогою МСКТ можливо отримувати унікальну інформацію про наявність кальцинозу коронарних артерій, так званого сумарного кальцієвого індексу (СКІ) - кальцинозу коронарних артерій, що відображає його ступінь [126, 168].
МСКТ виконувалась на мультіспіральному комп'ютерному томографі «Light Speed-16» («General Electric Company», Японія) в кабінеті томографії Регіонального лікувально-діагностичного центру «Інститут кардіології імені акададеміка М.Д.Стражеско» АМН України, з обробкою даних на кардіологічній робочій станції «Advantage Workstation 4.2» («General Electric Company», США).
Спіральний режим томографії з товщиною зрізу 2,5мм, поляцією 2,5мм, поперечною орієнтацією зрізу, сила тока на трубці – 300 mAm, напруга току на трубці 120 kV. Використовувалась ретроспективна синхронізація з ЕКГ ( з затримкою тригера 40 % від інтервалу R-R). Час сканування складав 6-8 сек. із обертанням трубки на 360. Поле дослідження FOV – 25см, досліджувана ділянка складала 16-18см (від рівня біфуркації легеневої артерії до основи серця). Дослідження проводилось при затримці дихання. Доза опромінювання складала 2,2мЗв за одне дослідження.
Для кількісної оцінки ступеню кальцинозу коронарних артерій методом МСКТ використовувалось програмне забезпечення томографа «Smart Score» по методу Agatston (1990р.), що дозволяло виявити коронарний кальциноз і визначити його ступень за рахунок кількісного підрахунку кальція у судинах.
Визначалися кількість вокселей із платністю що дорівнювала, або перевищувала 130 HU (одиниць Хаунсфилда), проводилася інтерполяція їх об’єму, з урахуванням товщини зрізу і їх перекриття. Програмне забезпечення дозволяло оцінити не тільки площу кальцинозу на кожному зрізі, а і загальний об’єм кальцієвого ураження із підрахунком СКІ.
6.2 Кореляційний зв’язок сумарного кальцієвого індексу з маркерами атеросклерозу
З метою визначення кореляційного зв'язку між СКІ і маркерами атеросклерозу (ІА, СРП, ЗХС) у пацієнтів з ЦД 2 типу було обстежено 30 хворих стабільної ІХС, стенокардією напруги II-ІІІ Ф.К., С.Н. I-IIА стадії з супутнім ЦД 2 типу та 42 хворих ІХС з постінфарктним кардіосклерозом давністю не більш одного року, із стенокардією напруги II-ІІІ Ф.К., С.Н. I-IIА стадії без ЦД. У процесі дослідження виявилась, що рівень СКІ у пацієнтів обох груп не мав достовірної різниці, (р>0,05). Відсутність достовірної різниці СКІ може бути розцінено, як результат раннього кальцинозу у пацієнтів хворих на ЦД 2 типу, обумовленого порушенням кальцієвого обміну, який, можливо, каталізує зміни Рh крові у даної групи пацієнтів [194].
У рамках даного дослідження вивчався зв'язок СКІ і показників ліпідно-вуглеводного обміну, а також CPП – як неспецифічного маркера запалення. (табл. 7.1).
Таблиця 6.1. Порівняльний аналіз вуглеводного, ліпідного обмінів і СPП крові у хворих на ІХС
|
Показники
|
ІХС+ЦД
M±SD
(n1=30)
|
ДІ
(-95,0%
до
+ 95,0% )
|
ІХС+ПІМ
M±SD
(n2=42)
|
ДІ
(-95,0%
до
+ 95,0%)
|
р
|
|
|
|
|
ЗХС, ммоль/л
|
4,97±0,87
|
4,65-5,30
|
4,93±1,06
|
4,60-5,26
|
р=0,86
|
|
|
ТГ, ммоль/л
|
2,19±0,89
|
1,86-2,53
|
1,66±0,79
|
1,42-1,91
|
p<0,01
|
|
|
Продовж. табл. 6.1
|
|
|
Показники
|
ІХС+ЦД
M±SD
(n1=30)
|
ДІ
(-95,0%
до
+ 95,0% )
|
ІХС+ПІМ
M±SD
(n2=42)
|
ДІ
(-95,0%
до
+ 95,0%)
|
р
|
|
|
ЛПДНЩ, ммоль/л
|
0,99±0,4
|
0,84-1,13
|
0,78±0,37
|
0,66-0,89
|
р=0,024
|
|
|
ЛПВЩ, ммоль/л
|
1,15±0,24
|
1,06-1,24
|
1,31±0,21
|
1,25-1,38
|
p<0,01
|
|
|
ІА, ум. од.
|
3,47±1,51
|
2,91-4,04
|
2,87±0,1
|
2,56-3,18
|
р=0,01
|
|
|
CPП, мг/мл
|
6,41±2,63
|
5,42-7,39
|
4,73±1,82
|
4,16-5,29
|
p<0,01
|
|
|
Глюкоза, ммоль/л
|
7,85±3,07
|
6,71-9,00
|
4,9±0,70
|
4,68-5,12
|
p<0,01
|
|
|
HbA 1c, %
|
8,09±1,6
|
7,49-8,68
|
-
|
-
|
-
|
|
|
СКІ, ум. од.
|
508,50±407,21
|
356,44-660,56
|
679,50±649,04
|
477,24-881,75
|
р=0,21
|
|
Примітка. p- достовірність
Ступінь кореляції з даними біохімічними показниками різнився у пацієнтів різних груп. Так, якщо у пацієнтів з постінфарктним кардіосклерозом СКІ мав високий ступінь кореляції лише з ЛПНЩ (r=0,55) (рис. 7.6), з ЗХС (r=0,58) (рис. 7.7), та не високий з CPП (r=0,33), то у пацієнтів з ЦД 2 типу спостерігався високий показник кореляції з ЛПДНЩ (r=0,65) (рис 6.4), з ТГ (r=0,65) (рис. 7.2), та з ІА ( r=0,67) (рис. 7.3), і з СРП (r=0,56), що можна пояснити особливостями обміну у даної групи пацієнтів.
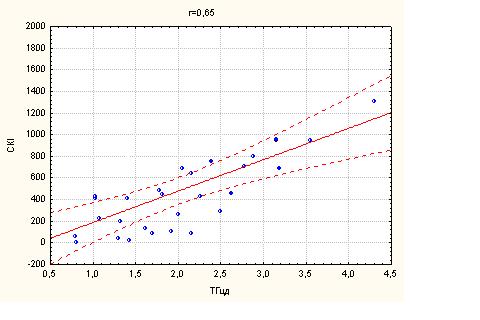
Рис. 6.2 Графік кореляції між СКІ та ТГ у хворих на ІХС з супутнім ЦД I2 типу. r=0,65, p<0,05
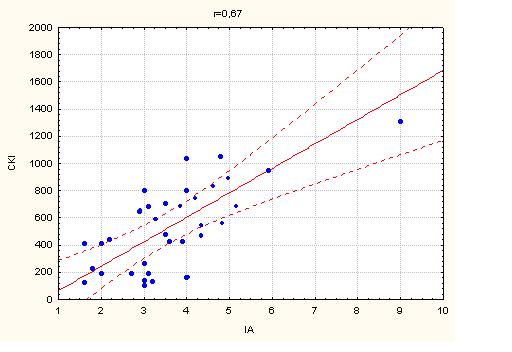
Рис. 6.3 Графік кореляції між СКІ та ІА у хворих на ІХС з супутнім ЦД 2 типу. r=0,67, p<0,05
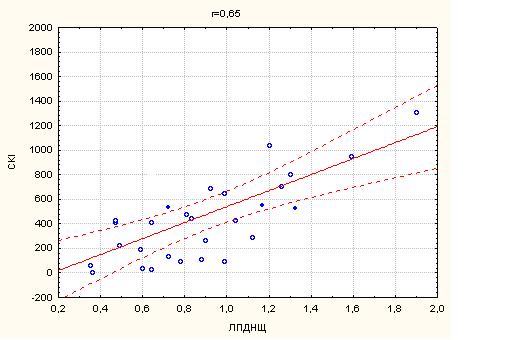
Рис. 6.4 Графік кореляції між СКІ та ЛПДНЩ у хворих на ІХС з супутнім ЦД 2 типу. r=0,65, p<0,05
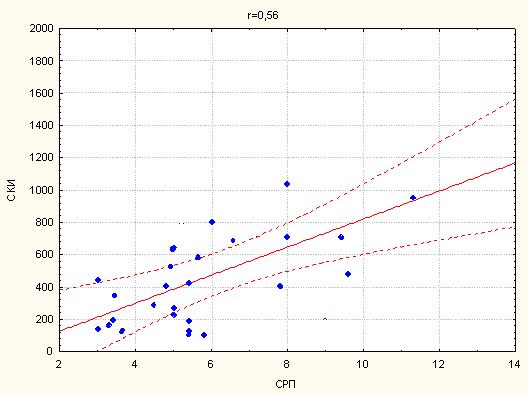
Рис. 6.5 Графік кореляції між СКІ та СРП у хворих на ІХС та супутнім ЦД 2 типу. r=0,56, р<0,05
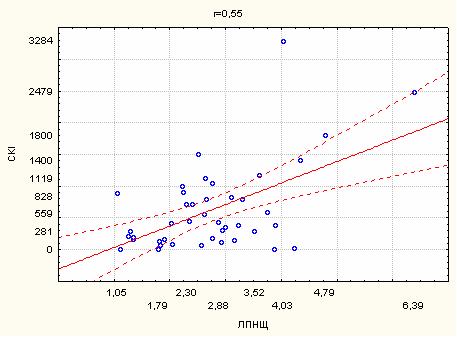
Рис. 6.6 Графік кореляції між СКІ та ЛПНЩ у хворих на ІХС та постінфарктним кардіосклерозом. r=0,55, p<0,05
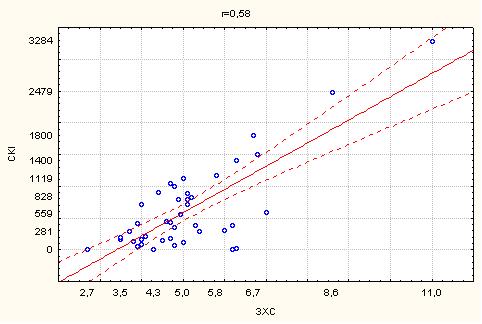
Рис. 6.7 Графік кореляції між СКІ та ЗХС у хворих на ІХС з постінфарктним кардіосклерозом. r=0,58, p<0,05
Очікувано високою була кореляція між СКІ і HbA1c (r=0,67) (рис. 6.1), що може свідчити про зв'язок ступеня компенсації цукрового діабету і інтенсивності кальциноза судин серця у пацієнтів з ЦД 2-типа. (табл. 7.2).
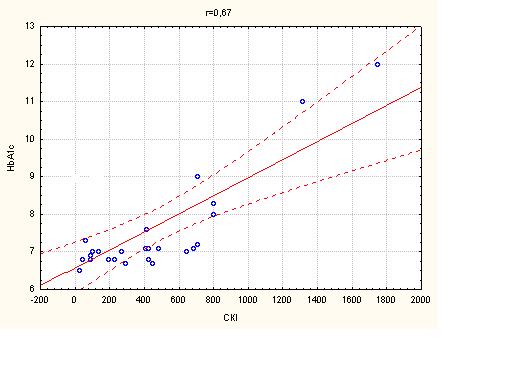
Рис. 6.1 Графік кореляції між СКІ та HbA 1c, % у хворих на ІХС з супутнім ЦД II типу. r=0,67, p<0,05.
Таблиця 6.2. Показники кореляційного зв’язку вуглеводного, ліпідного обмінів, CPП та СКІ у хворих на ІХС
|
Показники
|
Коефіцієнт кореляції з СКІ
|
|
ІХС+ЦД
|
ІХС+ПІКС
|
|
ЗХС, ммоль/л
|
0,32
|
0,58*
|
|
ТГ, ммоль/л
|
0,65*
|
0,10
|
|
ЛПНЩ, ммоль/л
|
0,21
|
0,55*
|
|
ЛПДНЩ, ммоль/л
|
0,65*
|
0,11
|
|
ЛПВЩ, ммоль/л
|
0,57
|
0,03
|
|
ІА, ум. од.
|
0,67*
|
0,45
|
|
CPП, мг/мл
|
0,56
|
0,33
|
|
Глюкоза, ммоль/л
|
0,15
|
0,097
|
|
HbA Ic, %
|
0,67*
|
-
|
Примітки:1.* - високий ступінь кореляції
2. р<0,05
6.3 Кореляційний зв’язок кальцієвого індексу коронарних судин з показниками екскреторної функції нирок
З метою дослідити вплив ЦД 2 типу на порушення екскреторної функції нирок (креатиніну плазми крові, ШКФ); ми проаналізували їх кореляційний зв'язок з СКІ у пацієнтів з ІХС, ГХ IIст без ЦД 2 типу, ( n1=30), у пацієнтів хворих на ІХС з постінфарктним кардіосклерозом давністю не більш 1 року (n3=42), у хворих на ІХС, ГХ IIст, з супутнім ЦД.2 типу (n2=30), та з HbAIc у пацієнтів хворих на ЦД 2 типу. Для оцінки ШКФ ми використовували розрахунковий кліренс креатиніну (КК) за формулою Cockcroft-Gault (1976) [31]:
для чоловіків КК = (140 – возраст) х масса (кг) / 72 х креатинін сировотки (мг/дл);
для жінок КК = ((140 – возраст) х масса (кг) / 72 х креатинін сировотки(мг/дл)) х 0,85.
Спостерігалось достовірне (р<0,05) збільшення рівня креатиніну сироватки крові в групах хворих з ІХС та постінфарктним кардіосклерозом, і в групі хворих , що мали ІХС та супутній ЦД 2 типу порівняно із групою хворих з ІХС (табл. 7.3).
Таблиця 6.3. Порівняльна характеристика рівня креатиніну і кліренсу креатиніна у пацієнтів хворих на ІХС
|
Показники
|
ІХС
n1=30
(M±SD)
|
ІХС+ЦД
n=30
(M±SD)
|
ІХС + ІМ
n2=30
(M±SD)
|
р
|
|
Креатинін(мкмоль/л)
|
73,80±13,70
|
99,23±27,38
|
89,43±223,62
|
р1,2<0,001
р2,3=0,10
р1,3<0,001
|
|
КК (мл/хв/1,73м2
|
111,87±31,61
|
86,86±29,054
|
108,73±34,04
|
р1,2<0,001
р2,3<0,001
р1,3=0,69
|
Примітка. p- достовірність
Таблиця6.4. Показники кореляційного зв’язку екскреторної функції нирок з вуглеводним обміном та сумарним кальцієви індексом
|
Показники
|
ІХС+ЦД
n=30
|
ІХС + ІМ
n2=30
|
|
r(HbAIc)
|
r(СKI)
|
r(СKI)
|
|
Креатинін(мкмоль/л)
|
0,67
|
0,61
|
0,31
|
|
КК (мл/хв/1,73м2
|
-0,55
|
-0,47
|
-0,34
|
Примітка. p <0,05
Кліренс креатиніну у хворих на ЦД 2 типу був достовірно нижчим (86,86±29,54 р<0,05), ніж у пацієнтів з інших груп дослідження, що вказує на зниження екскреторної функції нирок у хворих на ЦД.
Коефіцієнт кореляції КК та СКІ в групі пацієнтів хворих на ІХС з постінфарктним кардіосклерозом склав 0,34, в групі хворих ІХС з супутнім ЦД 2 типу – 0,47, що може бути пов’язано з системним ураженням артерій як еластичного (аорта та її гілки), так і мязовоеластичного типу (артерії серця, головного мозку, нирок та ін.) при атеросклерозі [20, 31](рис. 7.8).
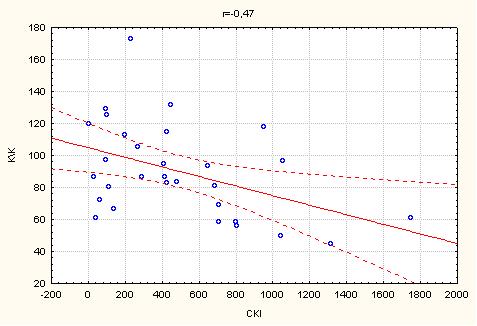
Рис. 6.8 Графік кореляції між СКІ та КК у хворих на ІХС з супутнім ЦД 2 типу. r=0,47, р<0,05
Коефіцієнт кореляції КК та HbAIc у пацієнтів з ЦД 2 типу був очікувано високим, і становив 0,55, що вказує на безпосередній зв'язок рівня компенсації цукрового діабета 2 типу та функціонального стану нирок (рис. 7.9).
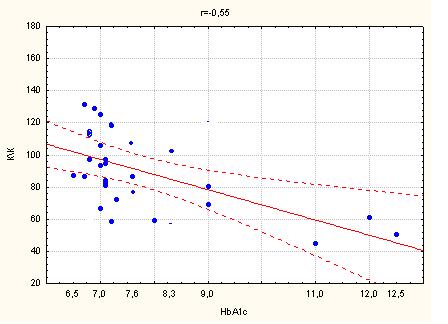
Рис. 6.9 Графік кореляції між HbA 1c, % та КК у хворих на ІХС з супутнім ЦД 2 типу. r=0,55, р<0,05
Таким чином, існує чітка паралель між формуванням і прогресуванням коронарного і не коронарного атеросклерозу, а також гломерулосклерозу з підвищенням ризику серцево-судинних і ниркових ускладнень [20].
Зважаючи на вище викладені результати дослідження, можна зробити висновки, що для пацієнтів з ІХС та супутнім ЦД 2 типу характерний ранній кальциноз великих судин серця за даними МСКТ. Крім того, виявлена висока кореляційна залежність між сумарним кальцієвим індексом і показниками вуглеводного обміну (HвA1c,%), ліпідного обміну (ЛПДНЩ, ТГ, ІА) і СРП у хворих на ІХС з супутнім ЦД 2 типу, що вказує на безпосередню причетність порушення вуглеводного, ліпідного обмінів, а також системного запалення на процес атерогенезу, який більшою мірою виражений у пацієнтів з ЦД 2 типу.
У хворих на ЦД 2 типу спостерігається раннє порушення екскреторної функції нирок, що проявляється відносним збільшенням рівня креатиніну плазми, зниженням швидкості клубочкової фільтрації, які можуть бути обумовлені прогресуванням загального атеросклероза судин і гломерулосклероза.
Підтвердженням цього припущення може бути виявлена кореляційна залежність між швидкістю клубочкової фільтрації та сумарним кальцієвим індексом і показником вуглеводного обміну (HвA1c,%).
Глава 7. Особливості сучасного лікування ІХС у хворих з ЦД
Чи впливає рутиний скринінг та лікування ІХС у безсимптомних пацієнтів з ЦД на прогноз захворювання?
Відомо, що ІХС у діабетиків часто протікає безсимптомно. Проте залишається не з'ясованим, чи поліпшить рутинний скринінг ішемії міокарду за відсутності її симптомів довгостроковий прогноз хворих на ЦД. Для відповіді на це питання американські і канадські учені провели рандомізоване контрольоване дос
|
АТ
протеїнурія 1г/24 год
|
<130/80
<125/75
|
|
HbA1c
Глюкоза венозноїкрови натщесерце
постпренадальна
|
≤6,5%
<6,0 мг/дл
<7,5 мг/дл
|
|
ЗХС
ЛПНЩ
ЛПВЩ
чоловіки
жінки
Тригліцериди
Індекс атерогеності
|
<4,5 мг/дл
≤1,8 мг/дл
>1,0
>1,2
<1,7
<3
|
Нижче представлена базова терапія лікування кардіоваскулярних ускладнень у хворих з ІХС та ЦД за рекомендаціями ESC\EASD 2007р:
1. Інгібітори АПФ рекомендовані як препарати першої лінії для хворих з ЦД із зниженням функції лівого шлуночка та симптомами серцевої недостатності, та без них (клас Ι, рівень доведення С).
2. Блокатори рецепторів ангіотензина обумовлюють східні ефекти у порівнянні з інгібіторами АПФ і можуть бути використані, як альтернатива, або у доповнення до інгібіторів АПФ (клас Ι, рівень доведення С).
3. β-блокатори, а саме метопролол, бісопролол, карведилол, небівалол рекомендовані, як препарати першої лінії при ЦД та СН (клас Ι, рівень доведення С).
4. Диуретики, у тому числі деякі петльові, є необхідними для симптоматичного лікування хворих на ЦД з затримкою рідини, що є наслідком СН (клас ΙIа, рівень доведення С).
5. Антагоністи альдостерону можуть бути доданими до лікування інгібіторами АПФ, β-блокаторами, діуретиками у хворих в випадку тяжкої СН (клас ΙIа, рівень доведення В).
6. Блокатори кальцієвих каналів, які застосовуються для корекції артеріального тиску та як протиішемічні препарати.
Складовими прогнозу є клінічні дані з урахуванням функціонального класу (ФК) по класифікації NYHA, переносимість фізичних навантажень, величини гемодинамічних, біохімічних, гормональних та імунологічних показників].
Вплив інгібіторів АПФ на клінічний перебіг ІХС у хворих з цукровим діабетом 2 типу
Одними з найбільш перспективних препаратів в лікуванні ІХС є інгібітори АПФ. Під дією цієї групи препаратів гальмується утворення потужного вазоконстриктора–ангиотензина II, що наводить до зменшення активності симпатичної нервової системи, ренин–ангиотензин–альдостероновой системи (РААС) і антидіуретичного гормону. Інгібітори АПФ володіють вазодилатирующим, діуретичним, ефектами і дозволяють знижувати проліферацію кліток в органах–мишенях.
ІАПФ допустимо використовувати у пацієнтів з помірно вираженою хронічною нирковою недостатністю, якщо рівень креатиніну в плазмі крові складає менше 300 мкмоль/л. При рівні креатиніну нижче 200 мкмоль/л застосовують середні терапевтичні дози ІАПФ. Якщо вміст креатиніну в плазмі вагається в межах від 200 до 300 мкмоль/л, добова доза ІАПФ має бути понижена в 2-4 рази, і використання цих препаратів повинне здійснюватися під ретельним динамічним контролем за рівнем креатиніну в плазмі крові. Найбільш частим побічним ефектом ІАПФ є сухий кашель, із-за якого 5-10% хворих вимушені відмовитися від їх вживання. На відміну від ІАПФ, антагоністи ангитензиновых рецепторів не провокують появу кашлю.
Особу увага заслуговує на лізиноприл – інгібітор АПФ з розширеною доказовою базою, перевірений часом, що багато разів доводить свої переваги для пацієнтів з ІХС, у тому числі на тлі таких захворювань, що значно ускладнюють ситуацію, як цукровий діабет та неаокогольний стеатогепатит.
У хімічній структурі лізиноприла присутня карбоксильна група. На відміну від більшості ІАПФ, лізиноприл не відноситься до проліків. Всмоктуючись в ШКТ, він не піддається подальшому метаболічному перетворенню і виводиться в незміненому вигляді нирками. Препарат володіє досить вариабельною біодоступністю – від 6 до 60%. Лізіопріл не ліпофілен і практично не зв'язується з білками плазми. Його дія починається за годину після вживання, пік ефекту розвивається через 4–6 годин, а тривалість дії досягає 24 годин, що забезпечує зручний режим призначення – однократно на добу.
Накопичено досить доказів протективного ефекту лизиноприла відносно органів-мішеней. Лізінопріл попереджає розвиток гіпертрофії міокарду ЛШ і викликає при тривалому лікуванні зменшення його маси. У дослідженні SAMPLE (Study on Ambulatory Monitoring of blood Pressure and Lisinopril Evaluation) пацієнти протягом року отримували лізиноприл в дозі 20 мг/сут, при необхідності в комбінації з ГХТ - в дозі 12,5-25 мг/сут. Лізінопріл не лише достовірно знижував АД (за даними офісного виміру і добового моніторування), але і викликав зворотний розвиток гіпертрофії міокарду ЛШ У дослідженні ELVERA (Effects of amlodipine and lisinopril on Left Ventricular mass) в 85 хворих, отримуючих лізиноприл в дозі 10-20 мг/сут протягом 2 років, індекс маси міокарду зменшився на 25,7 г/м2 Об'єм лівого передсердя є чинником ризику розвитку ряду серьозних ускладнень, найбільш частою з яких є фібриляція передсердь. Доведено, що терапія лізиноприлом сприяє зменшенню об'єму лівого передсердя і зменшенню ї мітральної регургітації навіть у хворих з органічною поразкою клапанів серця .Поліпшення ендотеліальної регуляції тонусу судин на тлі терапії лізиноприлом показане в невеликих дослідженнях у курців і хворих з дислипидемией .
У хворих з ЦД терапія інгібіторами АПФ сприяє не лише уповільненю прогресу ураження органів-мішеней, перш за все нефропатії, але і підвищенню чутливості тканин до інсуліну. Отримані докази ефективності лізиноприла в цієї групи хворих.
Так, у багатоцентровому дослідженні EUCLID (Randomised placebo-controlled trial of lisinopril in normotensive patients with insulin-dependent diabetes and normoalbuminuria or microalbuminuria) вивчався вплив лізноприла на діабетичну нефропатію і ретинопатію у хворих з ЦД2 без АГ. Терапія продовжувалася протягом 2 років. На момент закінчення дослідження рівень мікроальбумінурії в групі лізиноприла був на 18,8 % нижче, ніж в групі плацебо. Максимальний ефект спостерігався у хворих, що вже мали нефропатію на початку дослідження. У пацієнтів, отримуючих лізиноприл, рівень глікозильованного гемоглобіну був достовірно нижче (6,9% проти 7,3 %). Прогрес ретинопатії наголошувався в 13,2 % хворих в групі лізиноприла і в 24,3 % у групі плацебо .
До найцікавіших результатів дослідження можна віднести дані про зниження риски розвитку нових випадків ЦД у хворих, отримуючих лізиноприл, в порівнянні з приймаючими хлорталидон в дослідженні ALLHAT . Частота нових випадків ЦД, виявлених через 2 роки від початку лікування, була майже в 2 рази більше в групі хлорталидона, ніж в групі лізиноприла. Така сама тенденція зберігалася і через 4 роки. У хворих, які приймали лізиноприл, виявлений нижчий рівень глюкози крові. Ці відмінності стали достовірними вже через 2 роки дослідження і залишалися статистично значимими до його закінчення.
Результати цих і інших подібних досліджень дозволяють рекомендувати лизиноприл для призначення хворим з діабетичною нефропатією.
Крім того, відомо, що у хворих з кардіоваскулярною патологією, атеросклерозом, дисліпопротеїнемією в 90% випадків виявляється жирова інфільтрація печінки з елементами фіброзу, яка, є передстадією стеатогепатита. В 72% хворих з ІХС на тлі ЦД тип 2 діагностується хронічний стеатогепатит, що вимагає патогенетичної гепатопротекторной терапії. .
Гіперліпідемію (гипертриглицеридемию, гиперхолестеринемию або їх поєднання) часто відзначають при хронічному стеатогепатиті — в 20–81% випадків. Хоча дане захворювання зазвичай протікає доброякісно і безсимптомно, прогрес відзначають майже в половині випадків, а не менш ніж в 1/6 частини хворих розвивається цироз печінки.
З іншого боку відомо, що хворі з хронічним стеатогепатитом є групою підвищеного ризику по ІХС. Крім того, в 60% хворих було виявлено підвищення артеріального тиску. При дослідженні функціонального стану ЛШ в даної категорії хворих було виявлено ремоделювання ЛШ, яке прогресувало протягом 2-х літнього спостереження, що супроводжувалося ексцентричним типом гіпертрофії ЛШ. Крім того, у хворих з хронічним стеатогепатитом переважно спостерігається дисфункція діастоли ЛШ за типом порушення релаксації, що супроводиться підвищеною жорсткістю міокарду .
Вплив блокаторів рецепторів ангіотензину II на клінічний перебіг ІХС у хворих з цукровим діабетом 2 типу
Крім лідируючих позицій ІАПФ, як засоби лікування АГ при ЦД , настільки ж ефективним і доцільним вважається використання в цієї категорії хворих антагоністів рецепторів ангіотензину II (наприклад, лозартана - Козаар). За відсутності протипоказань ІАПФ або антагоністи ангиотензинових рецепторів повинні призначатися всім пацієнтам в яких АГ розвивається на фоні ЦД. Ці препарати ефективніше, ніж всі останні антигіпертензивні засоби, зменшують вираженість микроальбуминурии і протеїнурії (на 40%). Лише вони при проведенні багатоцентрових досліджень довели свою здатність в 5-6 разів уповільнювати темпи зниження швидкості клубочкової фільтрації і запобігати розвитку хронічної ниркової недостатності у пацієнтів з діабетичною нефропатією . Крім того, ІАПФ і антагоністи рецепторів ангіотензину II ефективно запобігають розвитку інсульту і гострого інфаркту міокарду при АГ , перевершують інші препарати по здатності знижувати вираженість гіпертрофії міокарду, є засобом вибору для лікування супутньої недостатності кровообігу . У багатоцентрових дослідженнях ІАПФ зменшували вираженість атеросклеротичного ураження коронарних артерій, знижували смертність при гострому інфаркті міокарду серед хворих з низькою фракцією викиду ЛШ, надавали антиканцерогенну дію.
Блокаторы ангиотензиновых рецепторів (БАР) – препарати, що пригнічують ренин–ангиотензиновую систему на рівні скріплення ангіотензину II з рецепторами типа 1 (АТ1–рецепторамі). Нефропротектівная активність БАР була підтверджена в дослідженнях RENAAL (для лозартана), IRMA–2 і IDNT (для ирбесартана), DETAIL (для телмисартана). З врахуванням результатів всіх цих досліджень ІАПФ і БАР увійшли до всіх європейських, американських і російських рекомендацій як препаратів першого ряду для лікування діабетичної нефропатії при ЦД типа 1 і 2. Ці препарати, призначені на стадії микроальбумінурии, повністю попереджають прогрес нефропатії, а призначені на стадії ХНН – подовжують додіализный період на 5–7 років.
Вплив блокаторів кальцієвих каналів на клінічний перебіг ІХС у хворих з цукровим діабетом 2 типу
Застосування антагоністів кальцію у хворих з ЦД тип 2 і АГ також є сповна виправданим, хоча по нефропротекторній дії ці препарати поступаються ІАПФ або антагоністам рецепторів ангіотензину II . Безперечною перевагою антагоністів кальцію є здатність попереджати напади варіантної (вазоспастичної) стенокардії і висока ефективність у літніх пацієнтів, включаючи здатність удвічі знижувати ризик розвитку деменції за наявності порушень мозкового кровообігу в анамнезі . Крім того, верапаміл і дилтіазем зменшують вираженість надшлуночкових аритмій, а дилтіазем підвищує також виживаність хворих з гострим інфарктом міокарду без зубця Q і зниження фракції викиду ЛШ. При ситуації, коли у хворого на ЦД тип 2, окрім АГ, є супутня недостатність кровообігу, вибір серед антагоністів кальцію слід зупиняти на амлодипіні і фелодипіні, безпека вживання яких при недостатності кровообігу (у складі комбінованої антигіпертензивної терапії) може сьогодні вважатися доведеною.
Для тривалого лікування АГ у хворих на ЦД тип 2 не слід використовувати короткодіючий нифедипин, який може підсилювати протеїнурію, посилювати прояви недостатності кровообігу, а у великих дозах (160-200 міліграм в добу) - погіршувати прогноз у хворих ІХС з постінфарктним кардіосклерозом.
Слід відмітити, що одна з дуже важливих знахідок дослідження ASCOT – зниження на 30% частота нових випадків розвитку цукрового діабету у хворих АГ, рандомізованих в амлодипіновую групу .
У дослідженні Syst-Eur було показано, що в 492 хворих з ЦД тип2 і АГ терапія за допомогою блокаторов кальцієвих каналів дигидропиридинового ряду (нитрендипин) призводила до зниження артеріального тиску систоли на 8,6 мм рт. ст. і діастоли – на 3,9 мм рт. ст. При цьому в групі хворих з діабетом було відмічено зменшення загальної смертності на 55 %, смертності від серцево-судинних захворювань – на 76 %, частоти розвитку всіх серцево-судинних захворювань – на 69 %, інсультів – на 73 %, ішемічній хворобі серця – на 63 %, що статистично достовірно перевищувало ефективність аналогічного лікування в групі пацієнтів, не страждаючих діабетом. В результаті активна антигіпертензивна терапія наводила до того, що ризик розвитку серцево-судинних захворювань у хворих цукровим діабетом не відрізнявся від такого в групі пацієнтів без діабету [203].
У дослідженні HOT вивчали ефективність впливу блокатора кальцієвих каналів фелодипіна, з подальшим додаванням препаратів інших груп, на серцево-судинну захворюваність і смертність. Воно включало 1501 хворого цукровим діабетом і артеріальною гіпертензією. При цьому хворі діабетом були розділені на наступні підгрупи: 501 пацієнт, в яких прагнули до досягнення рівня артеріального тиску діастоли менше 90 мм рт. ст., 501 хворий, в яких прагнули до підтримки тиску діастоли менше 85 мм рт. ст., і 499 пацієнтів, в яких метою антигіпертензивної терапії з'явилося зниження тиску діастоли менше 80 мм рт. ст. В результаті цього дослідження було встановлено, що в групі хворих з гіпертензією і діабетом, в яких середнє значення тиску діастоли було 81,1 мм рт. ст. в порівнянні з групою пацієнтів, в яких тиск діастоли складав 85,1 мм рт. ст., захворюваність ішемічною хворобою серця була знижена на 60 %, інсультом – на 43 %, серцево-судинна смертність знизилася на 77 % [204].
В дослідженні INSIGHT вивчався ефект застосування блокатора кальцієвих каналів (нифедипин пролонгованої дії) у порівнянні з діуретиками (гидрохлоротиазид і амилозид) в 1302 хворих ЦД і АГ. Встановлено, що ризик розвитку серцево-судинних захворювань не розрізнявся достовірно між групами хворих діабетом, що отримували блокаторы кальцієвих каналів або діуретики. В той же час, в групі пацієнтів, що отримували блокатор кальцієвих каналів, було виявлено достовірне (на 24 %) зниження об'єднаного показника частоти розвитку серцево-судинних захворювань і смертності від серцево-судинних і інших захворювань. [205 ]
Блокатори кальцієвих каналів не надають негативної дії на стан чутливості периферичних тканин до інсуліну, вміст глюкози крові, показники ліпідного обміну, вираженість клінічних проявів гіпоглікемічних реакцій. Серед 5019 пацієнтів, включених в дослідження INSIGHT і не хворіючих початково на ЦД, захворюваність діабетом протягом терміну дослідження була достовірно нижче в групі осіб, що отримували блокаторы кальцієвих каналів, чим в групі хворих з гіпертензією, що отримували діуретики (відповідно 4,3 і 5,6 %) У найбільшому дослідженні ALLHAT, було знайдено, що захворюваність ЦД під час дослідження (як через 2, так і через 4 роки після початку проекту) була достовірно нижче в групі пацієнтів, які застосовували блкатор кальцієвих каналів амлодипин, у порівнянні з хворими, що отримували діуретик хлорталідон, – відповідно 9,8 і 11,6%, через 4 роки дослідження.[206 ]
У літературі активно обговорюється питання про порівняльну ефективність різних класів антигіпертензивних препаратів в профілактиці серцево-судинних захворювань у хворих ЦД тип 2. У мета-анализе трьох досліджень: ABCD, FACET і STOP-2, що охопили 1318 хворих діабетом, було показано, що захворюваність інфарктом міокарду була в 2,2 разу вище у пацієнтів, що отримували терапію блокаторами кальцієвих каналів, в порівнянні з групою хворих, що лікуються інгібіторами ангиотензинпревращающего ферменту, хоча показники загальної смертності і смертності від серцево-судинних захворювань при цьому не розрізнялися [207]. В той же час в мета-анализе основних досліджень, проведених в загальній популяції хворих з артеріальною гіпертензією (STOP-Hypertension-2, NORD Il та інші), встановлено, що терапія за допомогою блокаторов кальцієвих каналів в порівнянні з використанням інших антигіпертензивних засобів першого ряду (перш за все діуретиків, бета-адреноблокаторов, ІАПФ) була декілька ефективнішою для запобігання інсульту і декілька менш ефективною для зниження риски ІХС за відсутності істотних відмінностей у впливи на показник загальної смертності [208]. У огляді досліджень, проведених в 1990–2000 рр., зроблено висновки, що в даний час не існує яких-небудь побоювань при призначенні блокаторов кальцієвих каналів хворим, страждаючим ЦД [209].
Вплив бета-блокаторів на клінічний перебіг ІХС у хворих з цукровим діабетом 2 типу
Сьогодні вже є аксіомою для лікарів необхідність призначення бета-адреноблокаторів у хворих з ІХС та ЦД тип 2.
Участь в патогенезі ІХС при ЦД і метаболічному синдромі підвищеної активності симпатичної нервової системи диктує необхідність вживання бета-блокаторів у лікуванні ІХС в даної категорії пацієнтів. Проте впродовж довгого часу застосування бета-блокаторов у хворих з порушеннями вуглеводного і ліпідного обміну було обмежено і навіть протипоказано. Зв'язано це було з несприятливим впливом неселективних бета-блокаторов на вуглеводний і ліпідний обмін. Багато селективних бета--блокаторів втрачають свою селективність у великих дозах і їх антагонізм виявляється і у відношенні бета-2-адренорецепторов, що призводить до розвитку гіпоглікемічних станів. У ряді випадків вони призводять до гіперглікемії і навіть до гиперглікемічної коми, блокуючи бета--адренорецепторы підшлункової залози, і, таким чином, гальмують вивільнення інсуліну. Несприятливий прогноз внаслідок підвищеної атерогености спостерігається при впливі бета-блокаторів на ліпідний обмін.
Але слід відмітити, що застосування таких бета-блокаторів як метопролол, карведілол, бісопролол та небіволол дозволено рекомендаціями ESC\EASD , оскільки цим препаратам не лише не властиві дисметаболічні ефекти, але і число нових випадків діабету на тлі їх прийому не збільшується, а зменшується порівняно з класичними бета-блокаторами. . Дослідження UKPDS довело, що застосування цих бета-блокаторов у пацієнтів з ЦД та АГ ефективно та безпечно як і лікування ІАПФ.[ 210 ]Польза применения бета-адреноблокаторов у больных сахарным диабетом, перенесших инфаркт миокарда, перевешивает риск их применения [ 211 ]Бісопролол – високоселективний бета1–адреноблокатор, що не володіє внутрішньою симпатоміметичною активністю і мембраностабилизируючим ефектом, з тривалим періодом напіввиведення (10–12 годин). У терапевтичних дозах (від 2,5 до 10 міліграма) препарат майже не проявляє блокуючої активності відносно бета2–адренорецепторов і тому не викликає таких метаболічних ефектів, як гіперглікемія, дислипидемия або гіпокаліємія, не робить ангіоспастичного впливу на артерії Фармакокінетичні особливості бисопролола - це висока біодоступність (> 90 %) і здатність розчинятися як в ліпідах, так і у воді, що обумовлює подвійну дорогу його елімінації – через печінку і нирки . Тому у хворих із захворюваннями цих органів корекція дози цього препарату не потрібна. Фармакокінетика бисопролола не залежить від патологічних змін білкового складу плазми крові, наприклад підвищення концентрації кислих альфа1–гликопротеидов, оскільки лише 30 % активної речовини пов'язано з білками плазми.
Бісопролол при тривалому вживанні не впливає на рівні атерогенных фракцій ліпідів (ТГ, ХС ЛПНП). У 13–місячному дослідженні у хворих на АГ, які отримували бисопролол в добовій дозі 5–10 міліграм, не було зареєстровано статистично достовірних змін вмісту ХС, ЛПНЩ і ЛПВЩ [212].У крупному дослідженні за участю 2723 хворих ІХС і ЦД тип 2 виявлено істотне зниження загальної смертності і смертності від серцево-судинних порушень на тлі лікування бета-адреноблокаторами [ 213 ] Підтверджені ефективність бисопролола і відсутність негативного впливу на чутливість тканин до інсуліну і метаболізм глюкози при тривалому лікуванні АГ у хворих ЦД тип 2 . При прийомі бисопролола в дозі 5-10 мг/сут протягом 24 тижнів не було виявлено значимих відмінностей рівнів глюкози плазми і гликозильованого гемоглобіну, а також концентрацій інсуліну після глюкозноого навантаження у порівнянні з вихідними показниками, тоді як систолічний, діастолічний і середній АТ достовірно знижувалися [214]. Таким чином, селективні бета-адреноблокаторы, такі як бисопролол, не посилюють перебіг ЦД, запобігаючи при цьому його мікро- і макросудинним ускладненням.
Вплив діуретиків на гіполіпідемічний та гіпоглікемічний профіль у хворих з ЦД.
Доведено, що застосування тіазидових діуретиків у хворих з ЦД призводить до підвищення інсулінорезистентності, гіперглікемії, гіперліпідемії.
Метаболічні зміни при застосуванні тіазидних діуретиків свідчать про необхідність мониторування показників електролітного балансу, ліпідного, вуглеводного обмінів, рівня сечової кислоти, креатиніну. До побічних ефектів тіазидних діуретиків відносять зниження сексуальної активності, фоточутливість, зникаючі після припинення прийому препаратів.
В той же час, при стандартному лікуванні АГ низькими дозами тіазидних діуретиків, що дають максимальний гіпотензивний ефект, відзначають мінімальні зміни біохімічних показників.
Тіазидні і тіазидоподібні діуретики можна умовно розділити на два покоління. Перше покоління — похідні бензотіадиазина: гидрохлортіазид, бендрофлюметіазид, політіазид; і фталімідину: хлорталідон і ін.
До другого покоління відносяться похідні хлорбензамида: індапамід, ксипамид і ін. і квиназалинона: метолазон.
Друге покоління тиазидоподобных діуретиків за свомих характеристиками нагадує петлеві діуретики. Індапамід, ксипамід, метолазон надають натрийуретичний і діуретичний ефекти при нирковій недостатності.
По-перше, індапамід інгібірує реабсорбцію іонів натрію, хлору, у меншій мірі, калія і магнію в проксімальних і дістальних канальцях короткого сегменту нефрону.
По-друге, індапамід усуває надлишковий вміст іонів натрію в судинній стінці, підвищує синтез простагландина E2 і J2, пригноблює приплив іонів кальцію у гладком'язових клітинах судинної стінки, в результаті виникає розширення судин і зниження їх чутливості до вазопресорних агентів (катехоламінів, тромбоксану) [215].Індапамід надає діуретичний ефект при вживанні дози 5 мг/сут, добовий діурез при цьому збільшується на 20 % від початкового. У дозах 1,25?2,5 мг/сут препарат діє, в основному, як периферичний артеріальний вазоділататор. По гіпотензивній активності индапамид перевершує в 30 разів дію спиронолактона, в 100 разів — фуросемида, в 30 разів — хлорталидона в разі вживання в порівнянних дозах. До того ж його антигіпертензивна ефективність в дозі 2,5 мг/сут не поступається 20 мг/сут эналаприла або 5 мг/сут амлодипина [216].
Загальний периферичний судинний опір при лікуванні індапамідом в дозі 2,5 мг/сут знижується на 10-15 %. За даними добового мониторирования АТ на тлі лікування відзначають рівномірне зниження АТ протягом доби, відсутні його підйоми в ранні утрішні години.
Препарат ефективний при нормальній і порушеній функції нирок.
Антигіпертензивна дія індапаміда визначається при помірному перебігу АГ приблизно в 70 % хворих. Антигіпертензивний ефект індапаміда виявляється через декілька днів лікування і поступово наростає. При тривалому лікуванні препаратом в 60 % хворих зберігається його антигіпертензивна дія.
Встановлено, що індапамід не володіє побічними метаболічними впливами, властивими тиазидным діуретикам. Він не надає негативної дії на вуглеводний обмін, не підвищує рівень атерогенных ліпідів крові. Дослідниками було відмічено, що на тлі лікування індапамідом відбувається зниження ЛПНЩ і триглицеридів, а також підвищення ЛПВЩ [217].
Окрім антигіпертензивної дії індапамід викликає регрес гіпертрофії ЛШ у хворих на АГ. Шестимісячна терапія індапамідом в дозі 2,5 мг/сут наводила до зменшення індексу маси ЛШ на 13,3 % [218].
Індапамід володіє нефропротективною дією на відміну від тіазидних діуретиків. При тривалому (2 роки) лікуванні препаратом хворих АГ з функціональною недостатністю нирок було відмічено збільшення швидкості клубочкової фільтрації на 28 %.[219]. При діабетичній нефропатії поліпшення мікроциркуляції на тлі лікування індапамідом супроводилося зменшенням екскреції альбуміну з сечею.
Таким чином, індапамід серед тіазидных і тіазидоподібных діуретиків є засобом вибору для лікування АГ у хворих з дислипопротеидемией, цукровим діабетом і помірною нирковою недостатністю.
Слід зазначити фармако-экономические аспекти вживання тіазидних і тфазидоподібних діуретиків. Низька вартість препаратів в порівнянні з іншими антигіпертензивними засобами є перевагою діуретиків. Доступність лікарського препарату, призначеного для тривалої довічної терапії, підвищує прихильність пацієнтів до лікування.
Вплив гіполіпідемічної терапії на клінічний перебіг ІХС у хворих з цукровим діабетом 2 типу
В наш час виділяють чотири основні групи гиполипидемических препаратів: інгібітори 3-гидроксі-3метилглутарилкоензим- А- редуктази або статины, похідні фібрової кислоти або фібрати, секвестранти жовчних кислот і нікотинова кислота і її похідні.
Безперечні успіхи первинної і вторинної профілактики ІХС у хворих ЦД типа 2 зв'язані із застосуванням статинов – препаратів першого ряду вибору для корекції дисліпопротеїнемій у хворих ЦД типа 2. Статини – інгібітори 3-гидроксі-3-метилглутарил- коензим- А- редуктази, ключового ферменту внутріклітинного синтезу ХС. Блокада ферменту призводить до зниження утворення ХС в клітках печінки, до збільшення кількості рецепторів ЛПНЩ в гепатоцитах, підвищеному захвату і витяганню ними з кровотоку самого атерогенного класу ліпідів – ЛПНЩ. Кінець кінцем дія статинов супроводиться значним зниженням рівня ЛПНЩ і загального ХС в крові. Статини, відкриті в 70-х роках XX століття, відносяться до найбільш ефективних і безпечних засобів корекції ліпідних порушень. Позитивні ефекти статинов визначаються не лише безпосереднім впливом на синтез ХС, але і такими не менш важливими властивостями, как:
• поліпшення функції ендотелія,
• зменшення процесів окислення ЛПНЩ,
• стабілізація фіброзної капсули атеросклеротичної бляшки,
• стабілізація ліпідного ядра,
• протизапальна дія,
• зменьшення тромбоутворення.
До теперішнього часу найбільш крупні дослідження по корекції дислипопротеїнемій статинами включали невелике число хворих і проводилися в рамках вторинної профілактики ІХС, тобто у хворих зі встановленою ІХС. До таких досліджень відносяться 4S, CARE, LIPID, в яких взяли участь 4444, 4159, 9014 чоловік, у тому числі хворих з ЦД 201, 603 і 777 чоловік відповідно. Результати цих рандомізованих плацебо -контрольованих досліджень, відповідних всім вимогам доказової медицини, дозволили зробити висновок про безперечну необхідність лікування статинами хворих з ІХС на тлі ЦД.
Проте залишалися цілий ряд невирішених питань:
• про доцільність лікування статинами хворих з ЦД без документованої ІХС, з метою первинної профілактики;
• про цільовий рівень зниження ЛПНЩ;
• про зниження ЛПНП через відсутність додаткової користі і можливого зростання побічних явищ, у тому числі впливу на функцію печінки у хворих з ІХС і стеатогепатитом.
• про безпеку і доцільність вживання статинов в осіб з поразкою мозкових і периферичних артерій при нормальному рівні ЛПНЩ, в літніх, жінок.
Підтвердженням найважливішої ролі, особливого місця статинов в профілактиці розвитку і прогресу ІХС і судинних ускладнень, а також відповіддю на низку запитань, що накопичилися, стали результати трьох найбільших проспективних досліджень по профілактиці серцево-судинних захворювань: ASCOT-LLA – Anglo-Scandinavian Cardiac Outcomes Trial-Lipid Lowering Arm, CARDS – Collaborative Atorvastatin Diabetes Study з використанням аторвастатина і HPS – Heart Protection Study із застосуванням симвастатина.
Дослідження ASCOT-LLA
Мета дослідження: вивчення кардіоваскулярних ускладнень у пацієнтів з АГ і рівнем ХС >6,5 ммоль/л і оцінка впливу терапії 10 мг аторвастатину порівняно з плацебо.
У рандомізоване подвійне сліпе багатоцентрове дослідження були включені 10 305 хворих, з яких 5168 чоловік було рандомізовано на прийом аторвастатина в дозі 10 мг і 5137 пацинтов отримували плацебо.
Вік хворих склав від 40 до 79 років. До включення в дослідження пацієнти не отримували фібраты і статины. Всі пацієнти мали 3 факторів ризику кардіоваскулярних захворювань і більш (гіпертрофія лівого шлуночку, зміни на ЕКГ, ЦД типа 2, захворювання периферичних судин, інсульт або ТІА, чоловіча стать, вік 55 років і старше, микроальбумінурія, протеїнурія, куріння, спадковість з серцево-судинних захворювань і так далі).
Тривалість спостереження склала в середньому 3,3 років.
Результати дослідження: аторвастатин в порівнянні з плацебо понизив рівень ХС на 1,3 ммоль/л, ЛПНЩ на 1,2 ммоль/л, ТГ на 0,3 ммоль/л в рік. Рівні ЛПВЩ були порівнянні в обох групах. Частота нефатальних інфарктів міокарду і коронарних смертей в групі знизилася на 36% (склала 1,9%, а в групі плацебо – 3%), частота інсультів – на 27% (0,024), частота всіх кардіоваскулярних і коронарних ускладнень – на 29% (р=0,0005). Небажані явища з боку трансаминаз печінки не розрізнялися достовірно в обох групах.
Таким чином, аторвастатин в дозі 10 мг знижує частоту інфарктів міокарду, кардіоваскулярних ускладнень і інсультів у хворих з АГ і високим ризиком кардіоваскулярних захворювань і нормальним рівнем або невеликим підвищенням ХС.
Дослідження HPS (дослідження захисту серця)
Метою дослідження стала оцінка впливу симвастатина в дозі 40 мг і антиоксидантів (600 мг вітаміну Е, 250 мг вітаміну С, 20 мг бета-каротину), що приймаються щодня, на загальну смертність, смертність від ІХС, смертність від інших причин у пацієнтів з задокументованою ІХС або без ІХС, але що мають високий ризик її розвитку.
У рандомізоване подвійне сліпе багатоцентрове дослідження було включено 20 536 пацієнтів з ІХС або її високим ризиком (у тому числі ЦД).
Вік пацієнтів склав 40–80 років. Всі пацієнти мали ХС>3,5 ммоль/л (>135 мг/дл).
Вплив на рівень ліпідів крові: впродовж всього дослідження в групі хворих, отримуючих симвастатин, рівень ХС ЛПНП був достовірно нижче, ніж в групі плацебо. Середня відмінність рівнів ЛПНЩ склала 0,96±0,02 ммоль/л. Динаміка рівня загального ХС і ЛПНЩ не залежала від вихідних значень цих показників.
Вплив на смертність і серцево-судинні осложнения. Серед отримуючих симвастатин достовірно знизилася загальна смертність. Особливо вражаюче зниження смертності спостерігалося від серцево-судинних причин – на 17% і коронарной смертності – на 18% .
У групі симвастатину ризик розвитку інфаркту міокарду знизився в порівнянні з плацебо на 38%. Вражає виражене зниження в групі симвастатина ризику будь-якого інсульту на 25%, при цьому ризик ішемічного інсульту знизився на 30%. Прийом симвастатина не зробив негативного впливу на частоту геморагічного інсульту (відмінності з групою плацебо недостовірні). На тлі прийому симвастатина в порівнянні з групою плацебо достовірно знизилася потреба в процедурах коронарної реваскуляризації (на 30%) і процедурах некоронарних реваскуляризацій (на 16%).
Загальний ризик основних судинних подій (інфаркт міокарду, смерть від коронарних причин, інсульт, потреба в реваскуляризаціях) знизився в групі пацієнтів, приймаючих симвастатин, на 24%.
Достовірне зменшення основних судинних подій в групі симвастатина сталося незалежно від попереднього анамнезу по ІХС, віку, прийому інших препаратів (ацетилсаліцилова кислота, бета-блокаторы, ІАПФ), у пацієнтів, що палять і некурящих.
Особливий інтерес представляє група хворих зЦД .
У групі хворих ЦД, отримавших симвастатин, частота основних судинних подій була достовірно нижче, ніж в групі плацебо. У підгрупах хворих з ЦД з наявністю ІХС або без ІХС відмічені аналогічні тенденції. Особливо вражаючим був ефект прийому симвастатина в групі хворих з ЦД без ІХС, в якій частота основних судинних подій знизилася на 28% (p<0,0001) в порівнянні з групою плацебо.
Великий інтерес представляють дані по виділеній групі хворих у віці від 75 до 80 років, яким до закінчення лікування було від 80 до 85 років. У цій групі, що складалася з 1263 пацієнтів, частота серцево-судинних ускладнень була достовірно нижче у пацієнтів, отримуючих симвастатин (23,1%), в порівнянні з групою плацебо (32,3%).
Клінічно значиме підвищення АСТ (> 4 разів від вірхнього рівня норми) відмічене протягом всього періоду лікування постійно лише в 9 (0,09%) з 43 пацієнтів, приймаючих симвастатин, і 4 (0,04%) з 32, що приймали плацебо; відмінності статистично не були значимі. Також не було статистично значимих відмінностей в групах симвастатина і плацебо у хворих, що припинили лікування (0,5 і 0,3% відповідно).
Дослідження CARDS
У дослідженні порівняні результати лікування аторвастатином в дозі 10 мг/сут і плацебо хворих ЦД типа 2 з відносно низьким рівнем ЛПНЩ (максимальна межа включення 4,14 ммоль/л). У хворих не було захворювань коронарних, мозкових або периферичних судин, але був принаймні одна з наступних ознак високого ризику: гіпертонія, ретинопатія, альбумінурія, куріння.
Первинна кінцева точка CARDS була складеною і включала одне з наступних подій: гострої смерті від коронарної хвороби серця, нефатального інфаркту міокарду, госпіталізації із-за нестабільної стенокардії, коронарної реваскуляризації або інсульту, реанімації після зупинки серця.
Вторинні кінцеві крапки – смерть від будь-якої причини, будь-яка серцево-судинна кінцева подія, рівні ліпідів і липопротеїнів.
Всього у 132 центрах Ірландії і Великобританії були включені 2838 хворих (1428 чоловік в групі аторвастатина, 1410 чоловік в групі плацебо).
Вихідний рівень ЛПНЩ (медіани) – 3,05 ммоль/л в групі аторвастатина і 3,07 ммоль/л в групі плацебо. Тривалість спостереження кожної групи хворих склала приблизно 4 роки.
Вміст ЛПНЩ під час дослідження в групі аторвастатина в порівнянні з групою плацебо був менший в середньому на 40% (на 1,19 ммоль/л), рівень ТГ – в середньому на 21% (на 0,4 ммоль/л).
Вживання аторвастатина супроводилося високодостовірним зменшенням частоти виникнення первинної кінцевої крапки на 37%, причому це зменшення було однаковим в підгрупах хворих з вихідним ХС ЛПНП вище і нижче середнього рівня 3,06 ммоль/л. Результати в групі аторвастатина виявилися достовірно кращими відносно таких компонентів первинної кінцевої крапки, як гострі коронарні події – зменшення ризику на 36% і інсульти – зменшення ризику на 48%, реваскуляризації міокарду – на 31%.
Лікування добре переносилося, не було випадків рабдомиолиза. Між групами плацебо і аторвастатина була відсутня різниця по частоті серйозних побічних явищ.
CARDS показало, що у хворих з ЦД типа 2 з нормальним або помірно підвищеним рівнями ХС аторвастатин в дозі 10 мг/сут безпечний і високоефективний відносно зниження ризику першої серцево-судинної події, включаючи інсульт. Принциповим визначальним чинником має бути загальний серцево-судинний ризик.
Таким чином, підсумки досліджень HPS з використанням симвастатина і ASCOT-LLA, CARDS з використанням аторвастатина дозволяють зробити висновок про необхідність призначення статинів хворим з ЦД.
Корекція діабетичної дисліпідемії за допомогою фібратів.
Існує ще одна група гіполіпідемічних препаратів - похідні фиброєвої кислоти або фібрати. Класичне уявлення про механізм дії цих препаратів є наступним: підвищення активності ліпопротеїдліпази, яка розщеплює ліпопротеїди, багаті тригліцеридами, тобто пригноблення синтезу і секреції ЛДНЩ в печінці. Додатково похідні фиброєвої кислоти сприяють підвищенню концентрації Апо-a1-основного білка ЛПВЩ. Ліпідсніжающий ефект фібратів полягає в першу чергу у вираженому зниженні концентрації ТГ і ЛДНЩ, а також у виразному збільшенні вмісту ЛПВЩ. Наголошується також помірне зниження рівня загального ХС і ЛПНЩ. [ 220 ] Побічні дії фибратов (особливо третього покоління) мінімальні Експериментальні роботи французьких вчених дозволили виявити принципово нову дію фібратів, що дозволяє пояснити їх ефективність як при атерогенній дисліпідемії, так і при інших метаболічних порушеннях. Було встановлено, що похідні фіброєвої кислоти виступають як синтетичні лиганді (передавачі сигналів) між ядерними рецепторами, що активуються пероксисомальним проліфератом (ППАР), і певними ділянками генів, що безпосередньо впливають на їх активність. ППАРa локалізовані в печінці, м'язах, нирках і серці, де вони стимулюють катаболізм ліпідів. В результаті дії фибратов (агоністи ППАРa) змінюється активність деяких генів-мішеней. Так, під впливом фібратів відбуваються наступні зміни: 1) підвищення активності ліпаз - ферментів, розщеплюючих ТГ в ліпопротеїдах, багатих ТГ; 2) підвищення активності ферменту ацетил-Ко-А-синтетази, яка прискорює внутріклітинний транспорт ХС і знижує концентрацію вільних жирних кислот; 3) пряма дія на гени АПО-а, що сприяє підвищенню концентрації Апо-a, основних білків ЛПВЩ .[ 221 ] Клінічно це призводить до помірного зниження рівня ЛПНЩ на 25% (навіть при ізольованій гіперхолестеринемії), більш вираженому зменшенню концентрації ТГ - до 50% і підвищенню рівня ЛПВЩ на 25%. Разом з цим наголошуються зниження активності маркерів запалення, поліпшення інсулиночутливості в печінці і скелетних м'язах, зниження рівнів фібриногену і сечової кислоти в крові [222].У 2000 р. у відділі метаболічних порушень Державного науково-дослідного центру профілактичної медицини (м. Москва, Росія) було проведено дослідження по вивченню ефективності фенофібрата у пацієнтів з метаболічним синдромом. У цьому дослідженні тривалістю 8 нед фенофібрат поєднувався з b-адреноблокатором атенололом (50 мг). Початково пацієнти мали помірну гіперхолестеринемію і гіпертригліцеридемію у поєднанні з низьким рівнем ЛПВЩ. В цілому фенофібрат, нівелюючи негативні метаболічні дії атенолола, привів до достовірного зниження рівня загального ХС на 20%, ЛПНЩ на 33%, ТГ на 53% і підвищенню рівня ЛПВЩ на 24%. Разом з цим препарат дав інші метаболічні ефекти, а саме понизив концентрацію фібриногену на 14%, рівень сечової кислоти на 25% і інсулінорезистентність на 18%. Ці зміни є зумовлюючим чинником зниження сумарного коронарного ризику у хворих з метаболічним синдромом, оскільки 8-тижнева терапія фенофібратом у поєднанні з атенололом привела до 3-кратного зменшення сумарної коронарної риски (розрахунок по моделі ПРОКАМ) аж до безпечного рівня [224]. Безумовно, це служить заставою значного зниження серцево-судинних ускладнень, пов'язаних з атеросклерозом, в осіб з широким спектром порушень ліпідного обміну.
Одним з важливих аспектів оцінки ефективності гіполіпідемічної терапії є її вплив на стенози і розвиток клінічних проявів ІХС за даними коронарографії. Оскільки цукровий діабет - чинник дуже високого ризику розвитку атеросклеротичних захворювань, а зміни рівня ліпідів, які спостерігаються при цукровому діабеті, відповідають профілю дії фенофібрата, передбачувана доцільність вживання мікронізованого фенофібрата для протекції прогресу атеросклерозу у хворих цукровим діабетом 2-го типа була досліджена в подвійному сліпому контрольованому для плацебо дослідженні в Канаді і Європі [225]. .
Дослідження DAIS проводилося протягом 2-5 років в 418 хворих цукровим діабетом 2-го типа. Виявилось, що в групі, що отримувала мікронізований фенофібрат, мінімальний діаметр просвіту судини (діаметр на місці стенозу) за період лікування зменшився в значно меншій мірі, чим в групі, що отримувала плацебо (різниця 40%). Прогрес стенозу був на 42% меншим в групі активного лікування. Сумарна кількість гострих коронарних епізодів (включаючи кількість випадків смерті, інфарктів міокарду, операцію транслюминальной ангіопластики і аортокоронарного шунтування) в групі лікування мікронізованим фенофібратом була достовірна на 23% нижче, ніж в групі плацебо. Описані клінічні ефекти мікронізованого фенофібрата спостерігалися на тлі нормалізації, що була у хворих цукровим діабетом помірної дислипидемии: зниження рівня загального ХС на 9,8%, ЛПНШ на 5%, ТГ на 30% при підвищенні ЛПВЩ на 7%.
В кінці 2005 р. завершилося дослідження FIELD, присвячене вивченню ефективності фенофібрата в осіб з цукровим діабетом 2-го типа [226]. Критеріями включення в дослідження були наступні: наявність цукрового діабету 2-го типа (критерій ВОЗ), чоловіки і жінки у віці 50-75 років, рівень загального ХС 3-6,5 ммоль/л у поєднанні з відношенням загальний ХС/ЛПВЩ >4 або ТГ >1 ммоль/л. У дослідження були включені 9795 хворих з трьох країн (Австралія, Нова Зеландія і Фінляндія), яких розподілили в 2 групи: плацебо і фенофібрат 200 мг. Тривалість цукрового діабету склала 5 років, середній рівень гликозильованого гемоглобіну - 6,9%. Серед хворих 37% склали жінки старше 65 років (40%). Документовану ІХС мали 22% хворих. В середньому пацієнти з цукровим діабетом початково мали м'яку гиперхолестеринемію (загальний ХС 5,03 ммоль/л і ЛПНЩ 3,07 ммоль/л), гіпертригліцеридемію (1,7 ммоль/л) і знижений рівень ЛПВЩ (1,1 ммоль/л). Низький рівень ЛПВЩ був виявлений у 59% пацієнтів, гіпертригліцеридемія - в 52%, поєднання цих порушень - в 38%. Через 4 мес сталося підвищення рівня ЛПВЩ на 5%, зниження рівня загального ХС і ХС ЛНП на 12%, ТГ на 28%. Основні результати дослідження були наступними: статистично незначиме зниження серцево-судинних подій на 11% і достовірне зниження частоти несмертельних випадків інфарктів міокарду на 24%. Слід зазначити, що в групі плацебо отримували статины 36% хворих, а в групі фенофібрата число хворих, додатково отримуючих статины, склало 19%. Після прийому статинів було виявлене, що зниження частоти серцево-судинних подій досягає 19%, що носить достовірний характер. З вторинних кінцевих крапок сталося статистично значиме зниження частоти коронарної реваскуляризації на 21%, а також інсультів на 11%. При цьому необхідність проведення лазерної терапії з приводу діабетичної ретинопатії знизилася на 30%, достовірно сповільнився прогрес альбуминурии і нефропатії. Аналіз кінцевих крапок в різних підгрупах пацієнтів з цукровим діабетом показує, що фенофібрат був ефективнішим в хворих без ІХС, у віковій групі молодше 65 років, у жінок, осіб з низьким рівнем ЛПВЩ і ЛПНЩ. У хворих з гіпертригліцеридемією, метаболічним синдромом, АГ, ожирінням зниження частоти серцево-судинних подій не досягло достовірних значень. За результатами дослідження FIELD можна зробити наступний висновок: гіполіпідемічна терапія з використанням фенофібрата сприяє зниженню макро- (до 20%) і мікросудинних (до 30%) ускладнень в осіб з цукровим діабетом у поєднанні з помірним коронарним ризиком.
За даними дослідження ACCORD виникло багато дискусій відносно переваг комбінованої терапії фенофібрата і симвастатина, застосування якої не знизило ризик фатальних серцево-судинних подій, нефатального ІМ або інсульту. Групу симвастатину з фенофібратом скали 5518 хворих, 4733 хворих затсосовували базову терапію. Всі хворі були з діагностованим ЦД тип 2 і високим кардіоваскулярним ризиком.
Враховуючи погляд доктора Roger Blumenthal (Медичний Центр Johns Hopkins , Балтімор, Меріленд) можна сказати, що у клінічній практиці більшість людей не додали б фібрати пацієнтам, поки рівні тригліцериду не були вищі чим 200 [mg/dL], але це можливо для зниження 5 –річного ризику розвитку кардіоваскулярних ускладнень.
Тому виникла пропозиція виділити підгрупу, в якої пацієнти з вищим рівнем ТГ і нижчими рівнем ЛПВЩ отримували б вигоду від додатку фібрата до симвастатину. В таких пацієнтах рівень ТГ досягав 284 mg/dL, приблизно на 120 mg/dL вище норми, і рівні ЛПВЩ були 29.5 mg/dL, приблизно 10 mg/dL нижче до норми. Серед цих пацієнтів зменшилися рівень ТГ, але рівень ЛПВЩ при застосуванні фібратів значно збільшився чим в групі без додатку фібратів.
Таким чином, ми можемо очікувати нових досліджень як post hoc так і нових про ефекти застосування фібратів у хворих з ІХС тв ЦД 2 тип.
Корекція діабетичної дисліпідемії за допомогою статинотерапії та урсодексохолевої кислоти
Відомо, що в усіх рекомендаціях АСС/AHA/ADA/ESC/Ассоціації кардіологів України по веденню хворих з ІХС, а також при проведенні, як первинної так і вторинної профілактики, підкреслюється необхідність терапії статинами, застосування яких знижує загальну і серцево-судинну смертність |7, 8, 9]. Метою призначення гіполіпідемічной терапії є зниження рівня ЗХС при вторинній профілактиці < 4,5ммоль/л і < 5,0 ммоль/л в популяції, ЛПНЩ при вторинній профілактиці < 2,5 і < 3,0 ммоль в популяції, підвищення ЛПВЩ > 1,0 у чоловіків і > 1,2 у жінок, ТГ < 2,0 [12, 13, 180].
Нами було обстежено 100 хворим з ІХС, стенокардією II–III Ф.К., у сполученні з ЦД 2 типу, яким було проведено дослідження біохімічних показників сироватки крові та дуплексне сканування екстракраніальних артерій.
На фоні базової та гіпоглікемічної терапії 30 хворих отримували урсодексохолевую кислоту , яку застосовували в дозі 12-13 мг/кг/доб. та аторвастатин в дозі 10 мг/доб. протягом року.
35 хворих отримували аторвастатин в дозі 20 мг/доб. протягом року.
Контрольну групу склали (60) хворих на ІХС, комбінованою з ЦД 2 типу, які відмовлялись приймати статини з різних причин.
Характер впливу УДХК та аторвастатину на прогресування атеросклеротичного процесу оцінювали шляхом визначення основних показників обміну ліпідів та ліпопротеїдів крові (ЗХС, ТГ, ЛПНЩ, ЛПДНЩ, ЛПВЩ), обміну вуглеводів (глюкоза сироватки крові та HbA1c), активності системного запалення (СРП) та стану судинного ремоделювання (визначення ТІМК каротид підчас дуплексного сканування екстракраніальних артерій).
Дослідження проводили підчас первинного огляду хворих, через 6 та 12 місяців від початку лікування.
Прийом аторвастатину протягом року значно зменшував атерогенність плазми крові порівняно з даними тієї ж групи хворих на початку дослідження, так рівень ЗХС знижувався на 26,5% (р<0,001), рівень ТГ – на 24,6% (р<0,05), ЛПНЩ – на 36% (р<0,001), ЛПДНЩ на 23,9% (р<0,05), ЛПВЩ підвищувався на 12,1% (р<0,001), ІА знижувався на 41,3% (р<0,001). Знижувався рівень маркеру системного запалення - СРП на 27% (р<0,01). Однак при цьому підвищувався рівень печінкових проб: АЛТ на 20,6% (р<0,05), та АСТ на 13,8% (р<0,05). Прийом аторвастатин не впливав на показники вуглеводного обміну (рівень глюкози сироватки крові та HbA1c), (табл. 8.1).
Таблиця. 7.1
Порівняльний аналіз ефективності гіполіпідемічної терапії у хворих з ІХС у сполучені з ЦД тип 2
|
Показник
|
Аторвастатин (n=35)
|
∆%
|
Контроль
(n=35)
|
|
|
До лікування
М±SD
|
Після лікування
М±SD
|
На початку
М±SD
|
1 рік
М±SD
|
|
|
ЗХС,
ммоль/л
|
6,23±1,55
|
4,58±1,01**
p<0,001
|
-26,5*
|
6,5±1,48
|
6,24±1,36
р=0,32
|
|
|
ТГ,
ммоль/л
|
2,07±1,22
|
1,56±0,55**
р=0,027
|
-24,6*
|
2,07±0,84
|
2,04±0,77
р=0,84
|
|
|
ЛПНЩ,
ммоль/л
|
4,05±1,26
|
2,59±0,88**
p<0,001
|
-36,0*
|
4,37±1,21
|
4,08±1,22
р=0,19
|
|
|
Продовж. табл. 8.1
|
|
|
Показник
|
Аторвастатин (n=35)
|
∆%
|
Контроль
(n=35)
|
|
|
До лікування
М±SD
|
Після лікування
М±SD
|
На початку
М±SD
|
1 рік
М±SD
|
|
|
ЛПДНЩ,
ммоль/л
|
0,92±0,55
|
0,70±0,25**
р=0,034
|
-23,9*
|
0,92±0,38
|
0,95±0,62
р=0,75
|
|
|
ЛПВЩ,
ммоль/л
|
1,16±0,17
|
1,32±0,2**
p<0,001
|
+12,1*
|
1,12±0,20
|
1,09±0,25
р=0,46
|
|
|
ІА, ум. од.
|
4,33±1,33
|
2,54±0,73 **
p<0,001
|
-41,34*
|
4,81±1,5
|
4,9±1,7
р=0,76
|
|
|
СРП,
мг/мл
|
8,71±3,89
|
6,36±2,30**
р=0,003
|
-27.0*
|
8,65±3,62
|
7,74±2,84
р=0,6
|
|
|
HbA1c, %
|
8,23±1,40
|
7,96±1,01
р=0,36
|
-3,28
|
7,79±1,06
|
7,70±1,02
р=0,63
|
|
|
|
|
АЛТ,
ммоль/л
|
31,77±17,53
|
40,0±12,34**
р=0,026
|
+20,58*
|
32,38±12,39
|
37,37±12,82
р=0,03*
|
|
|
АСТ,
ммоль/л
|
28,43±9,83
|
33,00±8,51**
р=0,041
|
+13,85*
|
25,22±10,44
|
25,70±8,8
p=0,78
|
|
Примітки:
1. * – різниця показників достовірна у порівнянні з такими на початку дослідження у даній групі (р<0,05–0,001).
2. ** - різниця показників достовірна у порівнянні з групою контролю.
3. ∆% - зміна показника в групі аторвастатину у порівнянні з даними на початку дослідження.
Внаслідок розвитку ураження паренхіми печінки і гепатоцелюлярного некрозу, який виражається в підвищенні трансаміназ печінки, особливо при хронічному стеатогепатиті, багато пацієнтів не можуть приймати достатньо тривалий час статини. Таким чином хворі не досягають цільових рівнів ХСЛПНЩ при лікуванні препаратами, що є у розпорядженні лікарів.
В даному випадку може виявитися доцільним застосування препарату, який володіє множинними властивостями, заснованими на численних механізмах його дії, що включають антихолестатичний, цитопротективний, гіпохолестеринемічний, літолітичний, імуномодулюючий, антиапоптичний ефекти. Таким препаратом є урсодоксихолєва кислота (УДХК) [9, 37].
Отримані дані свідчать про суттєву корегуючу дію комбінації УДХК + аторвастатин у дозі 10 мг на показники ліпідного обміну, активність системного запалення та судинного ремоделювання, але вплива на рівень глікемії виявлено не було. Так рівень СРП через один рік знижувався на 35,7% (р<0,01) порівняно з його рівнем до лікування. В цілому порівняно з результатами до лікування один через рік прийому УДХК +аторвастатин в дозі 10 мг зменшувався атерогенний потенціал плазми: рівень ЛПДНЩ зменшився на 20,2% (р<0,05), в той час як рівень ЛПНЩ зменшився на 25,6% (р<0,01). Рівень ЛПВЩ підвищився на 11,8 % (р<0,01). Рівень ТГ сироватки в групі УДХК +аторвастатин в дозі 10 мг достовірно зменшився на 21,5% (р<0,05). Також спостерігалася чітка тенденція до зниження ЗХС сироватки крові на 18,4% (р<0,01). В результаті зниження атерогенного потенціалу плазми (індекс атерогенності) скало 36,5% (р<0,01). Ми спостерігали зниження рівня АЛТ на 30,9% (р<0,01), та АСТ на 30,3% (р<0,01) (табл. 7.2).
При порівнянні гіполіпідемічного ефекту між групами, що отримувала терапію аторвастатином в дозі 20 мг/добу і комбіновану терапії УДХК +аторвастатин в дозі 10 мг достовірної різниці не було. Зниження рівня СРП також не мав достовірної різниці поміж груп (рис. 8.1, 8.2)
Таблиця.7.2
Порівняльний аналіз ефективності гіполіпідемічної терапії у хворих з ІХС у сполучені з ЦД тип 2
|
Показник
|
УДХК+аторвастатин (n=30)
|
∆%
|
Контроль
(n=60)
|
|
|
До лікування
М±SD
|
Після лікування
М±SD
|
До лікуванняМ±SD
|
Після лікування М±SD
|
|
|
ЗХС,
ммоль/л
|
5,98±1,13
|
4,88±1,20
р<0,01**
|
-18,4*
|
6,5±1,48
|
6,24±1,36
р=0,32
|
|
|
ТГ,
ммоль/л
|
2,14±0,94
|
1,68±0,56
р=0,02**
|
-21,5*
|
2,07±0,84
|
2,04±0,77
р=0,84
|
|
|
ЛПНЩ,
ммоль/л
|
4,02±1,18
|
2,89±1,26
р<0,001**
|
-25,6*
|
4,37±1,21
|
4,08±1,22
р=0,19
|
|
|
ЛПДНЩ,
ммоль/л
|
0,94±0,43
|
0,75±0,27
р=0,04**
|
-20,2*
|
0,92±0,38
|
0,95±0,62
р=0,75
|
|
|
ЛПВЩ,
ммоль/л
|
1,05±0,19
|
1,19±0,16
р<0,01**
|
+11,8*
|
1,12±0,20
|
1,09±0,25
р=0,46
|
|
|
ІА, ум. од.
|
4,90±1,43
|
3,11±0,96
р<0,001**
|
-36,5*
|
4,81±1,5
|
4,9±1,7
р=0,76
|
|
|
СРП,
мг/мл
|
9,42±4,18
|
5,40±0,37
р<0,001 **
|
-35,7*
|
8,65±3,62
|
7,74±2,84
р=0,6
|
|
|
HbA1c, %
|
8,20±1,54
|
7.79±0,95
р=0,22
|
-5.0
|
7,79±1,06
|
7,70±1,02
р=0,63
|
|
|
|
|
АЛТ,
ммоль/л
|
50,10±16,07
|
34,60±11,80
р<0,01
|
-30,9*
|
32,38±12,39
|
37,37±12,82
р=0,03*
|
|
|
АСТ,
ммоль/л
|
40,70±13,39
|
28,35±9,21
р<0,01
|
-30,3*
|
25,22±10,44
|
25,70±8,8
p=0,78
|
|
Примітка. * – різниця показників достовірна у порівнянні з такими до лікування (р<0,05–0,001).
2. ** - різниця показників достовірна у порівнянні з групою контролю.
∆% - зміна показника в групі УДХК+аторвастатин у порівнянні з даними на початку дослідження.
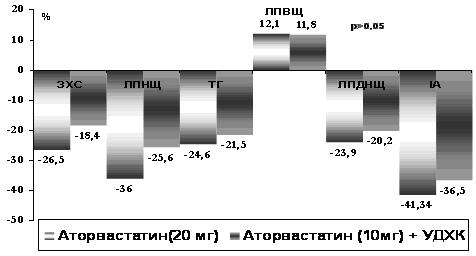
Рис. 7.1Порівняльний аналіз ефективності гіполіпідемічної терапії у хворих на ІХС і супутнім ЦД 2 типу
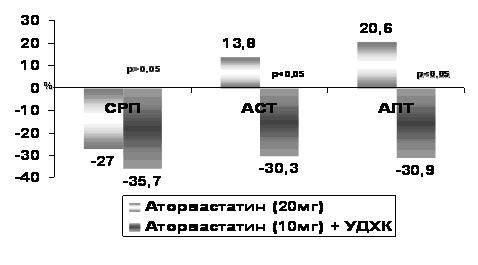
Рис. 7.2 Порівняльний аналіз ефективності та безпеки застосування гіполіпідемічної терапії у хворих на ІХС і супутнім ЦД 2 типу
При дослідженні показника товщини ІМК загальних сонних артерій під час дуплексного сканування екстракраніальних артерій достовірну позитивну динаміку порівняно з групою контролю спостерігали як в групі УДХК +аторвастатин в дозі 10 мг, так і у хворих, які приймали аторвастатин в дозі 20 мг, вже через 6 місяців від початку лікування.
При цьому вже через 6 місяців лікування в групах, які застосовували гіполіпідемічну терапію зменшення товщини ІМК було достовірним, в той час як в групі контролю товщина ІМК залишалася без суттєвої динаміки. Ця тенденція зберігалася і через один рік лікування (табл. 8.3).
Таблиця 7.3. Порівняльна характеристика динаміки товщини ІМК загальних сонних артерій у хворих з ІХС, комбінованою з ЦД ІІ типу протягом одного року лікування.
|
Товщина ІМК, см
|
УДХК+аторвастатин
М±SD(n=30)
|
Аторвастатин
М±SD(n=35)
|
Контроль
М±SD(n=35)
|
|
До лікування
|
0,14±0,03
|
0,14±0,03
|
0,14±0,03
|
|
Через 6 міс.
|
0,12±0,03,
р=0,01
|
0,12±0,03,
р=0,01
|
0,14±0,03,
р=1
|
|
Через 12 міс.
|
0,10±0,02,
р<0,01
|
0,10±0,03,
р=0,01
|
0,14±0,03,
р=1
|
Отримані дані свідчать про те, що зменшення дози статину у комбінації з УДХК у хворих на ІХС у сполученні з ЦД 2-го типу не впливає на ліпідкоригуючий ефект гіполіпідемічної терапії, має позитивний вплив на показник товщини комплексу інтима-медіа загальної сонної артерії, що є незалежним маркером прогресування атеросклеротичного процесу (рис.7.3).
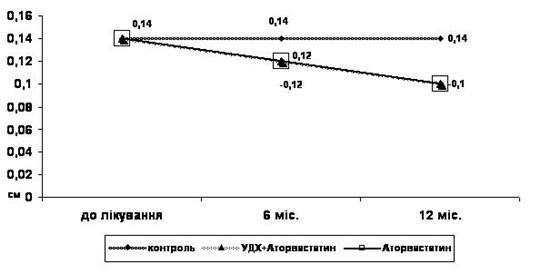
Рис.7.3 Динаміки товщини ІМК ЗСА у хворих на ІХС і супутнім ЦД 2 типу протягом 1-го року під дією ліпідознижуючої терапії (р<0,05).
Таким чином комбінована терапія аторвастатином і урсодезоксихолієвою кислотою дозволяє зменшити дозу статину, що не впливає на ліпідокоригуючий ефект гіполіпідемічної терапії при збереженні гепатопротекторної дії, має позитивний вплив на показник товщини комплексу інтима-медіа загальної сонної артерії у хворих на ІХС з супутнім ЦД 2 типу.
Список літератури:
1. Абдуллаев Р.Я. Эхокардиографические показатели систолической и диастолической функций левого желудочка при ишемической кардиомиопатии // Укр. кардіол. журн. - 2002. - № 2. - С. 23-27.
2. Александров О.В. Метаболический синдром / Александров О.В., Григорьев С.П. // Российский медицинский журнал. 2000.- № 6.-С.50-55.
3. Аметов А.С. Особенности безболевой ишемии миокарда у больных инсулиннезависимым сахарным диабетом / А.С. Аметов, В.А. Орлов, С.С. Жестовский // Проблемы эндокринологии. - 2000. - №4. – С.9-12.
4. Амосова Е.Н. Сахарный диабет и ишемическая болезнь сердца / Е.Н. Амосова // Журн. АМН Украины. 2000.-Т. 6. - № 3.- С. 508-516.
5. Балаболкін М.І. Роль окислювального стресу в патогенезі судинних ускладнень діабету / Балаболкін М.І., Клебанова Е.М. // Проблеми ендокринології. - 2000. - № 6. - С. 29-34
6. Бєлова Л.А. Зв’язки предикторів електричної нестабільності міокарда з показниками ліпідів крові та маркерами запалення у хворих на цукровий діабет 2 типу / Бєлова Л.А., ПанчИшин М.В., Шуфлат Т.А. // Матеріали ХV з’їзду терапевтів України. (Київ, 21-24 квітня 2004.) – С. 123-124.
7. Бобров В.О. Дослідження варіабельності серцевого ритму у кардіологічній практиці / Бобров В.О., Долженко М.М., Жаріков О.Й. – Київ: Міністерство охорони здоров’я України, Український центр наукової медичної інформації і патентно-ліцензійної роботи, 2004.-24с.
8. Боднар П.Н. Особливості терапії цукрового діабету типу 2 / Боднар П.Н., Міхальчишин Г.П. // Містецтво лікування. - 2005. №4. - С. 56-66.
9. Буеверов А.О. Возможности клинического применения урсо-дезоксихолевой кислоты / А.О. Буеверов // Consilium Medicum. – Гастроэнтерология . – 2005.-Т. 7.-№6.
10. Гуревич М.А. Особенности патогенеза и лечения ишемической болезни сердца, сердечной недостаточности и артериальной гипертензии у больных сахарным діабетом / М.А. Гуревич // Клиническая медицина. - 2005. - №1. – С. 4-9.
11. Денисюк П. В. Ремоделювання та аритмія при ішемічній хворобі серця у поєднанні з цукровим діабетом 2 типу / П. В. Денісюк // Матеріали VII Національного конгресу кардіологів України за редакцією Коваленка В.М. - 2004. - 159 с.
12. Діагностіка, профілактика та лікування дисліпідемій: методичні рекомендації робочої групи Українського наукового товариства кардіологів з проблеми атеросклерозу та хронічних форм ІХС.-Київ., 2004.- 36с.
13. Доборджгинадзе Л. Особливості діабетичної дісліпідемії і шляхи її корекції: ефект статинів / Л. Доборджгинадзе, Я. Грацианський // Проблеми ендокринології - 2001.- Т. 47. - №5. -С. 35-40.
14. Ефимов А. Диабетическая невропатия / А. Ефимов, Н. Скробонская, Н. Зуєва // Ліки Україні. - 2005. - №3. 21-25.
15. Ефимов А.С. Актуальные вопросы лечения сахарного диабета и его осложнений / А.С. Ефимов, Б.Н. Маньковский, Е.П Костюк // Журн. АМН Україні. - 2000. - Т. 6. - № 3 - С. 460-471.
16. Ефимов А.С. Клиническая диабетология / Ефімов А.С., Н.А.Скробонская – К.: Здоров’я, 1998. – 320 с.
17. Зелінський Б.А. Функціональний стан серцево-судинної системи при цукровому діабеті. Київ, 2004. - 225 с.
18. Зубкова С.Т. Серце при ендокринних захворюваннях./ Зубкова С.Т., Тронько М.Д. - К., 2006.- 15-16С.
19. КовальД.М. Зміни змісту маркерів запального процесу в плазмі крові у хворих цукровим діабетом II типу під впливом сімвастатина / Д.М. Коваль, Б.Н. Маньковський // Український кардіол. журн. 2003.- № 3. - С. 90-93.
20. Кобалава Ж.Д. Кардиоренальный синдром / Ж.Д Кобалава., Т.Б. Дмитрова // Русский Медицинский Журнал.- 2008.- № 3.- С. 58-64.
21. Лутай М.І. Атеросклероз і запалення / М.І. Лутай // Серце i судини.-2004.- № 3.- С. 89-100.
22. Лутай М.И. Стабильная стенокардия напряжения и методы ее диагностики // Здоров’я України. – 2008. - № 5/1 – С. 18-20.
23. Левина Л.І. Сердце при эндокринных заболеваниях. Ленинград. Медицина.1998. - 264 с.
24. Маньковский Б.Н. Терапия СД 2 типа: вчера, сегодня, завтра. Результаты исследования ADVANCE / Б.Н. Маньковский // Здоров’я України. – 2008. - № 15-16 – С.12-13.
25. Михальчишин Г.П. Современные стратегии ведения пациентов с СД 2 типа: в центре внимания – профилактика сердечно-сосудистых осложнений / Г.П. Михальчишина, А.В. Зилова // Здоров’я України. – 2008. - № 21-24 – С.48-49.
26. Наказ МОЗ Україні № 271.
27. Наказ МОЗ Україні № 486
28. Нетяженко В. Атеросклероз при цукровому діабеті ІІ типу: стратегія лікування дисліпідемій / В. Нетяженко, О. Барна, Т. Соломенчук // Ліки Україні. – 2003. - №10. – С.4-10.
29. Пархоменко А.Н. Діагностичне і прогностичне значення маркера системного запалення С-реактівного протеїну у хворих з гострими коронарними синдромами / Пархоменко А.Н., Лутай Я.М., Пономарева Г.В.// Укр. кардіол. журн. – 2006. – № 2. – С. 11-17.
30. Петухов В.А. Лікарі різних спеціальностей, об'єднуйтеся! / В.А. Петухов Ліпідний дистресс-синдром Савельева // Фарматека. – 2005. - №6. – 28-33.
31. Сіренко Ю.М. Ураження органів-мішеней при артеріальній гіпертензії: профілактика, діагностика та лікування / Ю.М. Сіренко, В.М. Граніч, Г.Д. Радченко // методичні рекомендації.-Київ, 2003.- 42 с.
32. Соколов Е.І. Пошкодження міокарду і судин при цукровому діабеті / Е.І Соколов // Терапевтичний архів. - 2005. - №12. - С. 9-13.
33. Спесивцева В.Г. Деякі методи лікування цукрового діабету і його ускладнень / В.Г. Спесивцева, І.М. Кахновський, Г.Г. Мамаєва // Терапевтический архив. - 2002. - №3.-С. 105-108.
34. Старкова Н.Т., Вплив гиполіпідемічної терапії на стан вуглеводного і ліпідного обміну і їх гормональних регуляторів у хворих цукровим діабетом типу 2 / Н.Т. Старкова, В.В. Долгов, А.Л. Давидов // Проблеми ендокринології. - 2003.- Т. 49. -№1. - С. 24-28.
35. Флетчер Р. Клиническая эпидемиология. Основи доказової медицини. / Р. Флетчер, С. Флетчер, Е. Вагнер; [перевод с анг.] – М.: Медиа Сфера. 1998.-352с.
36. Шевченко Ю.Н. Сучасні адсорбційні матеріали для ентеросорбції.// Біосорбційні методи і препарати в профілактичній та лікувальній практиці.- Київ. – 2005.- С.6-10.
37. Шипулин В.П. Хронический стеатогепатоз: проспективное исследование функционального состояния сердечно-сосудистой системы / В.П. Шипулин, М.Н. Долженко // Крымский медицинский журнал. – 2006. - №3 – С.12-16.
38. Agatston Quantification of coronary artery calcium using ultrafast computed tomography // J. Ammer. Coll. Cardiol.-1990.-Vol.15. – P.827-832.
39. American Diabetes Association Position Statement: Diabetes nephropathy // Diabetes Care.- 2004.- Vol.27, Suppl 1. – P. S79. [PMID: 14693434].
40. American Diabetes Association Position Statement: Preventive foot care in people with diabetes // Diabetes Care.- 2004. - Vol.27, Suppl 1. – P. S63. [PMID: 14693928]
41. American Diabetes Association. Tretement of hypertension in adults with diabetes // Diabetes Care. — 2003. — Vol. 26, Suppl. 1. — P. S80-S82.
42. American Diabetes Association: Clinical practice recommendations 2006 // Diabetes Care.- 2006.- Vol. 29, Suppl. 1.- P. S1-S85.[PMID: 16482699]
43. Anders K. Coronary artery bypass graft (CABG) patency: assessment with high-resolution submillimeter 16-slice (MDCT) versus coronary angiography / Anders K. // Eur J Radiol. 2006.- Mar.- Vol. 57(3).-Р. 336-44.
44. Andersen J.L. Diabetic macroangiopathy and atherosclerosis / Andersen J.L., Fasmussen L.M., Ledet T. // Diabetes. 1996. № 45. Suppl. 3 - P. 91-94.
45. Barnes E. Prolonged left ventricular dysfunction occurs in patients with coronary artery disease after both dobutamine and exercise induced myocardial ischaemia / Barnes E., Baker C.S.R., Dutka D.P., et al. // Heart. - 2000. - Vol. 83. - P. 283 - 289.
46. Bell S.P. Alterations in the determinants of diastolic suction during pacing tachycardia / Bell S.P., Nyland L., Tischler M.D., et al. // Circ. Res. - 2000. - Vol. 87. - P. 235–240.
47. Bella J.N. Relationship Between Left Ventricular Diastolic Relaxation and Systolic Function in Hypertension. - P. The Hypertension Genetic Epidemiology Network Study / Bella J.N., Palmieri V., Liu J.E., et al. // Hypertension. - 2001. - Vol. 38. - P. 424 - 428.
48. Bertrand M. E. Mangment of acute coronzry syndroms in patients presenting without persistent ST-segment elevation. / Bertrand M. E., Simoons M.L., Fox Keith A. // Eur. Heart J.- 2002. – № 23. – P. 1809-1840.
49. Bickel C. Relation of markers of inflammation (C-reactive protein, fibrinogen, von Willebrand factor, and leukocyte count) and statin therapy to long-term mortality in patients with angiographically proven coronary artery disease / Bickel C., Rupprecht H.J., Blankenberg S. et al. // Am. J. CARDIOL- 2002.- Vol. 89.- P. 901-908.
50. Blake G.J. Novel clinical markers of vascular wall inflammation / Blake G.J., Ridker P.M. // Circ. Res.- 2001.- Vol. 89.- P. 763-771.
51. Bos G. The relationship of lipoprotein lipase activity and LDL size is dependent on glucose metabolism in an elderly population. The Hoorn Study / Bos G., Scheffer P.G., Vieira D. et al. // Diabetes Care. – 2004. – Vol. 27. – P. 796-798
52. Brilla C.G. Lisinopril-mediated regression of myocardial fibrosis in patients with hypertensive heart disease / Brilla C.G., Funck R.C., Rupp H. // Circulation. - 2000. - Vol. 102. - P. 1388–1393.
53. Byberg L. Changes in physical are associated with chanqes in metabolic cardiovascular risk factors. / Byberg L, Zethelius В., McKeiguen P.M. // Diabetologia. 2001. 44. 12. -P. 2134-2139.
54. Lehto S. Cardiovascular risk factors clustering with endogenous hyperinsulinaemia predict death from coronary heart disease in patients with Type 2 diabetes / S. Lehto, T. Ronnemaa, K. Pyorala, M. Laakso // Diabetolo- gia.- 2000.- Vol. 43 № 2.- P. 148-155.
55. Caruana L. Do patients with suspected heart failure and preserved left ventricular systolic function suffer from “diastolic heart failure” or from misdiagnosis? A prospective descriptive study / Caruana L., Petrie M.C., Davie A.P., et al.// Circulation. - 2000. - Vol. 98. - P. 1224 - 1229.
56. Cazolla O. Differential expression of cardiac titin isoforms and modulation of cellular stiffness / Cazolla O., Freiburg A., Helmes M., et al. // Circ. Res. 2000. - Vol. 86. - P. 59-67.
57. Cerisano G. Echo-Doppler evaluation of left ventricular diastolic dysfunction during acute myocardial infarction: methodological, clinical and prognostic implications / Cerisano G., Bolognese L. // Ital. Heart J. - 2001. - Vol. 2(1). - P. 13-20.
58. Chan К.У. HMG-CoA reducta-se inhibitors for lowering elevated levels of C-reactive protein / Chan К.У., Boucher E.S., Gandhi PJ., Silva M.A. // Am. J. Health-Syst Pharm.- 2004- Vol. 61 (16).- P. 1676-1681.
59. Cheitlein. ACC/AHA Guidelines for the Clinical Application of Echocardiography // Circulation. - 1997. - Vol. 95. - P. 1686-1744.
60. Cheukman Yu. Progression of Systolic Abnormalities in Patients With "Isolated" Diastolic Heart Failure and Diastolic Dysfunction / Cheukman Yu, Hong Lin, Hua Yang, et al. // Circulation. - 2002. - Vol. 105. - P. 1195-1201.
61. Cooper G.I.V. Cardiocyte cytoskeleton in hypertrophied myocardium // Heart Failure Rev. - 2000. - Vol. 5. - P. 187-201.
62. de Berrazueta J.R. Effect of transdermal nitroglycerin on inflammatory mediators in patients with peripheral atherosclerotic vascular disease / de Berrazueta J.R., Sampedro I., Garcia-Unzueta M.T // Am. Heart J.— 2003.- Vol. 146 (4).- P. 14.
63. Despres J.P. Hyperinsulinemia as an independent risk factor for ischemic heart disease / J. P. Despres, B. Lamarche, P. Mauriege et al. // N. Engl. J. Med.- 2006- Vol. 348.- P. 952-957.
64. de Napoli M. Angiotensin-converting enzyme inhibitor use is associated with reduced plasma concentration of C-reactive protein in patients with first-ever ischemic stroke | De Napoli M., Papa F. // Stroke.— 2003.— Vol. 34 (12).- P. 2922-2929.
65. Di Biase. The magnitude of reverse remodelling irrespective of aetiology predicts outcome of heart failure patients treated with cardiac resynchronization therapy / Di Biase, A. Auricchio, A. Sorgente, K. Civetlo, С Klersy F. Faletra, L. Riedlbauchova, D. Patel, M. Arruda , et al. // Eur. Heart J., 2008. - Vol. 29. - P. 2497 - 2505.
66. Duchen L.W. Pathology of autonomic neuropathy in diabetes mellitus / Duchen L.W., Anjorin A. // Ann. Intern. Med. 1980. V. 92. - P. 301 -303.
67. Eberli F.R. Lack of Direct Role for Calcium in Ischemic Diastolic Dysfunction in Isolated Hearts / Eberli F.R., Strömer H., Ferrell M.A., et al.// Circulation. - 2000. - Vol. 102. - P. 2643 - 2649.
68. Guidelines on diabetes, pre-diabetes, and cardiovascular diseases: executive summary. The Task Force on Diabetes and Cardiovascular Diseases of the European Society of Cardiology (ESC) and of the European Association for the Study of Diabetes (EASD) // European Heart Journal. -2007/ - Vol. 28.-P. 88-136.
69. European Society of Cardiology Committee for Practice Guidelines. European guidelines on cardiovascular disease prevention in clinical practice: third joint task force of European and other societies on cardiovascular disease prevention in clinical practice (constituted by representatives of eight societies and by invited experts) / G. De Backer, E. Ambrosioni, K. Borch-Johnsen et al. // Eur. J. Cardiovasc. Prev. Rehabil.- 2003.- Vol. 10, Suppl. 1.- P. S1- 8.
70. European Study Group on Diastolic Heart Failure. How to diagnose diastolic heart failure // Eur. Heart J. - 1998. - Vol. 19. - P. 990–1003.
71. Evans J. Are oxidative stress-activated signaling pathways mediators of insulin resistance and b-cell dysfunction?/ Evans J., Goldfine I., Maddux B., Grodsky G.M. // Diabetes. – 2003. – Vol. 52. – P. 1-8.
72. Executive Summary of The Third Report of The National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, And Treatment of High Blood Cholesterol In Adults (Adult Treatment Panel III). Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults // JAMA.- 2001.- Vol. 285 - № 19.- P. 2486-2497
73. Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults. Executive Summary of the Third Report of The National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, And Treatment of High Blood Cholesterol In Adults (Adult Treatment Panel III).// JAMA. 2001. – Vol.285. – P.2486 –2497.
74. Feskens E.J. Glucose tolerance and the risk of cardiovascular disease: the Zutphen Study / Feskens E.J., Kromhout D. //J. Clin.Epidemiol.- 2005.- Vol. 45 № 11.- P. 1327-133.
75. Fichtlscherer S. Inflammatory markers and coronary artery disease / Fichtlscherer S., Heeschen C., Zeiher A.M. // Curr. Opin. Pharmacol.- 2004.- Vol. 4 (2).- P. 124-131.
76. Fischer M. Prevalence of left ventricular diastolic dysfunction in the community. - P. Results from a Doppler echocardiographic-based survey of a population sample / Fischer M., Baessler A., Hense H.W., et al. // Eur. Heart J.- 2003. - Vol. 24. - P. 320 - 328.
77. Fox K. Guidelines of Management of Stable Angina Pectoris / Fox K., Garcia M.A., Ardissino D. et al // Europ. Heart J. - 2006. – Vol.27. – P.1341-1381.
78. Galasko G.I.W. A prospective comparison of echocardiographic wall motion and radionuclide ejection fraction in predicting outcome following acute myocardial infarction / Galasko G.I.W., Basu S., Lahiri A., et al. // Heart. - 2001. - Vol. 86. - P. 271-276.
79. Gandhi G.Y. Patient-important outcomes in registered diabetes trials / Gandhi G.Y., Murad M.H., Fujiyoshi A., et al. // JAMA. - 2008.- V. 299. - P. 2543-2549.
80. Gandi S.K. The pathogenesis of acute pulmonary edema associated with hypertension / Gandi S.K., Powers J.C., Nomeir A., et al. // N. Engl. J. Med. - 2001. - Vol. 344. - P. 17–60.
81. Garcia M.J. Color M-mode Doppler flow propagation velocity is a preload insensitive index of left ventricular relaxation / Garcia M.J., Smedira N.G., Greenberg N.L., et al. // J. Am. Coll. Cardiol. - 2000. - Vol. 35. - P. 201–208.
82. Garvey W.T. Effects of insulin resistance and type 2 diabetes on lipoprotein subclass particle size and concentration determined by nuclear magnetic resonance / Garvey W.T., Kwon S., Zheng D. et al. // Diabetes. – 2003. – Vol. 52. – P. 453-462.
83. Gottdiener J.S. Predictors of congestive heart failure in the elderly: the Cardiovascular Health Study / Gottdiener JS, Arnold AM, Aurigemma GP, et al. // J. Am. Coll. Cardiol. - 2004. - Vol. 35. - P. 1628–1637.
84. Gotto A.M. Jr. Contemporary Diagnosis and Management of Lipid Disorders. Second Edition, 2001.
85. Grossman W. Defining Diastolic Dysfunction // Circulation. - 2000. - Vol. 101. - P. 2020 - 2021.
86. Grundy SM, Cleeman JI, Merz CN et al. National Heart, Lung, and Blood Institute; American College of Cardiology Foundation; American Heart Association. Implications of recent clinical trials for the National Cholesterol Education Program Adult Treatment Panel III guidelines.// Circulation.- 2004. – Vol.110. – P.227–239.
87. Guazzi M. Exercise Intolerance in Rats With Hypertensive Heart Disease Is Associated With Impaired Diastolic Relaxation / Guazzi M., Brenner D.A., Apstein C.S., et al // Hypertension. – 2001. – Vol. 37. - P. 204 - 208.
88. Guidelines Committee. 2003 European Society of Hypertension–European Society of Cardiology guidelines for the management of arterial hypertension // J Hypertens.- 2003. – Vol. 21. – P. 1011–1053.
89. Guidelines on diabetes, pre-diabetes, and cardiovascular diseases: executive summary //European Heart Journal- 2007. – Vol. 28(1) -P. 88-136.
90. Haffner S.M. Mortality from coronary heart disease in subjects with type 2 diabetes and in nondiabetic subjects with and without prior myocardial infarction / M. Haffner, S. Lehto, Т. Ronnema et al. // N. Engl. J. Med.-1998.- Vol. 339.- P. 229-234.
91. Haffner S.M. Diabetes, hyperlihidemia, and coronary artery disease// Am. J. I Cardiol. 1999. - V.83.- P.17-21.
92. Haffner S.M. Effect of rosiglitazone treatment on nontraditional markers of cardiovascular disease in patients with type 2 diabetes mellitus / Haffner S.M., Greenberg A.S., Weston W.M. et al. // Circulation. – 2002. – Vol. 106. – P. 679-684.
93. Hamlin S.K. Role of Diastole in Left Ventricular Function, II. - P. Diagnosis and Treatment / Hamlin S.K., Villars P.S., Kanusky J.T., et al. // Am. J. Crit. Care. - 2004. - Vol. 13. - P. 453 - 466.
94. Hansson L. Effects of intensive blood pressure lowering and low-dose aspirin in patients with hypertension: principal results of the Hypertension Optimal Treatment (HOT) / Hansson L. //Trial. Lancet. - 1998. – Vol.351.- P. 1755–1762.
95. Hansson L. Randomised trial of effects of calcium antagonists compared with diuretics and β-blockers on cardiovascular morbidity and mortality in hypertension: the Nordic Diltiazem (NORDIL) study / Hansson L., Hedner T., Lund-Johansen P., et al. // Lancet. – 2000. – Vol. 356. – P. 359-65.
96. Hara M. Tue frontiers of diagnostic radiology –PET/CT, 3DCT. / Hara M., Oshima H // Nippon Geka Gakkai Zasshi. – 2005.-Nov.- Vol. 106(11).- P. 677-84.
97. Hart C.Y. Differential effects of natriuretic peptides and NO on LV function in heart failure and normal dogs / Hart C.Y., Hahn E.L., Meyer D.M., et al. // Am. J. Physiol. Heart Circ. Physiol. - 2001. - Vol. 281. - P. H146– H154.
98. Heart J. Recommendations of the Task Force of the European Soci¬ety of Cardiology. Management of stable angina pectoris // Eur. Heart J. - 2000. - Vol. 21. P. 394-413.
99. Heart J. C-reactive protein and the severity of atherosclerosis in myocardial infarction patients with stable angina pectoris / Heart J., Tataru M.C., Heinrich J., Junker R. et al.// Eur. Heart J.— 2000.— Vol. 21.-P. 1000-1008.
100. Heart rate variablity. Standarts of measurement, physiological interpretation and clinical use. Task force of the European Society of Cardiology and the North American Society of Pacing and Electrophysiology // Circulation. - 2002. - Vol. 83. - P. 1043-1065.
101. Hees P.S. MRI and echocardiographic assessment of the diastolic dysfunction of normal aging. - P. altered LV pressure decline or load? / Hees P.S., Fleg J.L., Dong S.-J., et al. // Am. J. Physiol. Heart Circ. Physiol. - 2004. - Vol. 286. - P. 782 - 788.
102. Hokanson, J.E. Lipoprotein Management in Patients With Cardiometabolic Risk. Consensus Conference Report From the American Diabetes Association and the American College of Cardiology Foundation // J Am Coll Cardiol, - 2008.- Vol.51.- P.1512-1524
103. Hokanson J.E. Plasma triglyceride level is а risk factor for cardiovascular disease independent of high-density lipoprotein cholesterol level: а meta-analysis of population-based prospective studies / Hokanson J.E., Austin M.A. // J Cardiovasc Risk. - 2006. - Vol. 3. - № 2. - P. 213-219.
104. Hurst R. Т., Lee R. W. Increased incidence of coronary atherosclerosis in type 2 diabetes mellitus: mechanisms and management / Hurst R. Т., Lee R. W. // Ann. Intern. Med.- 2003.- Vol. 139.- P. 824-834.
105. Huwer H. Model of chronic systolic and diastolic dysfunction after cryothermia-induced myocardial necrosis in rats / Huwer H., Winning J., Vollmar B., et al.// Comp. Med. - 2000. - Vol. 50(4). - P. 385-90.
106. Huxley R. Excess risk of fatal coronary heart disease associated with diabetes in men and women: meta-analysis of 37 prospective cohort stu dies / Huxley R., Barzi F, Woodward M. // BMJ.- 2006.- Vol. 332 № 7533.- P. 73-78.
107. Ilia R. Coronary colaterals in patients with normal and impaired left ventricular systolic function / Ilia R., Carmel S., Cafri C, Gueron V. // Int. J. Cardiol. 1998. - Vol. 63.2. - P. 151 -153.
108. Indovina A. Evaluation of heart dysfunction using non-invasive methods. A comparison between left ventricular end diastolic volume measured using blood pool gated radioisotope angiography and left ventricular transverse end diastolic diameter measured using two dimensional echocardiography // Minerva Cardioangiol. - 2000. - Vol. 48(6). - P. 149-54.
109. Jap J. Tada Hisaya, Kobayaschi Noriaki, Tzukamoto Masayoshi et al. //J. Jap. Diabet. Soc. 2000. - Vol.43.- №12.-P.1037-1041
110. Jenkins N.P. Beta-blockers are associated with lower C-reactive protein concentrations in patients with coronary artery disease / Jenkins N.P., Keevil B.C., Hutchinson I.V., Brooks N.H. // Am. J. Med.- 2002.- Vol. 112 (4).-P. 269-274.
111. Kalant D. Increased postprandial fatty acid trapping in subcutaneous adipose tissue in obese women / Kalant D., Phelis S., Fielding B.A. et al. // J. Lipid Res. – 2000. – Vol. 41. – P. 1963-1968.
112. Kane L.S. Doppler echocardiographic changes found in diastolic dysfunction / Kane L.S. // J. Insur. Med. - 2001. - Vol. 33(4). - P. 355-7.
113. Kass D.A. What Mechanisms Underlie Diastolic Dysfunction in Heart Failure? /Kass D.A., Bronzwaer J.G.F., Paulus W.J.// Circ. Res. - 2004. - Vol. 94. - P. 1533 - 1542.
114. Kitzman D.W. Diastolic dysfunction in the elderly. Genesis and diagnostic and therapeutic implications / Kitzman D.W. // Cardiol Clin. - 2000. - Vol. 18(3). - P. 597-617.
115. Kitzman D.W. For the CHS Research Group. Importance of heart failure with preserved systolic function in patients 65 years of age / Kitzman D.W., Gardin J.M., Gottdiener J.S., et al. // Am. J. Cardiol. - 2001. - Vol. 87. - P. 413– 419.
116. Kjaergaard S. C. Inhospital outcome for diabetic patients with acute myocardial infarction in the thrombolyticera / S. C. Kjaergaard, H. H. Hansen, L Fog, et al. // Scand. Cardiovasc. J.- 1999.- Vol. 33 – P. 166-70.
117. Kostin S. The cytoskeleton and related proteins in the human failing heart / Kostin S., Hein S., Arnon E., et al. // Heart Fail Rev. - 2000. - Vol. 5. - P. 271–280.
118. Kuralay E. Recovery of Left Ventricular Diastolic Function After Coronary Bypass Surgery / Kuralay E., Demirkiliç U., Özal E., et al.// Asian Cardiovasc. Thorac. Ann. - 1998. - Vol. 6. - P. 250 - 256.
119. Laufs U. Upregulation of endothelial nitric oxide synthase by HMG COA reductase inhibitors / Laufs U., La Fata V., Plutzky J. et al. // Circulation.- 1998, - Vol. 97.- P. 1129-1135.
120. Leite-Moreira A.F. Afterload induced changes in myocardial relaxation: a mechanism for diastolic dysfunction // Cardiovasc. Res. - 1999. - Vol. 43(2). - P. 344-53.
121. Lipscombe L.L. Thiazolidinediones and cardiovascular outcomes in older patients with diabetes / Lipscombe L.L., Gomes T., Levesque L.E., et al. //JAMA. -2007. - V. 298. - P. 2634-2643.
122. Little WC, Kitzman DW, Cheng C. Diastolic dysfunction as a cause of exercise intolerance / Little WC, Kitzman DW, Cheng C. // Heart Failure Rev. - 2000. - Vol. 5. - P. 301-306.
123. Lubsen J. Design and current status of ACTION: A Coronary disease Trial Investi¬gating Outcome with Nifedipine GITS / Lubsen J., Pool-Wilson P.A., Pocock S.J. et al.// Eur. Heart J. - 1998. Vol. 19. - Suppl. 1. - P. 20-32.
124. Luscher T.F. Endothelial dysfunction as therapeutic target // Eur. Heart J. - 2004. - Suppl D. - P. D20-D25.
125. Magadle R. C-reactive protein as а marker for active coronary artery disease in patients with chest pain in the emergency room / Magadle R., Weiner P., Beckerman M. et al. // Clin. CARDIOL- 2002.- Vol. 25 (10).- P. 456-460.
126. Maintz D 64-slice multidetector coronary CT angiography: in vitro evaluation of 68 different stents. Eur Radiol. 2006 Apr ;16(4):818-26.
127. Watkins L.O. Epidemiology and burden of cardiovascular disease // Clin. Cardiology. – 2004. – Vol. 27 (Suppl. 3). – P. 2-6.
128. Malmberg K. Impact of diabetes on long-term prognosis in patients with unstable angina and non-Q-wave myocardial infarction: results of the OASIS (Organization to Assess Strategies for Ischemic Syndromes) Registry/ K Malmberg, S., Yusuf, H. et al. // Circulation. - 2000. - Vol. 102. - P. 1014–1019.
129. Marks J.B., Raskin P. Cardiovascular risk in diabetes // J. Diabet. Complicat. – 2000. – Vol. 14. – P. 108-115.
130. Massalana A.J. Value of echocardiography and heart Doppler in the diagnosis and therapeutic orientation of congestive heart failure--the importance of diastolic dysfunction // Rev. Port. Cardiol. - 1998. - Vol. 17(1). - P. 93-100.
131. McCulloch A.C. Management of diastolic heart failure in older adults: Diagnosing diastolic dysfunction is complex // BMJ. - 2004. - Vol. 328. - P. 1378 - 1379.
132. McDermott M.M. Hospitalized congestive heart failure patients with preserved versus abnormal left ventricular systolic function: clinical characteristics and drug therapy / McDermott M.M., Feinglass J., Sy J., et al. // Am. J. Med.. 2000. - Vol. 104. - P. 629–635.
133. Mehlhorn U. Myocardial fluid balance / Mehlhorn U., Geissler H.J., Laine G.A., et al. // Eur. J. Cardiothorac. Surg. - 2001. - Vol. 20. - P. 1220 - 1230.
134. Mehta J.L. Interactive role of infection, inflammation and traditional risk factors in atherosclerosis and coronary artery diseasse / Mehta J.L., Saideen T.G., Rand K. // J. Am. Coll. Cardiol. - 2007. - Vol.60. № 6. - P.1217-122
135. Miettinen H. Impact of diabetes on mortality after the first myocardial infarction The FINMONICA Myocardial Infarction Register Study Group / H. Miettinen, S. Lehto, V. Salomaa et al. // Diabetes Care.- 1998.- Vol. 21 № i._ р. 69-75.
136. Miguel E. M. Diagnosis and treatment of diastolic ventricular dysfunction // Rev. Clin Esp. - 2001. - Vol. 201(10). - P. 582-5.
137. Mitu F. Clinical aspects of the left ventricular diastolic dysfunction at patients with coronary heart disease / Mitu F., Mitu M. // Rev. Med. Chir. Soc. Med. Nat. Iasi. - 2001. - Vol. 105(4). - P. 733-9.
138. Montori V.M. Systematic evaluation of the quality of randomized controlled trials in diabetes / Montori V.M., Wang Y. G., Alonso-Coello P., Bhagra S. // Diabetes Care. - 2006. - Vol.29. - P. 1833-1838.
139. Nagatomo Y. Differential effects of pressure or volume overload on myocardial MMP levels and inhibitory control / Nagatomo Y., Carabello B., Coker ML, et al. // Am. J. Physiol. Heart Circ. Physiol. - 2000. - Vol. 278. - P. H151– H161.
140. Nijiand F. Prognostic implications of restrictive LV filling in acute myocardial infarction: a serial Doppler echocardiographic study / Nijiand F., Kamp О., Karreman A.J.P., et al.// J. Am. Coll. Cardiol. - 2007. - Vol. 60. - P. 1618-1624.
141. Nishimura R.A. Evaluation of diastolic filling of left ventricle in health and disease: Doppler echocardiography is the clinician's Rosseta stone / Nishimura R.A., Tajik A.J.// J. Am. Coll. Cardiol. - 2007. - Vol. 60. - P. 8-18.
142. Nisson. Inflammation and cholesterol / Nisson., Ares M. P. S., Linddholm M. et al. // Europ. Heart.J. 2001. V.4 (Suppl.A). - P. 18-25.
143. O’Conner C.M. Clinical characteristics and long-term outcomes of patients with heart failure and preserved systolic function / O’Conner C.M., Gattis W.A., Shaw L., et al. // Am. J. Cardiol. - 2000. - Vol. 86. - P. 863–867.
144. Odemuyiwa O. Temporal influences on the prediction of postinfarction mortality by HRV: a comparison with LV ejection fraction / Odemuyiwa O., Poloniecki J., Malik M., et al. // Br. Heart J. - 1999. - Vol. 104. - P. 521 -527.
145. Ohte N. Striking effect of left ventricular systolic perfomance on propagation velocity of left ventricle early diastolic filling flow / Ohte N., Narita H., Kurokawa K., et al. // J. Am. Soc. Echocardiogr. - 2001. - Vol. 11. - P. 1070-1074.
146. Ommen S.R. Clinical utility of Doppler echocardiography and tissue Doppler imaging in the estimation of left ventricular filling pressures: a comparative simultaneous Doppler-catheterization study / Ommen S.R., Nishimura R.A., Appleton C.P., et al // Circulation. - 2000. - Vol. 102. - P. 1788–1794.
147. O'Rourke M.F. Diastolic heart failure, diastolic left ventricular dysfunction and exercise intolerance // J. Am. Coll. Cardiol. - 2001. - Vol. 38(3). - P. 803-5.
148. Otasevic P. Short early filling deceleration time on day 1 after acute myocardial infarction is associated with short and long term left ventricular remodeling / Otasevic P., Neskovic A.N., Popovic Z., et al. // Heart. – 2001. – Vol. 85. – P. 527 - 532.
149. Pepe S. Coenzyme Q10 in cardiovascular disease / Pepe S. et al. // Mitochondrion. – 2007. - Vol. 7. – P. 154–167.
150. Paulus W.J. Beneficial effects of nitric oxide on cardiac diastolic function: “the flip side of the coin” // Heart Failure Rev. - 2000. - Vol. 5. - P. 337–344.
151. Petrie M.C. Poor concordance of commonly used echocardiographic measures of left ventricular diastolic function in patients with suspected heart failure but preserved systolic function. - P. is there a reliable echocardiographic measure of diastolic dysfunction? /Petrie M.C., Hogg K., Caruana L., et al. // Heart. - 2004. - Vol. 90. - P. 511 - 517.
152. Pfeffer M.A. Ventricular remodeling after myocardial infarction: experimental observation and clinical implications / Pfeffer M.A., Braunwald E. // Circulation. - 2003. – Vol.109. – P.1161 — 1172.
153. Pierach C.A. Looking for Diastolic Dysfunction - Response / Pierach C.A., Zile M.R., Gaasch W.H., et al. // Circulation. - 2002. - Vol. 105. - P. 189.
154. Pinamonti B., di Lenarda A., Sinagra G.. Heart failure due to diastolic dysfunction. - P. the treatment principles // Ital. Heart J. Suppl. - 2000. - Vol. 1(4). - P. 469-80.
155. Poelaert J. Diagnosis of Diastolic Dysfunction. - P. Importance of Spectral Doppler Imaging • Response / Poelaert J., Denault A., Bernard F., et al. // Anesth. Analg. - 2002. - Vol. 94. - P. 1043 - 1045.
156. Poulsen S.H. Relationship between serum amino-terininal propeptide of type III procollagen and changes of left ventricular function after acute myocardial infarction / Poulsen S.H., Høst NB., Jensen S.E., et al. // Circulation. - 2000. - Vol. 101. - P. 1527-1532.
157. Poulsen S.H. Effects of long-term adrenergic beta-blockade on LV diastolic filling in patients with acute myocardial infarction / Poulsen S.H., Jensen S.E., Egstrup K. // Am. Heart J. - 1999. - Vol. 138. - P. 710-720.
158. Poulsen S.H. Longitudinal changes and prognostic implications of LV diastolic function in first acute myocardial infarction / Poulsen S.H., Jensen S.E., Egstrup K. // Am. Heart J. - 2003. - Vol. 141. - P. 910-918.
159. Poulsen S.H. Evaluation and prognostic significance of LV diastolic function assessed by Doppler echocardiography in the very early phase of a first myocardial infarction / Poulsen S.H., Jensen S.E., Gotzsche О., et al // Eur. Heart J. - 2006. - Vol. 27. - P. 1882- 1889.
160. Poulsen S.H. Prognostic value of left ventricle diastolic function with heart rate variability after first acute myocardial infarction / Poulsen S.H., Jensen S.E., Møller J.E., et al. // Am. J. Cardiol. - 2004. - Vol. 87(1). - P. 19-25.
161. Poulsen S.H. Prognostic implications of left ventricular diastolic dysfunction with preserved systolic function following acute myocardial infarction / Poulsen S.H., Møller J.E., Norager B., et al. // Cardiology. - 2001. - Vol. 95(4). - P. 190-7.
162. Pudil R. The effect of trimetazidine on C-reactive protein, cytokines and adhesion molecules in the course of acute myocardial infarction / Pudil R., Pidrman V, Krejsek J. et al. // Acta Medica (Hradec Kralove).— 2001- Vol. 44 (4).- P. 135-140.
163. Rahn K.H. The European Lacidipine Study on Atherosclero¬sis (ELSA): prevalence of baseline carotid and correlations with risk factors // J. Hypertens. - 1998. - Vol. 16. - Suppl. 9: - P. S31-S33.
164. Ramachandran S. Defining Diastolic Heart Failure // Circulation. - 2006. - Vol. 101. - P. 2118.
165. Reaven G.M. Role of insulin resistance in human disease //Diabetes. – 1988. – Vol. 37. – P. 1595-1607.
166. Ridker P.M. Comparison of C-reactive protein and low-density lipoprotein cholesterol levels in the prediction of first cardiovascular events Ridker P.M., Rifai N., Rose L. et al. // N. Engl. J. Med.- 2002.-Vol. 347.- P. 1557-1565.
167. Roe M.T. Patterns and prognostic implications of low high-density lipoprotein levels in patients with non-ST-segment elevation acute coronary syndromes / Roe M.T., F.S. Ou, K.P.Alexander, L.K. Newby, J.M. Foody// Eur. Heart J. - 2008. - Vol. 29. - P. 2480-2488
168. Turner R. З Risk factors for coronary artery disease in non-insulin dependent diabetes mellitus: United Kingdom Prospective Diabetes Study (UKPDS: 23) / R. З Turner, H. Millns, H. A. Neil et al. // BMJ.- 1998.- Vol. 316, J* 7134.- P. 823-828.
169. Rumberger J.A. Electron beam computed tomography coronary calcium scanning: а review and guidelines for use in asymptomatic persons. Mayo Clin Proc. 2000;V74 :P 243-252
170. Sakkinen P. C-reactive protein and myocardial infarction / Sakkinen P., Abbott R.D., Curb J.D. et al. // J. Clin. Epidemiol.- 2002.- Vol. 55.- P. 445-451.
171. Savage D.B. Human metabolic syndrome resulting from dominant-negative mutations in the nuclear receptor peroxisome proliferator-activated receptor-g / Savage D.B., Tan G.D., Acerini C.L. et al. // Diabetes. - 2003. - Vol. 52. - P. 910-917.
172. Schirmer H. Mitral flow derived Doppler indices of left ventricular diastolic function in a general population. The Tromsø study / Schirmer H., Lunde P., Rasmussen K.// Eur. Heart J. - 2000. - Vol. 21. - P. 1376 - 1386.
173. Shepherd J, Effect of lowering LDL cholesterol substantially below currently recommended levels in patients with coronary heart disease and diabetes: the Treating to New Targets (TNT) / Shepherd J, Barter P, Carmena R, Deedwania P, Fruchart JC, Haffner S, Hsia J, Breazna A, LaRosa J, Grundy S, Waters D.//Study. Diabetes Care 2006; 29:1220–1226.
174. Shutov A.M. Does E/A ratio correctly estimate diastolic dysfunction in patients with chronic renal failure? / Shutov A.M., Kondratyeva N.I., Kulikova E.S., et al. // Nephrol. Dial. Transplant. - 2000. - Vol. 15. - P. 1256 - 1257.
175. Singh S. Long- term risk of cardiovascular events with rosiglitazone: a meta-analysis / Singh S., Loke Y.K., Furberg C.D. // JAMA. - 2007. - Vol. 298. - P. V 189-1195.
176. Sjaastad I. Echocardiographic criteria for detection of postinfarction congestive heart failure in rats / Sjaastad I., Sejersted O.M., Ilebekk A., et al. // J. Appl. Physiol. - 2000. - Vol. 89. - P. 1445 - 1454.
177. Smiseth O.A. Atrioventricular filling dynamics, diastolic function and dysfunction / Smiseth O.A., Thompson C.R. // Heart Fail. Rev. – 2000. – Vol. 5(4). – P. 291-299.
178. Smith SC Jr, AHA/ACC Scientific Statement: AHA/ACC guidelines for preventing heart attack and death in patients with atherosclerotic cardiovascular disease: 2001 update: a statement for healthcare professionals from the American Heart Association and the American College of Cardiology./ Smith SC Jr, Blair SN, Bonow RO et al. //Circulation. 2006. – Vol.114 (10). –P.385–484.
179. Stavenow L. Influence of serum triglyceride levels on the risk for myocardial infarction in 12 510 middle aged males: interaction with serum cholesterol / Stavenow L., Kjellstrom T. // Atherosclerosis. – 1999. – Vol. 147 № 2. – P. 243-247.
180. Stein В. Influense of diabetes mellitus on early and outcome after PTCA / Stein В., Weintraub W., King S.// Circulation. - 2006. - Vol. 101. - P.2121-2126.
181. Steiner G. Risk factors for macrovascular disease in type 2 diabetes. Classic lipid abnormalities // Diabet. Care. 1999. Vol. 22 (Suppl 3). - P. 18-23.
182. Stout R.W. The adipoinsular axis: effects of leptin on pancreatic β-cells / Stout R.W. // Diabetes Care. – 2000, January. Vol. 278, Issu1, E1-E14.
183. Summary and content: Asymptomatic Diastolic Dysfunction: Common and Ominous // Journal Watch Cardiology. - 2003. - Vol. 2003. - P. 2.
184. Summary and content: How Common Is Diastolic Dysfunction? // Journal Watch (General). - 2003. - Vol. 2003. - P. 2.
185. Temeikova-Kurkischiev T. Subclinical inflammation in newly detecled type 2 diabetes and impaired glucose tolerance / Temeikova-Kurkischiev T., Henkel E., KOEHLERC. // Diabetologia. 2006. 49. №1. - 151 р.
186. The ALLHAT Officers and coordinators. Major cardiovascular events in hypertensive patients randomized to doxazosin vs chlorthalidone // JAMA. - 2000. - Vol. 283. - P. 1967-1975.
187. The Expert committee on the diagnosis and classification of diabetes mellitus. / Diabetes Care/-2003.- Vol. 26.-P.5-20.
188. Timmis A. D. Diabetic heart disease: clinical considerations // Heart.- 2005.- Vol. 89 № 4.- P. 463-469.
189. Tsuruta M. Hyperinsulinaemia as а predictor of hypertension: an 11-year follow-up study in Japan / Tsuruta M., Hashimoto R., Adachi H. et al. //J. Hypertension. – 2000. – Vol. 118. – P. 483-488
190. UK Prospective Diabetes Study (UKPDS) Group. Effect of intensive blood-glucose control with metformin on complications in overweight patients with type 2 diabetes (UKPDS 34) // Lancet.- 1998.- Vol. 352 № 9131- P. 854-865.
191. UK Prospective Diabetes Group. Tight blood pressure control and risk of macrovascular and microvascular complications in type 2 diabetes: UKPDS 38. BMJ 1998; 317:703-713.
192. Van de Werf F. Mangment of acute coronzry syndroms in patients presenting with persistent ST-segment elevation. / Van de Werf F., Ardissino D., Betriu A. // Eur.Heart J.- 2003. – N 24. – P. 28-66.
193. Varadarajan S.G. Changes in [Na+]i, compartmental [Ca2+], and NADH with dysfunction after global ischemia in intact hearts / Varadarajan S.G., An J., Novalija E., et al. // Am. J. Physiol. Heart Circ. Physiol. - 2001. - Vol. 280. - P. 280 - 293.
194. Varma N. Left ventricular diastolic dysfunction during demand ischemia. - P. rigor underlies increased stiffness without calcium-mediated tension. Amelioration by glycolytic substrate / Varma N., Eberli F.R., Apstein C.S. // J. Am. Coll. Cardiol. - 2005. - Vol. 37(8). - P. 2144-53.
195. Varma N. Mechanisms underlying ischemic diastolic dysfunction. - P. relation between rigor, calcium homeostasis, and relaxation rate / Varma N., Morgan J.P., Apstein C.S. // Am. J. Physiol. Heart Circ. Physiol. - 2003. - Vol. 284. - P. 758 - 771.
196. Vasan R.S. Defining diastolic heart failure: a call for standardized diagnostic criteria / Vasan R.S., Levy D. // Circulation. - 2000. - Vol. 101. - P. 2118–2121.
197. Wannamethee S. G. Cardio vascular disease incidence and mortality in older men with diabetes and in men with coronary heart disease / Wannamethee S. G., Shaper A. G., Lennon L // Heart.— 2004.— Vol. 90 № 12.- P. 1398-1403
198. Wexler L. Coronary artery calcification: pathophysiology, epidemiology, imaging methods and clinical implications // Circulation. – 2006. – Vol. 104. – P. 1175-1192.
199. Wintersperger B. Cardiac multidetector-row computed tomography: initial experience using 16 detector-row / Wintersperger B., Nikolaou K., Reiser M.F. // Crit. Rev. Comput. Tomography. – 2003. – Vol. 44. – P. 27-45.
200. Yip G.W.K. Leite-Moreira A.F., et al. Diastolic Dysfunction and Hypertension / Yip G.W.K., Sanderson J.E.// N. Engl. J. Med. - 2001. - Vol. 344. - P. 1401 - 1402.
201. Yokoyama H. et al. // Stroke – 2006. – Vol. 37. P. 2420.//17
202. Zanchetti A. Evaluating the benefits of an antihypertensive agent using trials based on event and organ damage the Systolic Hypertension in the Elderly Long-term Lacidipine (SHELL) trial and European Lacidipine Study on Athero¬sclerosis (ELSA) // J. Hypertens. - 1995. - Vol . 13. - Suppl 4. - P. S35-S39.
203. Young L.H., Wackers F.J.Th., Chyun D.A. et al. Cardiac Outcomes After Screening for Asymptomatic Coronary Artery Disease in Patients With Type 2 Diabetes: The DIAD Study: A Randomized Controlled Trial. JAMA. April 15, 2009;301(15):1547–1555.
204. Yusuf S., Ostergren J.B., Gerstein H.C. et al. Effects of Candesartan on the Development of а New Diagnosis of Diabetes Mellitus in Patients With Heart Failure. Circulation. July 5, 2005;112:48-53.
205. Tuomilehto J., Rastenyte D., Birkenhager W.H. for the Systolic Hypertension in Europe Trial Investigators. Effects of calcium-channel blockade in older patients with diabetes and systolic hypertension. Systolic Hypertension in Europe Trial Investigators // New Engl. J. Med. – 1999. – Vol. 340. – P. 677-684.
206. Hansson L., Zanchetti A., Carruthers S.G. for the HOT Study Group. Effects of intensive blood-pressure lowering and low-dose aspirin in patients with hypertension: principal results of the Hypertension Optimal Treatment (HOT) randomized trial // Lancet. – 1998. – Vol. 351. – P. 1755-1762.
207. Mancia G., Brown M., Castaigne A. et al. Outcomes with nifedipine GITS or co-amilozide in hypertensive diabetics and nondiabetics in intervention as a goal in hypertension (INSIGHT) // Hypertension. – 2003. – Vol. 41. – P. 431-436.
208. The ALLHAT Officers and Coordinators for the ALLHAT Collaborative Research Group. Major outcomes in high-risk hypertensive patients randomized to angiotensin-converting enzyme inhibitor or calcium channel blocker vs diuretic. The Antihypertensive and Lipid-Lowering Treatment to Prevent Heart Attack Trial (ALLHAT) // JAMA. – 2002. – Vol. 288. – P. 2981-2987.
209. Opie L.H., Schall R. Evidence-based evaluation of calcium channel blockers for hypertension: equality of mortality and cardiovascular risk relative to conventional therapy // J. Amer. Coll. Cardiology. – 2002. – Vol. 39. – P. 315-322.
210. Pahor M., Psaty B.M., Alderman M.H. et al. Health outcomes associated with calcium antagonists compared with other first-line antihypertensive therapies: a meta-analysis of randomized controlled trials // Lancet. – 2000. – Vol. 356. – P.1949-1954.
211. Kaplan N.M. Hypertension trials: 1990 to 2000 // Curr. Opin. Nephrol. Hypertension. – 2001. – Vol.10. – P. 501-505.
212. UK Prospective Diabetes Study Group: Tight blood pressure control and risk of macrovascular and microvascular complications in type 2 diabetes: UKPDS 38. Br Med J 1998; 317: 703–13.
213. Kjekshus J, Gilpin E, Gali G, et al. Diabetic patients and beta blockers after acute myocardial infarction. Eur Heart J 1990;11:43-50.
214. Fogari R, Zoppi A, Tettamanti F, et al. Beta-blocer effects on plasma lipids in antihypertensive therapy. J Cardiovasc Pharmacol 1990;16(Suppl. 5): 76-80.
215. Jonas M, Reicher-Reiss H, Boyko V, et al. Usefullness of beta-blocker therapy in patients with noninsulin dependent diabetes mellitus and coronary arthery disease. Bezafibrate infarction prevention (BIP) Study Groop. Amer J Cardiol 1996;77:1237.
216. Owada A, Suda S, Hata T, et al. The effect of bisoprolol, а selective beta1-blocker, on glucose metabolism by long-term administration in essential hypertension. Clin Exp Hypertens 2001;23: 305-16.
217. Weidman P. Metabolic profile of indapamide sustained-release in patients with hypertension: data from three randomized double-blind studies. Drug. Saf. 2001; 24 (15); 1155-1165.
218. Bulpitt C.J., Emeriau J.P., Knauf H. et al. Equivalence study of antihypertensive effect of indapamide sustained-release 1,5 mg, hydrochlortiazide 25 mg, and amlodipine 5 mg in hypertension. J. Hypertension 1997: 15 (suppl 4); 5130.
219. Grimm R.H. Jr: antihypertensive therapy: taking lipids into consideration. Av. Heart J 2001; 122; 910-918.
220. Gosse F., Shesidan D.J., Zannd F. et al. Regression of left ventricular hypertrophy in hypertensive patients treated with indapamide SR 1,5 mg versus enala-pril 20 mg: thr LIVE study. J. Hypertension 2000: 18 (10); 1465-1475.
221. Ambrosioni E. Low-dose antihypertensive therapy with 1,5 mg SR indapamide: results of randomized double-blind controlled studies. . J. Hypertension 1998: 19; 1677-1684.
222. Robins S.J. Fibrates and coronary heart disease reduction in diabetes. Curr Opin Endocrinol Diabet 2002;9:312-322.
223. Fruchart J.C., Staels Ст, Duriez P. PPARS, metabolic disease and atherosclerosis. Pharmacol Res 2001;44:345-352.
224. Kirchgassler K.U., Schmit H., Bachh G. Ефективність і переносимість 12-тижневої терапії микронизированным фенофибратом (200 міліграм в добу). Clin Drug Invest 1998;15:3:197-204.
225. Косматова О.В., Перова Н.В., Мамедов М.Н. Ефективність поєднаної корекції артеріальної гіпертонії і гіперліпідемії при метаболічному синдромі. Зростав кардиол журн 2001;6:38-43.
226. Vakkilainen J., Steiner G., Ansquer J.C. et al. Relationships between low-density lipoprotein particle size, plazma lipoproteins and progression of coronary artery disease: the Diabetes Atherosclerosis Intervention Study (DAIS). Circulation 2003;107:1733-1737
227. The FIELD study investigators. Effects of long-term fenofibrate therapy on cardiovascular events in 9795 people with type 2 diabetes mellitus (the FIELD study): randomized controlled trial. Lancet 2005;366:1849-1861.