
 Какой статин идеально подходит пациентам при необходимости комплексного лечения?
Какой статин идеально подходит пациентам при необходимости комплексного лечения?*
Borghi C., Cicero A.F.G
Департамент медицины, возрастных изменений и клинической нефрологии Болонского университета, Италия
Ключевые слова: дислипидемия, снижение уровня липидов, липопротеин низкой плотности, комплексная терапия, статины, питавастатин.
Статины широко используют в лечении сердечно-сосудистых заболеваний (ССЗ), поскольку они улучшают профиль липидов, а также снижают риск возникновения ишемической болезни сердца и нарушений кровообращения головного мозга.
В последние 15 лет, в связи с увеличением числа пациентов, у которых выявляют несколько сопутствующих заболеваний, общий профиль риска применения статинов, существенно изменился и усложнился. Дислипидемия действительно часто осложняется артериальной гипертензией, сахарным диабетом, метаболическим синдромом, а также ССЗ и почечной недостаточностью.
Идеальный для таких пациентов статин должен обладать свойствами, позволяющими одновременно улучшать профиль липидов и снижать общий риск возникновения ССЗ. В частности, такой препарат должен обеспечивать снижение общего уровня холестерина (ХС), а также ХС липопротеинов низкой плотности (ЛПНП) и повышение уровня ХС липопротеинов высокой плотности (ЛПВП). Этим требованиям соответствует питавастатин.
Клиническая эффективность идеального статина должна быть подтверждена результатами исследования с большим числом пациентов из разных групп риска возникновения ССЗ. Исследования должны предусматривать первичную и вторичную профилактику. Идеальный статин должен быть эффективным в лечении пациентов по поводу дислипидемии при наличии дополнительных факторов риска (в частности, гипергликемии, метаболического синдрома).
С точки зрения безопасности идеальный гиполипидемический препарат характеризуется низким уровнем взаимодействия с другими лекарственными средствами, что особенно важно для пациентов, которым показано комплексное лечение. В отличие от других статинов, питавастатин не вступает в реакцию с цитохромом Р450 3А4, вследствие чего вероятность взаимодействия препарата с другими достаточно мала.
Применение питавастатина способствует улучшению функций сердечно-сосудистой системы и почек (улучшению диастолической функции, снижению протеинурии); снижению риска возникновения ССЗ и контролю уровня липидов в крови.
С тех пор как статины были включены в курс лечения, направленный на снижение уровня холестерина в крови, их применение связывают со снижением риска возникновения ССЗ. Результаты проведенного в 2005 г. мета-анализа 14 клинических исследований, в которых приняли участие до 90 000 пациентов, показали, что включение статинов в курс терапии приводит к уменьшению уровня ХС ЛПНП на 1,0 ммоль/л и способствует пропорциональному уменьшению частоты тяжелых сосудистых осложнений (острая коронарная недостаточность, нелетальный инфаркт миокарда, коронарная реваскуляризация, инсульт) на 20% [1]. По данным более позднего мета-анализа результатов 26 исследований, проведенных методом случайной выборки, в которых приняли участие 170 000 пациентов, более интенсивное снижение уровня ХС ЛПНП под влиянием статинов во многих ситуациях предотвращает возникновение ССЗ [2]. Действительно, снижение уровня ХС ЛПНП на 1,0 ммоль/л способствовало уменьшению частоты сердечных приступов, реваскуляризации и ишемического инсульта более чем на 20% в год.
Пациентам, применяющим гиполипидемические препараты, часто назначают и другие лекарственные средства для лечения сопутствующих заболеваний. Основными категориями пациентов, которым назначают комплексное лечение, являются:
• пациенты пожилого возраста (составляют 13–15% населения, применяют 30% лекарственных средств)
• пациенты, страдающие ССЗ (ишемической болезнью сердца, застойной сердечной недостаточностью и др.)
пациенты, у которых диагностируют сопутствующие заболевания, кроме ССЗ (например, хронические обструктивные заболевания легких)
• пациенты, у которых выявляют сахарный диабет
• пациенты, у которых выявляют многочисленные факторы риска
• пациенты, занимающиеся самолечением (использующие препараты, отпускаемые без рецепта).
T. Schuler и соавторами [3] проведено проспективное систематическое исследование, направленное на изучение взаимосвязи между различными факторами и применением комплекса препаратов в клиниках Австрии. Обследованы пациенты пожилого возраста с различными болезнями внутренних органов. Основными факторами, требовавшими применения комплекса препаратов являлись: женский пол, потребность в уходе, комплексный диагноз при выписке из стационара, высокие показатели по шкале коморбидности Карлсона. В частности, в исследовании установлено, что наличие таких сопутствующих заболеваний, как артериальная гипертензия, сахарный диабет, почечная недостаточность, хроническое обструктивное заболевание легких, требует назначения большого количества препаратов.
По данным A. Linton и соавторов [4], количество препаратов, применяемых пациентами, увеличивается с возрастом. Пациент вынужден применять по 5–6 препаратов разных групп. В исследование включены 126 000 участников программы здравоохранения TRICARE министерства обороны США в возрасте старше 65 лет. Женщины применяли больше препаратов, чем мужчины (Р < 0,001). Пациентам пожилого возраста чаще выписывали препараты по поводу ССЗ. Пациентам, которым назначали сердечно-сосудистые средства, в общем применяли больше препаратов. Как и ожидалось, при увеличении количества препаратов наблюдали линейное повышение риска взаимодействия между ними. Следовательно, при выборе лекарственных средств для пациентов, которым показан курс комплексного лечения, следует учитывать вероятность взаимодействия между препаратами. В связи с этим, препараты, отличающиеся низкой способностью к взаимодействию, назначают чаще.
При выборе идеального статина для пациента, применяющего несколько лекарственных средств, врач должен учитывать ряд ключевых факторов:
• обоснованные клинические показания
• высокая эффективность при минимальной дозе
• влияние на весь профиль липидов
• низкая способность к взаимодействию с другими препаратами
• дополнительные клинически значимые свойства. Питавастатин обладает всеми этими характеристиками. Цель данной статьи – рассмотреть каждый из перечисленных факторов и привести доказательства более высокой эффективности питавастатина по сравнению с другими подобными препаратами.
ОБОСНОВАННЫЕ КЛИНИЧЕСКИЕ ПОКАЗАНИЯ И ВЫСОКАЯ ЭФФЕКТИВНОСТЬ ПРИ МИНИМАЛЬНОЙ ДОЗЕ
Способность питавастатина снижать уровень ХС ЛПНП в крови общепризнана [5]. По данным систематического обзора и мета-анализа, в которых сравнивали эффективность 6 статинов, применяемых для снижения уровня ХС ЛПНП, все препараты продемонстрировали терапевтическую эффективность в сопоставимых дозах [6]. Более того, применение аторвастатина и розувастатина не более 20 мг в сутки способствовало снижению уровня ХС ЛПНП более чем на 40%. Эффективность питавастатина зависит от дозы. При введении 2 или 4 мг питавастатина уровень ХС ЛПНП снижается более чем на 40% [5], действие питавастатина сопоставимо с таковым аторвастатина и розувастатина.
Влияние препарата наблюдают у значительной части пациентов, при этом уровень ХС ЛПНП в крови достигает целевого значения [7]. С клинической точки зрения сопоставимость эффективности питавастатина и аторвастатина представляет интерес при их назначении пациентам, которым показано комплексное лечение.
Более того, в исследовании действия питавастатина и аторвастатина у 252 больных при остром коронарном синдроме, проведенном в Японии (JAPANACS) [8], установлено, что питавастатин в дозе 4 мг и аторвастатин в дозе 20 мг существенно снижают уровень ХС ЛПНП и количество тромбоцитов в сроки наблюдения 12 мес. Применение 4 мг питавастатина (у 125 больных) или 20 мг аторвастатина (у 127 больных) способствовало снижению уровня ХС ЛПНП соответственно на (36,2 ± 19,5) и (35,8 ± 22,9)%; количество тромбоцитов уменьшилось соответственно на (16,9 ± 13) и (18,1 ± 14,2)%. Результаты исследования свидетельствуют, что снижение уровня ХС ЛПНП под влиянием питавастатина способствует предотвращению прогрессирования атеросклероза. Примечательно, что степень уменьшения агрегации тромбоцитов в венечных артериях при применении статинов (питавастатина или аторвастатина), оказалось существенно меньше (Р < 0,001) у больных при остром коронарном синдроме и сахарном диабете (n = 74), чем у пациентов без диабета (n = 178), хотя различия между группами снижения уровня ХС ЛПНП недостоверны [9].
Установлена также эффективность питавастатина в отношении снижения уровня ХС ЛПНП у больных при дислипидемии и сахарном диабете II типа. В исследовании S. Nomura и соавторов [10] получены результаты, сходные с таковыми исследования JAPAN-ACS: снижение уровня ХС ЛПНП практически одинаково как у больных сахарным диабетом, так и без такового. Применение питавастатина в дозе 2 мг в сутки способствовало существенному (Р < 0,001) снижению уровня ХС ЛПНП через 3 и 6 мес по сравнению с исходным уровнем, у 75 пациентов при гиперлипидемии, не зависимо от наличия сахарного диабета.
К тому же, у больных сахарным диабетом II типа под влиянием питавастатина существенно увеличилось содержание адипонектина по сравнению с исходным – (2,81 ± 0,95) мкг/мл, через 3 мес – до (3,84 ± 0,84) мкг/мл, через 6 мес – до (4,61 ± 1,15) мкг/мл (Р < 0,001). Также через 6 мес применения питавастатина наблюдали существенное снижение уровня sE-селектина – с (74 ± 21) до (51 ± 10) нг/мл; (Р < 0,05) и sL-селектина – с (896 ± 141) до (814 ± 129) нг/мл (Р < 0,05). Результаты исследования показали, что питавастатин не только снижает уровень общего ХС и ХС ЛПНП, но и влияет на уровень адипонектина и предотвращает прогрессирование атеросклероза у больных при гиперлипидемии и сопутствующем диабетом II типа.
Более того, у пациентов при сахарном диабете II типа применение питавастатина в течение 3 мес не оказывало негативного влияния на контроль уровня глюкозы в крови, в то время как под влиянием аторвастатина гликемический контроль ухудшался [11]. При применении питавастатина 2 мг/сут или правастатина 10 мг/сут в течение 3 мес не выявлены существенные изменения контроля уровня глюкозы в крови (уровня глюкозы натощак и гликозилированного гемоглобина – HbA1c), тогда как при применении аторвастатина 10 мг/сут отмечено существенное (Р < 0,001) повышение этих показателей. Различие влияния препаратов на контроль уровня глюкозы в крови у больных при дислипидемии и сопутствующем сахарном диабете имеют важное значение, так как могут непосредственно влиять на состояние этих пациентов. Больные, у которых диагностируют дислипидемию и сопутствующий диабет, составляют наиболее многочисленную категорию пациентов, которым проводят комплексное лечение [11].
ВЛИЯНИЕ НА ПРОФИЛЬ ЛИПИДОВ
Идеальный статин должен не только снижать уровень ХС ЛПНП в крови, но и обладать широким спектром действия на все атерогенные липиды, выявленные по данным липидограммы. Это ключевое свойство характерно для многих статинов, в том числе питавастатина.
В исследовании, проведенном в Японии, больным при гиперхолестеринемии в течение 12 нед назначали питавастатин в различных дозах. Установлено, что применение питавастатина в дозе 4 мг/сут способствовало снижению общего уровня ХС, ХС ЛПНП и триглицеридов, а также повышению уровня ХС ЛПВП (рис. 1) [12].
Более того, у больных при первичной гиперхолестеринемии и комбинированной дислипидемии при назначении 1–2 мг питавастатина или 10–20 мг аторвастатина в сутки отмечено благоприятное влияние на весь профиль липидов [7]. Уровень общего ХС, ХС ЛПНП и триглицеридов снижался по сравнению с исходным соответственно на 21–32, 30–45 и 10–30%. Как и высокий уровень ХС ЛПНП, низкий уровень ХС ЛПВП значительно повышает риск возникновения сердечно-сосудистых осложнений у пациентов при комплексных ССЗ, которым проводят комплексное лечение. Следует подчеркнуть, что в исследованиях доказана способность питавастатина стабильно повышать уровень ХС ЛПВП на 3–10% [7].
НИЗКАЯ СПОСОБНОСТЬ К ВЗАИМОДЕЙСТВИЮ
С ДРУГИМИ ПРЕПАРАТАМИ
Для пациентов, которым проводят комплексное лечение, низкая способность к взаимодействию с другими лекарственными средствами является одним из важнейших свойств идеального статина. Учитывая благоприятный метаболический профиль питавастатина, в частности, отсутствие взаимодействия с цитохромом Р450 3А4, низкая способность препарата к взаимодействию с другими лекарственными средствами общепризнана [5, 13, 14]. Действительно, питавастатин можно считать статином с самым низким потенциалом взаимодействия с другими препаратами.
За исключением циклоспорина и эритромицина, фармакокинетический профиль питавастатина не взаимодействует в клинически существенной мере со многими препаратами, которые обычно назначают пациентам при комплексном лечении. Более того, питавастатин не оказывает клинически существенного влияния на многие препараты, которые выписывают пациентам [15].
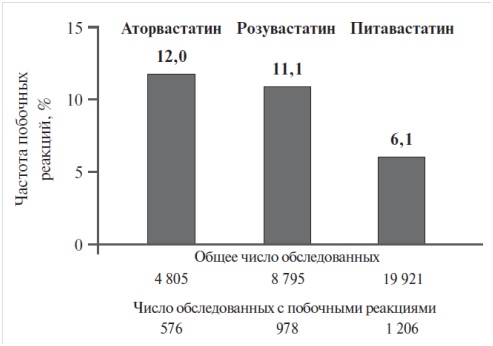
Благодаря низкому потенциалу взаимодействия при применении питавастатина сравнительно реже возникают побочные реакции, чем при назначении других статинов. При наблюдении за пациентами которым в течение 3 мес назначали аторвастатин [16], розувастатин [17] и питавастатин [18], отмечено, что питавастатин наименее часто вызывал неблагоприятные побочные реакции (рис. 2).
Безопасность питавастатина дополнительно подтверждена в исследовании его эффективности и безопасности LIVES, в котором приняли участие более 19 000 пациентов. Продолжительность наблюдение 2 года. При применении питавастатина в сочетании с другими лекарственными средствами, которые часто назначают пациентам по поводу ССЗ и/или сахарного диабета, отмечено уменьшение риска возникновения неблагоприятных реакций. При отсутствии питавастатина в комплексе лечения риск возникновения нежелательных реакций увеличивался. При применении питавастатина не наблюдали существенного взаимодействия с другими препаратами [19].
Рис. 1. Влияние питавастатина на профиль липидов у пациентов при первичной гиперхолестеринемии Пациентам назначали по 1 мг (n = 81), 2 мг (n = 75) или 4 мг (n = 76) питавастатина в сутки в течение 12 нед. Приведено по данным исследования, проведенного в Японии [12].
Таблица. Плейотропные свойства питавастатина
|
Свойства
|
Целевая группа больных
|
|
Существенно снижает уровень ХС ЛПНП при применении в малых дозах
|
Сложные в лечении пациенты, которым показаны интенсивная терапия и постоянное врачебное наблюдение
|
|
Стабильно повышает уровень ХС ЛПВП
|
Пациенты при низком уровне ХС ЛПВП
|
|
Улучшает весь профиль липидов
|
Пациенты при высоком риске возникновения сердечно-сосудистых осложнений
|
|
Ослабляет действие маркеров воспаления
|
Пациенты с воспалительными ССЗ
|
|
Имеет низкий потенциал взаимодействия с другими препаратами
|
Пациенты, которым показано комплексное лечение
|
|
Улучшает функцию эндотелия/антиоксидантные функции
|
Пациенты, у которых выявлена эндотелиальная дисфункция
|
|
Имеет высокий профиль безопасности
|
Пациенты, у которых могут возникнуть побочные реакции
(пожилого возраста, необходимость проведения комплексного лечения, интенсивной терапии с применением больших доз препаратов)
|
|
Стабилизирует/уменьшает количество тромбоцитов
|
Пациенты при остром коронарном синдроме
|
|
Противодействует ожирению/улучшает метаболизм глюкозы
|
Больные при сахарном диабете, при резистентности к инсулину, ожирении
|
|
Улучшает функцию почек
|
Пациенты с почечной дисфункцией
|
![Рис. 2. Частота возникновения нежелательных побочных реакций (НПР) при применении различных статинов Данные приведены по итогам исследования с применением аторвастатина [16], розувастатина [17] и питавастатина [18] в течение 3 мес. Рис. 2. Частота возникновения нежелательных побочных реакций (НПР) при применении различных статинов Данные приведены по итогам исследования с применением аторвастатина [16], розувастатина [17] и питавастатина [18] в течение 3 мес.](/Data/Sites/1/a-reklama/recordati/pitavostatyn-2.jpg)
Рис. 2.
Частота возникновения нежелательных побочных реакций (НПР) при применении различных статинов
Данные приведены по итогам исследования с применением аторвастатина [16], розувастатина [17] и питавастатина [18] в течение 3 мес.
ДОПОЛНИТЕЛЬНЫЕ КЛИНИЧЕСКИ ЗНАЧИМЫЕ СВОЙСТВА
Идеальный статин, который применяют в комплексе лечения, должен не только благоприятно влиять на весь профиль липидов, но и обладать дополнительными (плейотропными) свойствами, имеющими значение с клинической точки зрения для конкретных групп пациентов (например, при почечной дисфункции, сердечной недостаточности и др.). В таблице приведены некоторые плейотропные свойства питавастатина (обобщенные Y. Saito [13]).
По данным исследования LIVES, применение питавастатина в сроки наблюдения 2 года способствовало существенному (Р < 0,001) увеличению скорости клубочковой фильтрации по сравнению с исходной у пациентов при почечной дисфункции [20]. Аналогичный эффект наблюдали у больных сахарным диабетом и почечной недостаточностью разной степени тяжести через 12 и 52 нед лечения с применением питавастатина [21]. Более того, при применении 4 мг питавастатина наблюдали улучшение функции почек, сравнимое с таковым при назначении аторвастатина в дозах 20 или 40 мг. Важность этого наблюдения очевидна, если учесть, что аторвастатин сегодня считают одним из наиболее эффективных нефропротективных статинов.
Питавастатин также оказывал благоприятное влияние у пациентов при сердечной недостаточности. У 23 больных при застойной сердечной недостаточности назначение 1–2 мг питавастатина в течение (7,5 ± 3,8) мес способствовало существенному (Р = 0,002) увеличению фракции выброса левого желудочка (ФВЛЖ): перед началом исследования она составляла (42 ± 11)%, на момент его завершения – (48 ± 13)% [22]. Увеличение ФВ ЛЖ наблюдали независимо от наличия у пациентов ишемической болезни сердца (Р = 0,036) или ее отсутствия (Р = 0,017). Более того, увеличение ФВ ЛЖ у больных при сердечной недостаточности сопровождалось существенным снижением уровня мозговых натрийуретических пептидов в плазме крови, от исходного уровня (94 ± 78) пг/мл до (70 ± 56) пг/мл – на момент завершения исследования (Р = 0,005). Хотя в исследовании принимали участие не так много пациентов, результаты свидетельствуют, что питавастатин эффективно уменьшает выраженность дисфункции ЛЖ у больных при сердечной недостаточности, сопровождающейся гиперлипидемией. В настоящее время проводится более масштабное исследование влияние питавастатина на таких пациентов, чтобы установить роль препарата в улучшении их состояния.
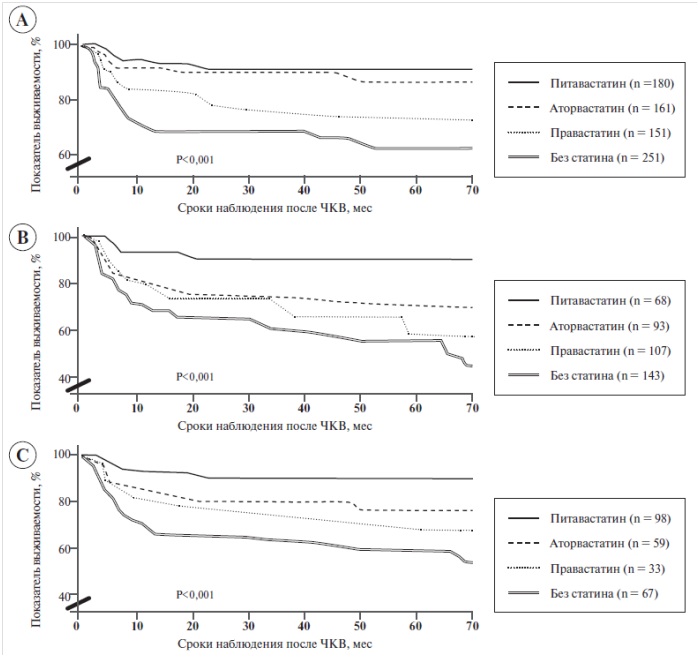
Рис. 3. Анализ Каплана–Мейера для кардиологических осложнений у пациентов, которым назначали питавастатин, правастатин, аторвастатин или лечение без статинов
Составлен на основе результатов исследования CIRCLE.
А – пациенты четырех терапевтических групп; В – пациенты, у которых применяли непокрытые металлические стенты; С – пациенты, у которых применяли стенты с лекарственным покрытием.
Эффективность статинов в снижении уровня ХС ЛПНП и повышении уровня ХС ЛПВП различна. Сегодня недостаточно доказательств, что она влияет на риск возникновения кардиологических осложнений. Ретроспективное исследование, проведенное в Японии (CIRCLE) [23], было посвящено сравнительному влиянию статинов (правастатина, аторвастатина и питавастатина) на уровень липидов в сыворотке крови, а также оценке взаимосвязи между степенью этих изменений и риском кардиологических осложнений у 743 пациентов после чрескожного коронарного вмешательства, т. е. у типичной группы пациентов, которым показано комплексное лечение. Как и ожидалось, по сравнению с курсом лечения, не включавшем статины, уровень ХС ЛПНП существенно снизился при применении правастатина – на (-23,7 ± 15,7)%, аторвастатина – на (-32,8 ± 14,4)% и питавастатина – на (-34,2 ± 16,6)%; (Р < 0,001). При лечении без статина уровень ХС ЛПНП повысился на (5,3 ± 21,4)%. Уровень ХС ЛПВП несущественно увеличился при применении правастатина на (5,4 ± 25,4)%; (Р > 0,99) и аторвастатина – на (7,0 ± 23,8)%; (Р = 0,83), после применения питавастатина уровень ХС ЛПВП существенно повысился на (13,4 ± 22,9)%; (Р = 0,01).
Анализ показателей выживаемости Каплана– Мейера, составленный на основе этих результатов, отражает влияние трех статинов на частоту возникновения тяжелых сердечно-сосудистых осложнений (рис. 3). Данные свидетельствуют, что питавастатин оказывает на пациентов существенно более благоприятное влияние, чем два других статина [23].
ВЫВОДЫ
Улучшение профиля липидов – цель терапии многих пациентов, которым проводят комплексное лечение. Питавастатин способствует улучшению профиля липидов у пациентов при гиперхолестеринемии или комбинированной дислипидемии, особенно при низком уровне ХС ЛПВП. Уникальный метаболический профиль питавастатина обеспечивает низкий риск взаимодействия с другими препаратами, сводя к минимуму частоту нежелательных реакций и риск неадекватного лечения. Эта особенность очень важна для пациентов, которым проводят комплексное лечение, а их число в последнее время значительно увеличилось.
В дополнение к благоприятному влиянию на профиль липидов, питавастатин обладает дополнительными свойствами, позволяющими ему позитивно влиять в сложных клинических ситуациях, способствуя улучшению исхода болезни у «сложных» пациентов.
Хотя веские доказательства принадлежности питавастатина к идеальным статинам находятся в стадии накопления, все имеющиеся данные о его свойствах подтверждают это предположение.
СПИСОК ЛИТЕРАТУРЫ
1. Cholesterol Treatment Trialisrs’ (CTT) Collaborators. Efficacy and safety ol cholesterol-lowering treatment: prospective meta-analysis of data from 90,056 participants in 14 randomised trials of statins. Lancet 366, 1267–1278 (2005).
2. Cholesterol Treatment Trialists’ (CTT) Collaboration. Efficacy and safety of more intensive lowering ol LDL cholesterol: a metaanalysis of data from 170,000 participants in 26 randomised trials of statin. Lancet 366, 1267–1278 (2005).
3. Schuler J., Duckelmann C., Beindl W., Prinz E. at all. Polypharmacy and inappropriate prescribing in elderly internal-medicine patients in Austria. Wien Klin. Wochenschr. 120, 733-741 (2008).
4. Linton A., Garber M., Fagan N.K., Peterson M.R. Examination ol multiple medication use among TRICARE beneficiaries aged 65 years and older. / Manag. Care Pharm. 13. 155–162 (2007).
5. Mukhtar R.Y., Reid J., Reckless J.P. Pitavastatin. Int. J. Clin. Pract. 59, 239–252 (2005).
6. Weng T.C. Yang Y.H., Lin S.J., Tai S.H. A systematic review and meta-analysis on the therapeutic equivalence of statins. J. Clin. Pharm. Ther. 35, 139–151 (2010).
7. da Silva P.M. Are all statins the same?: Focus on the efficacy and tolerability of pitavastatin. Am. J. Cardiovasc. Drug, 11, 93–107 (2011).
8. Hiro T., Kimura T., Morimoto T. et al. Effect of intensive statin therapy on regression of coronary atherosclerosis in patients with acute coronary syndrome: a multicenter randomized trial evaluated by volumetric intravascular ultrasound using pitavastatin versus atorvastatin (JAPAN-ACS (Japan assessment of pitavastatin and atorvasiatin in acute coronary svndrome study). J. Am. Coll. Cardiol. 54, 293–302 (2009).
9. Hiro T., Kimura T., Morimutu T. et al. Diabetes mellitus is a major negative determinant of coronary plaque regression during statin therapy in patients with acute coronary syndrome – serial intravascular ultrasound observations from the Japan Assessment of Pitavastatin and Atorvastatin in Acute Coronary Syndrome Trial (the JAPAN-ACS Trial). Circ. J. 74, 1165–1174 (2010|.
10. Nomura S., Shouzu A. Omoto S. et al. Correlation between adiponectin and reduction of cell adhesion molecules after pitavastatin treatment in hyperlipidemic patients wiih Type 2 diabetes mellitus. Thromb. Res. 122, 39–45 (2008).
11. Yamakasava T., Takano T., Tanaka S., Kadonosono K., Terauchi Y. Influence of pitavastatin on glucose tolerance in patients with type 2 diabetes mellitus. J. Atheroscler. Thromb. 15, 269–275 (2008).
12. Saito Y., Yamada N., Teramoto T. at al. Clinical efficacy of pitavastatin, 3 new 3-hydroxy-3-methylglutaryl coenzyme A reductase inhibitor, in patients with hyperlipidemia. Dose-finding study using the douhle-blind, three-group parallel comparison. Arzneimittelforschnung 52. 251–255 (2002).
13. Saito Y. Critical appraisal of the role of pitavastatin in treating dyslipidemias and achieving lipid goals. Vasc. Health Risk Manag. 5, 921–936 (2009).
14. Ose L. Pitavastatin: a distinctive lipid-lowering drug. Clin. Lipidol. 5, 309–323 (2010).
15. Corsini A., Ceska R. Drug-drug interactions with statins: will pitavastatin overcome the statins’ Achilles’ heel? Curr. Med. Res. Opin. 27. 1551–1562 (2011).
16. Komano N., Masaki M., Kawai H., Kubota Y., Kaijura T. The safety and efflicacy in post-marketing surveys of atorvastatin. Prog. Med. 25, 131–142 (2005).
17. Yoshida S. Crestor. Safely and efficacy in clinical experience investigation [in Japanese].Prog. Med. 27. 1159–1189 (2007).
18. Kurihara Y., Douzono T., Kawakita K. A large-scale, prospective post-marketing surveillance of pitavastatin (LIVALO® Tablet) – drug use investigation [in Japanese]. Jpn. Pliarmacol. Ther. 5, 9–40 (2007).
19. Kurihara Y., Douzono T., Kawakita K., Nagasaka Y. A large-scale, long-term, prospective postmarketing surveillance ol pitavastatin (LIVALO® Tablet) – LIVALO Effectiveness and Safety (LIVES) Study. Jpn. Pharmacol, Ther. 36, 709–731 (2008).
20. Kimura K., Shimaino H., Yokote K., Urashima M., Teramoto T. Effects of pitavastatine (LIVALO® Tablet) on the estimated glomerular filtration rate (eGFR) in hypercholcstcrolemic patients with chronic kidney disease. Sub-analysis of the LIVALO Effectiveness and Safety (LIVES) Study. Atheroscler. Thromb. 17, 601–609 (2010).
21. Gumprecht J., Gosho M., Budinski D., Hounslow N. Comparative long-term efficacy and tolerability of pitavastatin 4 mg and atorvastatin 20-40 mg in patients with Type 2 diabetes mellitus and combined (mixed) dyslipidaemia. Diabetes Obes. Metab. 13, 1047–1055 (2011).
22. Aoyagi T., Nakamura E. Tomaru T., Toyo-Oka T. Beneficial effects ol pitavastatin, a 3-hydroxy3-methylglutaryl coenzyme a reductase inhibitor, on cardiac function in ischemic and nonischemic heart failure. Int. Heart J. 49, 49–58 (2008).
23. Maruyama T., Takada M., Nishibori Y. at al. Comparison of preventivs efflect on cardiovascular events with different statins: the CIRCLE study. Circ. J. 75, 1951–1959 (2011).
* Clin. Lipidol. – 2012. – V. 7, N3, suppl. 1. – P. 11–16.